2. 广西白云山盈康药业有限公司, 广西南宁 530022;
3. 广西医科大学, 广西南宁 530022
2. Guangxi Baiyunshan Yingkang Pharmaceutical Co., Ltd., Nanning, Guangxi, 530022, China;
3. Guangxi Medical University, Nanning, Guangxi, 530022, China
血虚证是中医临床常见症候,表现为血液不足或者血液营养功能低下、脏腑组织器官失养的病理状态,主要原因包括失血过多、脾胃虚弱、血液生化之源不足、瘀血阻滞、新血不生[1]。
九味补血口服液是在经典名方基础上按照传统中医药学理论以及广西壮医药专家多年临床用药经验,以广西特有草药绞股蓝(Gynostemma pentaphyllum)配以人参(Panax ginseng)、黄芪(Astragalus membranaceus)等9味中药组方,具益气补血、健脾益胃之功效,用于气血两虚所致的失眠健忘、心悸怔忡、神疲乏力、短气自汗、纳呆食少诸证[2],临床已应用多年,具有良好的治疗效果。王婉莹等[3]的研究表明,人参具有补脾益肺、大补元气之功效,黄芪具有补气升阳、润肠通便等功效,临床上常常将人参与黄芪配伍,以发挥其调节免疫、保护心血管、抗肿瘤、抗衰老、降血糖等药理活性。绞股蓝主要含有皂苷类、多糖类和黄酮类等化学成分,具有降血糖、降血脂、保肝、抗氧化、抗衰老和保护心脑血管等作用[4]。九味补血口服液作为一款中药复方制剂,其成分复杂,作用机制还不够明确。网络药理学是一门将生物学网络与药物作用网络整合,分析药物在网络中与节点或网络模块的关系,由寻找单一靶点转向综合网络分析的学科,能较好地契合中药复方作用模式,近年来成为中药研究领域比较常用的热门领域[5]。本研究拟通过网络药理学分析结合在体研究的手段,从系统生物学角度出发,从多组分、多靶点、多途径的多层次研究维度,深入挖掘九味补血口服液治疗血虚证的具体作用机制和药效物质,拟为九味补血口服液的临床精准和合理应用提供理论依据。
1 材料与方法 1.1 材料 1.1.1 实验动物昆明小鼠,雄性,体质量18-22 g,无特定病原体级(SPF级)实验动物,购自湖南省长沙市天勤生物技术有限公司,许可证号为SCXK(湘)2019-0014。动物实验经实验动物伦理委员会批准(批准号为2022060801)。
1.1.2 药物与试剂九味补血口服液,规格为每支10 mL,批号为211218,广西白云山盈康药业有限公司生产。复方阿胶浆,规格为每支20 mL,批号为1904045,东阿阿胶股份有限公司生产。注射用环磷酰胺,0.2 g/瓶,批号为20092225,江苏恒瑞医药股份有限公司生产。GAPDH抗体(批号为00075847)、Toll样受体4(TLR4)抗体(批号为10005089)、缺氧诱导因子-1α(HIF-1α)抗体(批号为00096129)均购自Proteintech公司。核因子-κB (NF-κB) p65抗体(批号为01)购自Cell Signaling Technology公司。促红细胞生成素(Erythropoietin, EPO)抗体(批号为5500009384)购自ABclonal公司。山羊抗兔免疫球蛋白[IgG(H+L)]辣根过氧化物酶(HRP)偶联抗体(批号为GR3307521-3)、山羊抗鼠IgG(H+L)HRP偶联抗体(批号为GR3271082-3)均购自Abcam公司。ChamQ Universal SYBR qPCR Master Mix试剂盒(批号为Q711-02)、逆转录试剂盒(批号为L/N 7E48010)均购自南京诺唯赞生物科技股份有限公司。
1.1.3 主要仪器BC-5000型血细胞分析仪,深圳迈瑞生物医疗电子股份有限公司。Mini-PROTEAN Tetra电泳仪和Mini Trans-Blot cell转膜仪,伯乐生命医学产品(上海)有限公司。Tanon 4600全自动化学发光图像分析系统,上海天能科技有限公司。LightCycler 480实时荧光定量PCR仪,罗氏诊断产品(上海)有限公司。Centrifuge 5427R台式高速冷冻离心机,Eppendorf AG公司(德国艾本德股份公司)。Waters ACQUITY UPLC超高效液相色谱仪,沃特世科技(上海)有限公司。Waters Xevo G2-XS Q-Tof高分辨质谱仪,沃特世科技(上海)有限公司。
1.2 方法 1.2.1 九味补血口服液化学成分鉴定及潜在活性成分筛选采用超高效液相色谱串联四级杆飞行时间质谱(UPLC-Q-TOF-MS/MS)技术对九味补血口服液进行化学成分鉴定。通过中药系统药理学平台(TCMSP,https://old.tcmsp-e.com/tcmsp.php)对所鉴定出来的化学成分进行口服生物利用度(OB)、药物相似性(DL)筛选,选择OB≥30%、DL≥0.18的成分,构建九味补血口服液的潜在活性成分库,用于下一步的网络药理学分析[6]。
1.2.2 药物作用预测靶点的筛选通过Swiss Target Prediction(http://www.swisstargetprediction.ch/)、中药系统药理学平台(TCMSP,https://old.tcmsp-e.com/tcmsp.php)、中医药整合药理学研究平台(TCMIP,http://www.tcmip.cn/TCMIP/index.php/Home/Login/login.html)等在线数据库预测前述筛选出的活性成分的作用靶点,构建九味补血口服液化学成分-作用靶点数据库。
1.2.3 贫血疾病靶点的收集检索GeneCards(http://www.genecards.org/)、DrugBank(https://go.drugbank.com/)、OMIM(https://www.omim.org/)、DisGeNET(https://www.disgenet.org/)和中医药整合药理学研究平台数据库,以“Anemia”“Anemia of Inadequate Production”为筛选关键词,获取贫血相关的疾病基因信息。去除重复基因后,得到贫血疾病靶点数据库。
1.2.4 蛋白质-蛋白质相互作用网络的构建与分析将九味补血口服液成分作用预测靶点与贫血疾病靶点进行交集,取交集靶点作为药物改善贫血的预测靶点, 并利用Cytoscape 3.7.1软件构建九味补血口服液治疗血虚证的活性成分-作用靶点网络。将上述交集靶点导入STRING平台构建蛋白质-蛋白质相互作用(PPI)网络,并将PPI网络数据导入Cytoscape 3.7.1软件进行网络特征值分析,以网络节点中的拓扑结构特征值——度(Degree)值为重要参考,提取分析这些候选节点的网络关系。选取网络中大于度值中位数1.5倍的基因靶点作为九味补血口服液治疗贫血的关键靶点(Hub节点),用于后续基因本体(GO)分析、京都基因与基因组百科全书(KEGG)通路富集分析。
1.2.5 GO分析和KEGG通路富集分析利用DAVID数据库(https://david.ncifcrf.gov/)对上述关键基因靶点进行GO分析和KEGG通路富集分析,获得九味补血口服液治疗贫血的关键靶点蛋白在基因功能和信号通路中的具体调控信息,并筛选与疾病相关的关键通路及核心靶点。
1.2.6 分子对接将Hub节点与筛选出来的药物成分一起构建药物活性成分-关键靶点互作网络,筛选网络中Degree值>中位数的活性成分分子并将其作为网络核心药效分子,从PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)中获取相应药效分子的SDF格式文件,利用OpenBabel软件将其转化为PDB格式文件。筛选KEGG通路富集分析所获取的关键核心靶点,从RCSB PDB数据库(https://www.rcsb.org/)中检索其相应的3D结构PDB格式文件。采用AutodockFG软件进行核心成分与核心靶点间的分子对接验证。利用结合能(Affinity)评估药效分子与靶点的结合能力,将结合能≤-6 kcal/mol的药效分子-靶点结合对纳入选择。
1.2.7 九味补血口服液对血虚证小鼠的改善作用(1) 动物分组、造模及给药
适应性饲养1周后,将60只小鼠随机分为6组,每组10只,分别为对照组、模型组、阳性药(复方阿胶浆口服液,30 mL/kg)组,以及九味补血口服液高、中、低剂量组(10.0、5.0、2.5 mL/kg,分别为临床日剂量的20、10、5倍)[7]。每天灌胃给药1次,连续32 d。除对照组外,其余5组小鼠在给药第10-12天、第18-21天以及第26、28、30、31天分别腹腔注射环磷酰胺100 mg/kg,共11次,以建立血虚证小鼠模型[8]。
(2) 血液学指标检测
末次给药后1 h后(末次腹腔注射环磷酰胺24 h)摘眼球采血,乙二胺四乙酸(EDTA)抗凝后,用血细胞分析仪自动检测全血中的红细胞(RBC)、血红蛋白(HGB)和红细胞压积(HCT)等指标。
(3) qRT-PCR法检测肾脏中关键靶点mRNA水平
根据网络药理学分析预测和分子对接所验证的关键靶点进行基因水平表达验证。取小鼠左肾脏组织30 mg置于匀浆管中,加入总RNA提取试剂(Trizol) 1 mL充分研磨,加入三氯甲烷0.25 mL混匀,4 ℃、12 000 r/min离心10 min;吸取上清液,加入等量异丙醇,摇匀后移入-20 ℃冰箱保存30 min,4 ℃、12 000 r/min离心10 min;弃去液体,加入75%酒精洗涤沉淀,4 ℃、12 000/min离心10 min;弃去管中液体,倒置晾干,加入无酶水,测定RNA浓度。根据逆转录试剂盒说明书将RNA逆转录为cDNA,再根据扩增试剂盒说明书进行扩增。TLR4上游引物:5′-CCGCTCTGGCATCATCTTCA-3′,下游引物:5′-CCCACTCGAGGTAGGTGTTTC-3′。NF-κB上游引物:5′-TGTGGTGGAGGACTTGCTGAGG-3′,下游引物:5′-AGTGCTGCCTTGCTGTTCTTGAG-3′。HIF-1α上游引物:5′-ACCACAACTGCCACCACTGATG-3′,下游引物:5′-TGCCACTGTATGCTGATGCCTTAG-3′。EPO上游引物:5′-ATTCCTCCCAGCCACCAGAGAC-3′,下游引物:5′-CAGTACCCGAAGCAGTGAAGTGAG-3′。GAPDH上游引物:5′-GACAGCCGCATCTTCTTGTG-3′,下游引物:5′-GAGAAGGCAGCCCTGGTAAC-3′。引物由生工生物工程(上海)股份有限公司设计合成。使用2-ΔΔCt法计算基因mRNA水平。
(4) 免疫印迹法检测肾脏中关键靶点的蛋白表达水平
取小鼠右肾脏组织,加入裂解液并匀浆,冰浴1 h提取总蛋白,4 ℃、12 000 r/min离心10 min,收集蛋白上清液。BCA(Bicin-Choninic Acid)法测定蛋白浓度,加入上样缓冲液(Loading buffer),混匀,95 ℃加热15 min,配胶;待胶凝固后加入待测样本,以120 V电压电泳,120 V电压转聚偏二氟乙烯膜(PVDF膜)90 min,使用5%脱脂奶粉封闭PVDF膜1 h;TBST(含吐温的Tris-HCl缓冲盐溶液)清洗PVDF膜,分别加入TLR4、NF-κB p65、HIF-1α、EPO、GAPDH等一抗,4 ℃孵育过夜;TBST清洗PVDF膜,加入二抗(1∶5 000),孵育1 h,再次使用TBST清洗PVDF膜,显影并拍照。使用Image J(v 1.8.0)软件获取各条带灰度值,计算目的蛋白相对于内参蛋白GAPDH的相对表达量。
1.2.8 数据统计与分析因动物个体差异性,部分实验动物未能耐受环磷酰胺毒性而死亡,故动物实验例数实际为剔除死亡动物后的剩余例数,纳入统计分析范畴。实验数据用(χ±s)表示,多组样本均数的两两比较采用单因素方差分析,方差齐性采用最小显著差异(LSD)检验,方差不齐则采用非参数检验,P<0.05为差异有统计学意义。
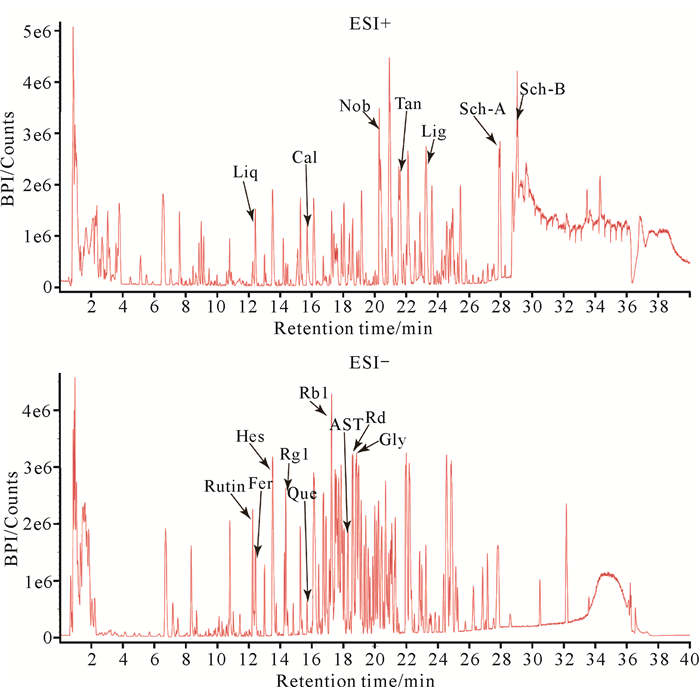
2 结果与分析 2.1 九味补血口服液的化学成分前期研究中(图 1)[9],从九味补血口服液中分离鉴定了91个化学成分,主要为黄酮、皂苷、木酯素、苯酞、有机酸等类型的化合物。采用对照品对照的方式,进一步确认组方药材中的16种指标性成分,包括黄芪甲苷(Astragaloside,AST)、毛蕊异黄酮(Calycosin,Cal)、人参皂苷Rb1 (Ginsenoside Rb1,Rb1)、人参皂苷Rg1(Ginsenoside Rg1,Rg1)、人参皂苷Rd(Ginsenoside Rd,Rd)、阿魏酸(Ferulic acid,Fer)、藁本内酯(Ligustilide,Lig)、五味子甲素(Schisandrin,Sch-A)、五味子乙素(Schisandrin B,Sch-B)、橙皮苷(Hesperidin,Hes)、川陈皮素(Nobiletin,Nob)、橘皮素(Tangeretin,Tan)、槲皮素(Quercetin,Que)、芦丁(Rutin)、甘草苷(Liquiritin,Liq)、甘草酸(Glycyrrhizic acid,Gly)。通过TCMSP数据库对上述91种化学成分进行进一步筛选,选取OB≥30%、DL≥0.18的成分,共获得16个,作为九味补血口服液的潜在活性成分,如表 1所示。
| 序号 No. |
化合物名称 Name of compound |
保留时间/min tR/min |
分子式 Molecular formula |
分子量 Molecular weight |
OB/% | DL | 离子源 Ion source |
| 1 | Nobiletin | 20.35 | C21H22O8 | 402.4 | 61.67 | 0.52 | +H, +Na |
| 2 | Sinensetin | 19.19 | C20H20O7 | 372.4 | 50.56 | 0.45 | +H, +Na |
| 3 | Isosinensetin | 18.06 | C20H20O7 | 372.4 | 51.15 | 0.44 | +H, +Na |
| 4 | Gomisin A | 22.14 | C23H28O7 | 416.5 | 30.69 | 0.78 | +Na |
| 5 | Schisandrin C | 29.66 | C22H24O6 | 384.4 | 46.27 | 0.84 | +H, +Na |
| 6 | Schisantherin B | 25.11 | C28H34O9 | 514.6 | 31.99 | 0.83 | +Na |
| 7 | Angeloylgomisin O | 24.30 | C28H34O8 | 498.6 | 31.97 | 0.85 | +Na |
| 8 | Licoricone | 24.41 | C22H22O6 | 382.4 | 63.58 | 0.47 | +H |
| 9 | Didymin | 15.41 | C28H34O14 | 594.6 | 38.55 | 0.24 | +H, +Na |
| 10 | Gomisin R | 22.33 | C22H24O7 | 400.4 | 34.84 | 0.86 | +H |
| 11 | Ginsenoside F2 | 21.01 | C42H72O13 | 784.5 | 37.03 | 0.25 | +Na |
| 12 | Isorhamnetin | 13.14 | C12H16O7 | 316.1 | 49.6 | 0.31 | +H |
| 13 | Quercetin | 12.61 | C15H10O7 | 302.0 | 46.43 | 0.28 | -H |
| 14 | Hesperetin | 14.11 | C16H14O6 | 302.1 | 70.31 | 0.27 | +Na, +H |
| 15 | Liquiritin | 12.46 | C21H22O9 | 418.1 | 65.69 | 0.74 | +Na, +H |
| 16 | Boc-D-Trp-OH | 9.70 | C16H20N2O4 | 304.1 | 68.76 | 0.20 | +H |
2.2 九味补血口服液活性成分-靶点网络的构建与分析
经TCMSP、TCMIP数据库预测成分候选靶点(TCMIP数据库靶点筛选条件:相似性>0.6),因人参皂苷F2无相应符合条件的靶点,故剔除之,剩余15个潜在活性成分,获得药物靶点基因332个用于后续网络分析。从HPO、OMIM、TTD、DrugBank、GeneCards等数据库获取贫血疾病靶点1 393个,获取药物靶点与疾病靶点的交集,共计63个共有靶点。运用Cytoscape 3.7.1软件构建九味补血口服液治疗血虚证的活性成分-作用靶点网络(图 2)并进行分析,此网络由15个活性成分及63个潜在靶点构成。63个潜在靶点均至少与13个活性成分相互作用,充分体现了九味补血口服液是通过多成分、多靶点的方式来干预血虚证的。
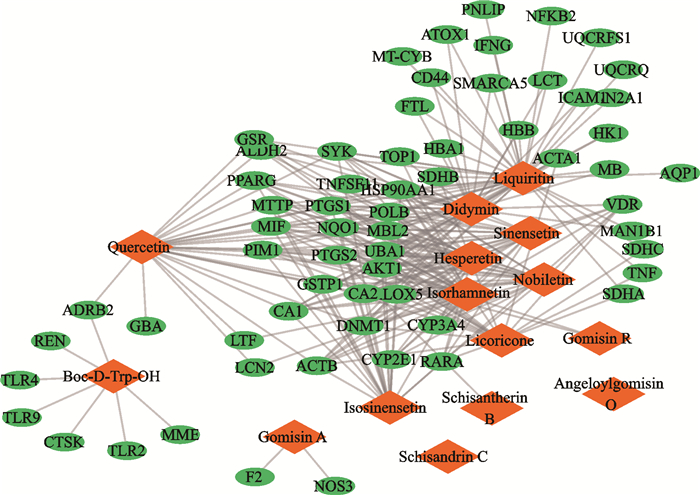
|
| Orange diamond shape represents active ingredients obtained from Jiuwei Buxue Oral Liquid, green ellipse shape represents common targets. 图 2 九味补血口服液治疗血虚证的活性成分-作用靶点网络 Fig. 2 Active ingredients-targets network of Jiuwei Buxue Oral Liquid in the treatment of anemia |
通过Cytoscape 3.7.1软件插件Network Analyze的度值进行九味补血口服液干预血虚的重要潜在靶点的评估,进一步确定关键靶点,结果见图 3。其中关键靶点有15个,如肌动蛋白β(ACTB)、丝氨酸/苏氨酸蛋白激酶(AKT1)、肿瘤坏死因子(TNF)、过氧化物酶体增殖物激活受体γ(PPARG)、Toll样受体4(TLR4)、热休克蛋白90α家族A类成员1(HSP90AA1)、环氧合酶2(PTGS2)等。该网络中,与靶点相互作用较多的成分包括甘草苷、香蜂草苷、橙皮素、异鼠李素、异橙黄酮、川陈皮素、甜橙黄酮、甘草利酮、槲皮素等9种。
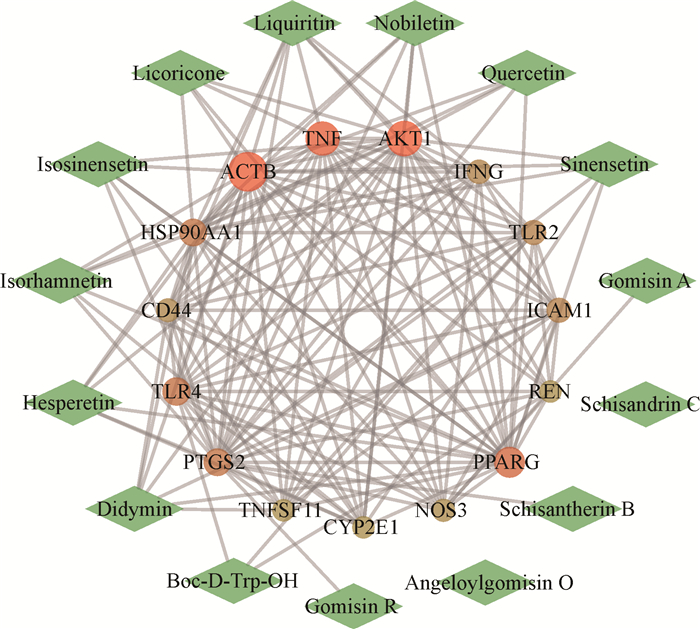
|
| Green diamond shape represents 15 active ingredients, ellipse shape represents key targets for Jiuwei Buxue Oral Liquid in treatment of anemia.The redder the color, and the larger the degree value. 图 3 九味补血口服液治疗血虚证的活性成分-关键靶点网络 Fig. 3 Active ingredients-key targets network of Jiuwei Buxue Oral Liquid in treatment of anemia |
2.3 关键靶点的KEGG通路富集及GO分析
选取上述筛选出的15个关键靶点(图 3),利用DAVID数据库对这些关键靶点进行KEGG通路富集分析及GO分析。选取通路富集分析排名前18的通路(P<0.01,图 4),结果可以看出九味补血口服液治疗血虚证的关键靶点主要富集于NF-κB signaling pathway、Metabolic pathway、HIF-1 signaling pathway、Toll-like receptor signaling pathway等信号通路。
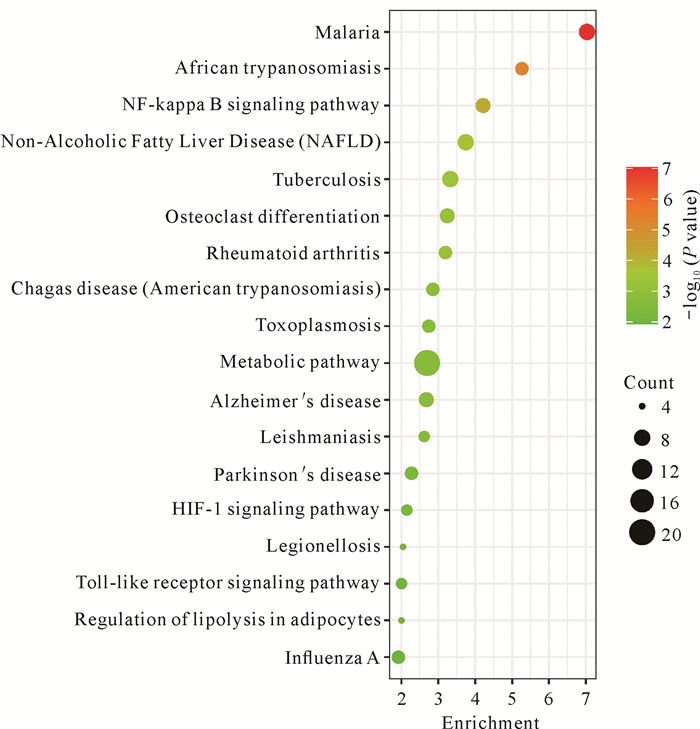
|
| The redder the bubbles, and the larger the P value;the size of each bubble reflects the number of genes enriched in the pathway. 图 4 九味补血口服液治疗血虚证潜在靶点的KEGG通路富集分析 Fig. 4 KEGG pathway enrichment analysis of potential targets of Jiuwei Buxue Oral Liquid in the treatment of anemia |
GO分析结果显示,九味补血口服液治疗血虚证的关键靶点主要参与的生物学过程包括寒冷反应、细胞对β-淀粉样蛋白的反应、生物矿化、产热、蛋白质组装正调控、多元醇生物合成、白细胞介素6 (IL-6)合成负调控等过程;在分子功能上,九味补血口服液主要与氧气结合、铁离子结合、一元羧酸结合、血红素结合、脂多糖结合等相关;在细胞组分方面,其主要作用于内吞囊泡腔、线粒体呼吸体、氧化还原酶复合物、呼吸链复合物、琥珀酸脱氢酶复合物等(图 5)。
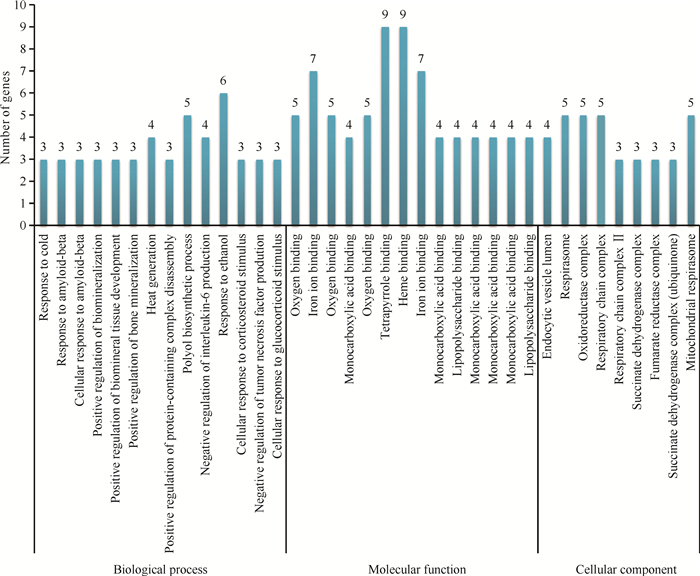
|
| 图 5 九味补血口服液治疗血虚证关键靶点的GO分析 Fig. 5 GO analysis of key targets of Jiuwei Buxue Oral Liquid in the treatment of anemia |
2.4 九味补血口服液活性成分与关键靶点的结合能力
根据“活性成分-关键靶点”网络分析得到九味补血口服液核心活性成分有甘草苷、香蜂草苷、橙皮素、异鼠李素、异橙黄酮、川陈皮素、甜橙黄酮、甘草利酮、槲皮素等9种。根据血虚证的疾病机制及KEGG通路富集结果,本研究选取上述成分与所富集的关键信号通路中的关键靶点如TLR4、NF-κB p65、HIF-1α进行结合能力预测。一般认为结合能小于-4.25 kcal/mol提示配体与受体有一定的结合活性,小于-5.0 kcal/mol有较好的结合活性,小于-7.0 kcal/mol表示有强烈的结合活性[10]。9种活性成分与3个靶蛋白对接,结果显示甘草苷、橙皮素与TLR4有强烈结合能力(表 2),用PyMOL软件对部分有强烈结合活性(结合能小于等于-7 kcal/mol) 的成分与靶点对接结果进行可视化,发现甘草苷可以在TLR4蛋白的ASN-481、ASN-530、ARG-460、GLN-507、GLU-485、HIS-555位点处产生氢键作用,橙皮素可以在TLR4蛋白的ARG-460、ASN-486、GLN-507、HIS-529、HIS-555位点处产生氢键作用(图 6)。
| Unit: kcal/mol | |||||||||||||||||||||||||||||
| 化合物 Compound |
TLR4 | NF-κB p65 | HIF-1α | ||||||||||||||||||||||||||
| Liquiritin | -7.2 | -4.2 | -4.5 | ||||||||||||||||||||||||||
| Didymin | -6.3 | -4.2 | -4.4 | ||||||||||||||||||||||||||
| Hesperetin | -7.0 | -4.0 | -4.8 | ||||||||||||||||||||||||||
| Isosinensetin | -6.4 | -3.8 | -4.9 | ||||||||||||||||||||||||||
| Licoricone | -6.9 | -3.5 | -4.4 | ||||||||||||||||||||||||||
| Quercetin | -6.7 | -3.6 | -3.8 | ||||||||||||||||||||||||||
| Isorhamnetin | -6.6 | -3.3 | -3.8 | ||||||||||||||||||||||||||
| Nobiletin | -6.1 | -4.3 | -4.9 | ||||||||||||||||||||||||||
| Sinensetin | -6.1 | -3.8 | -3.9 | ||||||||||||||||||||||||||
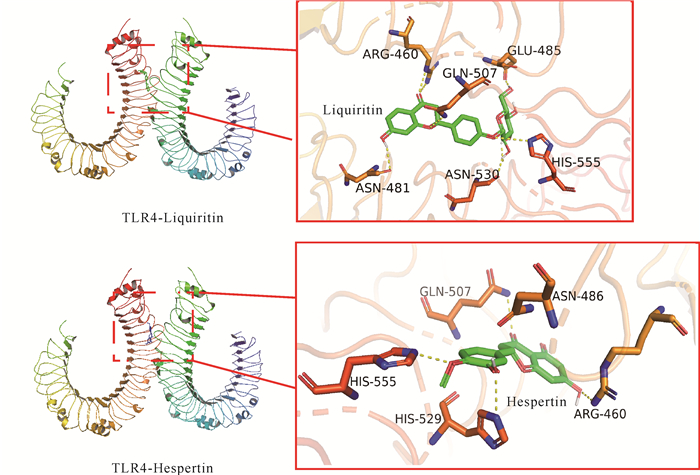
|
| 图 6 甘草苷、橙皮素与TLR4的分子对接示意图 Fig. 6 Molecular docking diagram of liquiritin, hesperetin and TLR4 |
2.5 九味补血口服液对血虚证小鼠的改善作用 2.5.1 九味补血口服液对血虚证小鼠血液学指标的影响
如表 3所示,与对照组相比,模型组小鼠的RBC、HGB和HCT均显著降低(P<0.01),表明小鼠血虚造模成功;与模型组相比,10.0、5.0 mL/kg九味补血口服液可显著升高血虚证小鼠血液RBC、HGB、HCT的水平(P<0.05,P<0.01)。
| 组别 Group |
小鼠数量 Number of mice |
剂量/(mL/kg) Dosage/ (mL/kg) |
RBC/(×1012 L) | HGB/(g/L) | HCT/% |
| Control group | 10 | 10.31±0.43 | 170.50±6.52 | 49.94±1.85 | |
| Model group | 7 | 4.39±1.78** | 74.00±29.68** | 20.69±8.54** | |
| Positive drug group | 8 | 30.0 | 5.29±0.83 | 88.88±14.31 | 25.79±4.25# |
| Jiuwei Buxue Oral Liquid group | 10 | 10.0 | 5.99±0.85## | 98.50±14.70## | 28.77±3.97## |
| 9 | 5.0 | 5.99±0.68## | 99.00±10.22## | 28.54±3.33## | |
| 10 | 2.5 | 5.15±1.20 | 84.00±18.74 | 24.00±5.09 | |
| Note: **P<0.01 vs.control group; #P<0.05,##P<0.01 vs.model group. | |||||
2.5.2 九味补血口服液对血虚证小鼠肾脏HIF-1α/EPO信号的改善作用
qRT-PCR和免疫印迹实验(表 4及图 7)均显示,与对照组相比,模型组小鼠肾脏中HIF-1α蛋白和基因水平显著升高(P<0.01或P<0.05),EPO蛋白和基因水平显著降低(P<0.01或P<0.05),提示环磷酰胺诱导血虚证小鼠肾脏促红细胞生成作用减弱。与模型组相比,九味补血口服液高、中、低剂量组均显著升高肾脏EPO表达水平(P<0.05或P<0.01),但无法逆转HIF-1α的变化。HIF-1α已被多项研究证实是EPO的转录因子[11],同时HIF-1α的合成及降解受多种通路调节,九味补血口服液未能逆转HIF-1α的改变,而上调HIF-1α水平最终可能进一步促进EPO的转录合成。
| 组别 Group |
剂量/(mL/kg) Dosage/(mL/kg) |
HIF-1α | EPO |
| Control group | 1.01±0.12 | 1.14±0.69 | |
| Model group | 2.69±0.76** | 0.05±0.01** | |
| Positive drug group | 30.0 | 2.40±0.53 | 1.16±0.62## |
| Jiuwei Buxue Oral Liquid group | 10.0 | 4.45±1.66# | 2.49±1.53## |
| 5.0 | 3.15±0.86 | 0.38±0.23## | |
| 2.5 | 2.80±0.57 | 0.64±0.48# | |
| Note: **P<0.01 vs.control group; #P<0.05,##P<0.01 vs.model group. | |||
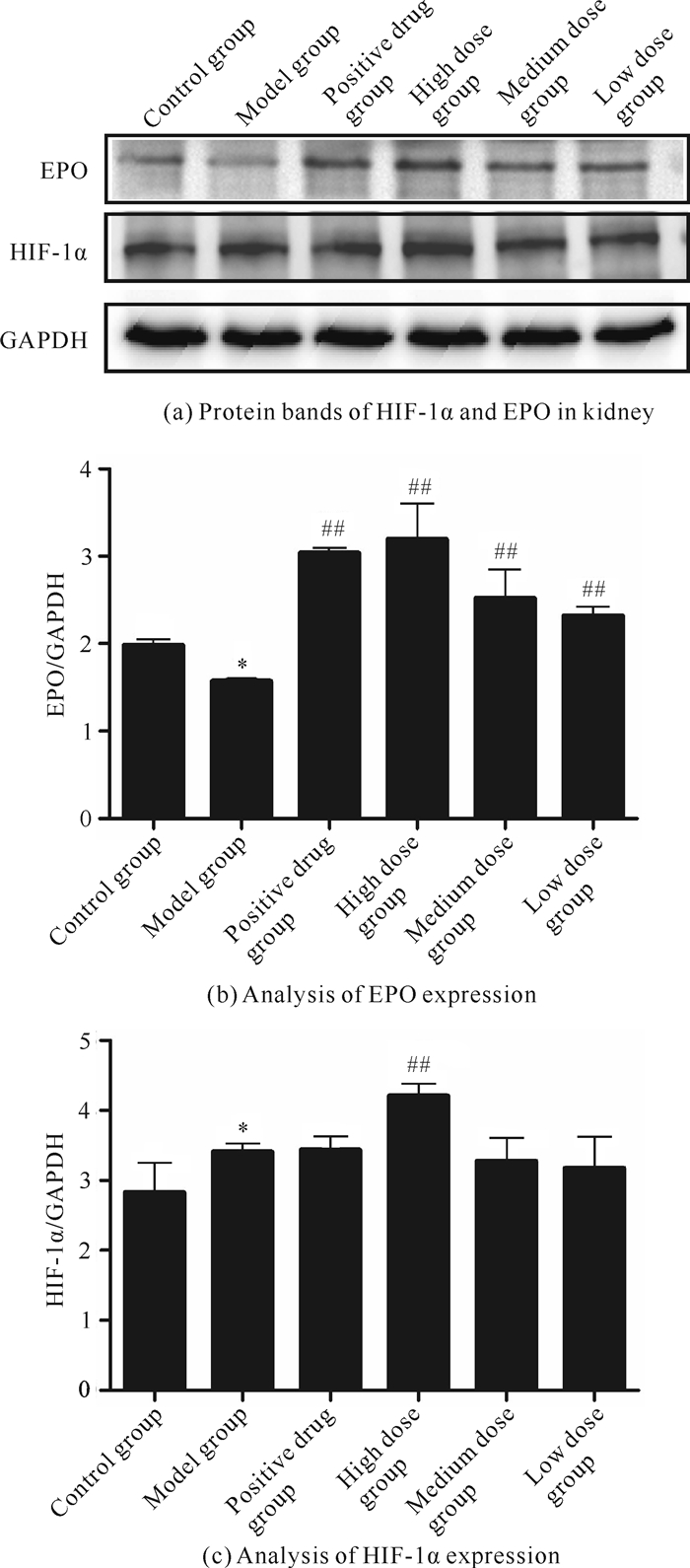
|
| *P<0.05,vs.control group; ##P<0.01 vs.model group. 图 7 九味补血口服液对血虚证小鼠肾脏HIF-1α、EPO蛋白表达水平的影响 Fig. 7 Effects of Jiuwei Buxue Oral Liquid on expressions of HIF-1α and EPO in kidney of blood deficient mice |
2.5.3 九味补血口服液对血虚证小鼠肾脏TLR4/NF-κB p65炎性信号的调控作用
九味补血口服液对血虚证小鼠肾脏TLR4/NF-κB p65炎性信号的调控作用如表 5和图 8所示。与对照组相比,模型组小鼠肾脏中TLR4、NF-κB p65蛋白出现明显上调的现象(P<0.01,P<0.01),表明环磷酰胺可增强小鼠肾脏内炎性信号;与模型组相比,10.0 mL/kg九味补血口服液可显著降低TLR4、NF-κB p65的表达,进而减少环磷酰胺诱导的肾脏炎性反应(P<0.01,P<0.01)。
| 组别 Group |
剂量/ (mL/kg) Dosage/ (mL/kg) |
TLR4 | NF-κB p65 |
| Control group | 1.04±0.34 | 1.07±0.42 | |
| Model group | 10.23±3.87** | 4.99±1.77** | |
| Positive drug group | 30.0 | 7.24±2.86 | 3.68±0.93 |
| Jiuwei Buxue Oral Liquid group | 10.0 | 5.92±1.82# | 2.36±0.58## |
| 5.0 | 6.74±2.89 | 3.99±1.42 | |
| 2.5 | 6.59±0.89# | 3.95±1.15 | |
| Note: **P<0.01 vs.control group; #P<0.05,##P<0.01 vs.model group. | |||
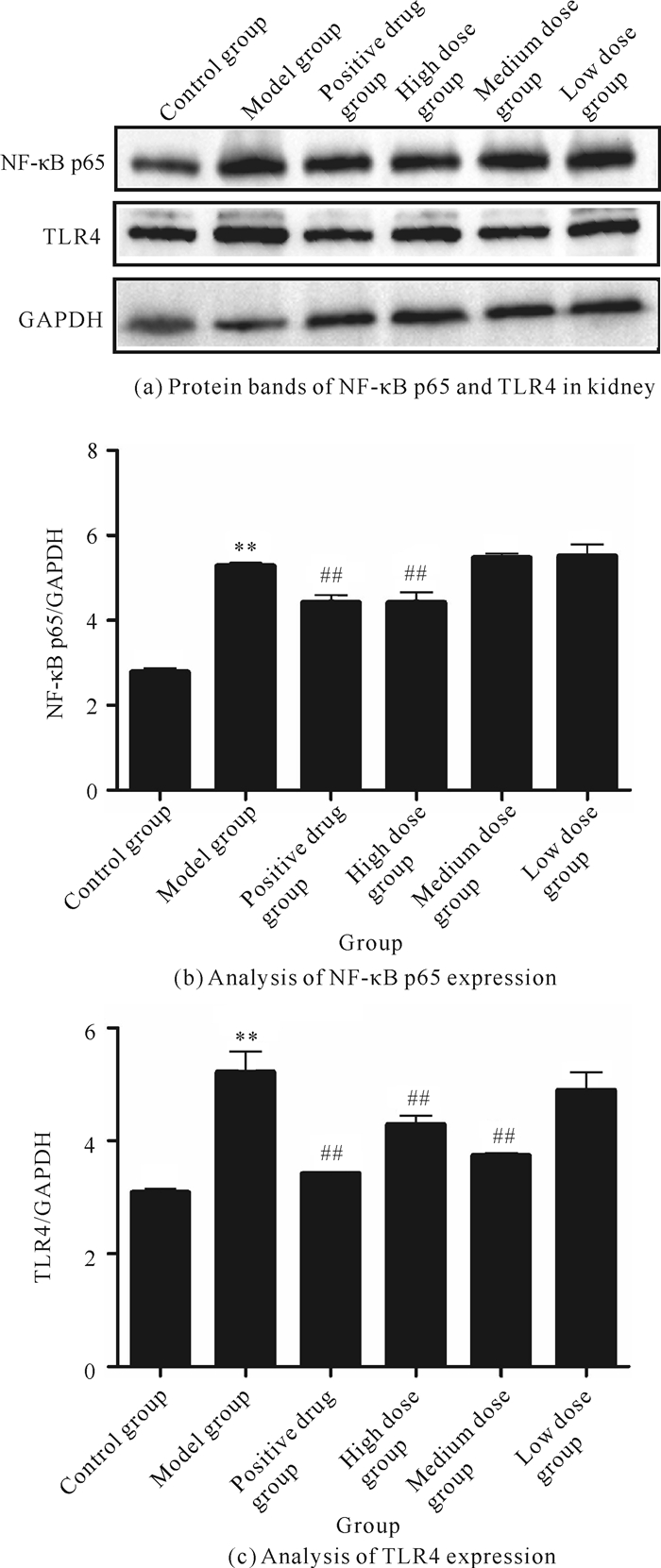
|
| **P<0.01 vs.control group; ##P<0.01 vs.model group. 图 8 九味补血口服液对血虚证小鼠肾脏NF-κB p65、TLR4蛋白表达的影响 Fig. 8 Effects of Jiuwei Buxue Oral Liquid on expressions of NF-κB p65 and TLR4 in kidney of blood deficient mice |
3 讨论
本研究采用环磷酰胺建立小鼠血虚证模型,通过抑制骨髓造血功能,减少外周血红细胞数量,模拟血虚证病理表现[12],且在环磷酰胺诱导的血虚证小鼠中,也证实了环磷酰胺可以造成明显的贫血症状,而九味补血口服液可以升高血红蛋白水平,改善红细胞压积和血虚证小鼠贫血等症状。
九味补血口服液主要由人参、黄芪、绞股蓝、五味子(Schisandra chinensis)、当归(Angelica sinensis)、白术(Atractylodes macrocephala)、陈皮、山楂、甘草(Glycyrrhiza uralensis)这9味中药组方而成,目前临床上主要用于气血两虚所致的失眠健忘、心悸怔忡诸证。本研究初步揭示,九味补血口服液中的香蜂草苷、橙皮素、异鼠李素、异橙黄酮、甘草利酮、槲皮素等15个成分可能是发挥拮抗血虚作用的潜在活性物质。上述活性成分的关键作用靶点包括ACTB、AKT1、TNF、PPARG、TLR4、HSP90AA1、PTGS2等15个。GO分析结果显示,九味补血口服液中的活性成分主要与氧气结合、铁离子结合、一元羧酸结合、血红素结合、脂多糖结合等分子功能相关,并对线粒体呼吸链功能具有潜在的调控作用,这些机制与临床上血虚证的治疗思路契合,可能是拮抗血虚证的重要机制。同时, 上述靶点主要富集于TLR4、NF-κB、HIF-1等通路,可能对炎症、红细胞生成有一定的调控作用。
采用分子对接技术将九味补血口服液的主要药效成分如甘草苷、香蜂草苷、橙皮素、异橙黄酮、甘草利酮、槲皮素等,与核心通路的相关靶点TLR4、NF-κB p65、HIF-1α进行结合能力预测,结果发现甘草苷、橙皮素与TLR4有强烈的结合能力,但与NF-κB p65、HIF-1α结合能力较低。通过实验验证,九味补血口服液可显著下调血虚证小鼠肾脏TLR4、NF-κB p65蛋白表达,减少环磷酰胺诱导的肾脏炎症反应。王燕等[13]研究报道,在环磷酰胺诱导机体免疫抑制刺激下,可造成肾脏纤维增生、出血、炎症浸润等现象。多项研究显示,炎症刺激可通过激活TLR4并介导下游NF-κB信号调控,参与细胞免疫调节、炎症、增殖等过程[14, 15]。综合上述研究结果,推测九味补血口服液可能通过减少TLR4的合成,同时负作用于TLR4蛋白后,减少对NF-κB信号的激活,而并非直接作用于NF-κB。
在缺血缺氧状态下,NF-κB p65活化入核也可以调控HIF-1α的表达,进一步对细胞炎症反应进行负调控[16-18]。Wenger等[11]发现,HIF-1α还参与调控EPO的合成。EPO是一种功能广泛的细胞因子,人成年后主要在肾脏中合成,可显著刺激红细胞的增殖、存活,促进造血功能进而改善血虚状态,并具有脑、肾脏、心脏保护等多重作用[19-22]。由此可知,通过增强HIF-1α功能进而促进EPO分泌,可能改善机体的造血功能。根据分子对接的预测,九味补血口服液可能并非直接作用于HIF-1α,而是通过调控HIF-1α转录表达或者其降解途径,进而增加了其蛋白水平。因此,九味补血口服液可以通过促进HIF-1α、EPO表达来改善肾脏促造血功能。
4 结论本研究初步阐明了九味补血口服液可能通过TLR4/NF-κB通路和HIF-1α/EPO通路分别调节血虚证小鼠肾脏炎症反应以及EPO合成,通过减轻肾脏炎症进而促进红细胞生成作用,改善血虚证小鼠血虚症状。本研究将有助于明确九味补血口服液治疗贫血的药效物质基础,可为九味补血口服液的临床应用提供更多循证依据。
| [1] |
冯伟科, 吴江, 刘俊志, 等. 四物汤对环磷酰胺致血虚证小鼠骨髓细胞凋亡及Bcl-2、Bcl-xL蛋白表达的影响[J]. 时珍国医国药, 2019, 30(3): 579-581. |
| [2] |
黄若干, 裴泽建, 黄平权, 等. 九味补血口服液质量标准研究[J]. 中国民族民间医药, 2016, 25(23): 16-19. |
| [3] |
王婉莹, 姜思亮, 柴军红, 等. 黄芪和人参配伍的药理作用及临床应用研究进展[J]. 中医药学报, 2023, 51(8): 104-109. |
| [4] |
王振兴, 杨金梅, 张志斌, 等. 绞股蓝的化学成分及其生物活性研究进展[J]. 南方农业学报, 2023, 54(6): 1741-1752. |
| [5] |
李学军, 许海玉. 网络药理学与中药研究[J]. 药学学报, 2018, 53(9): 1385-1386. |
| [6] |
RU J, LI P, WANG J, et al. TCMSP: a database of systems pharmacology for drug discovery from herbal medicines[J]. Journal of Cheminformatics, 2014, 6: 13. DOI:10.1186/1758-2946-6-13 |
| [7] |
黄继汉, 黄晓晖, 陈志扬, 等. 药理试验中动物间和动物与人体间的等效剂量换算[J]. 中国临床药理学与治疗学, 2004, 9(9): 1069-1072. |
| [8] |
王穆, 让蔚清, 张琪, 等. 四物汤对环磷酰胺所致血虚证治疗后的代谢组学研究[J]. 中国中药杂志, 2010, 35(5): 630-634. |
| [9] |
韦洁, 蓝晓东, 李冬梅, 等. 基于整合网络药理学和实验验证探究九味补血口服液调控Glu/GABA动态平衡改善失眠大鼠睡眠机制的研究[J]. 药学学报, 2023, 9(6): 1484-1495. |
| [10] |
HSIN K Y, GHOSH S, KITANO H. Combining machine learning systems and multiple docking simulation packages to improve docking prediction reliability for network pharmacology[J]. PLoS One, 2013, 8(12): e83922. DOI:10.1371/journal.pone.0083922 |
| [11] |
WENGER R H, KURTZ A. Erythropoietin[J]. Comprehensive Physiology, 2011, 1(4): 1759-1794. |
| [12] |
张文卓, 杨海淼, 张硕, 等. 参红补血颗粒对乙酰苯肼/环磷酰胺血虚证模型动物免疫调节相关因子的影响[J]. 长春中医药大学学报, 2014, 30(5): 776-778. |
| [13] |
王燕, 周建华, 俞春英, 等. 环磷酰胺对福建黄兔肝肾损伤的试验研究[J]. 福建畜牧兽医, 2022, 44(2): 8-11. |
| [14] |
MA T, LIU P, WEI J, et al. Imperatorin alleviated endometriosis by inhibiting the activation of PI3K/Akt/NF-κB pathway in rats[J]. Life Sciences, 2021, 274: 119291. |
| [15] |
ZUSSO M, LUNARDI V, FRANCESCHINI D, et al. Ciprofloxacin and levofloxacin attenuate microglia inflammatory response via TLR4/NF-kB pathway[J]. Journal of Neuroinflammation, 2019, 16(1): 148. |
| [16] |
ZHANG Y, LU Y, MA L, et al. Activation of vascular endothelial growth factor receptor-3 in macrophages restrains TLR4-NF-κB signaling and protects against endotoxin shock[J]. Immunity, 2014, 40(4): 501-514. |
| [17] |
LI J, XIE C, ZHUANG J, et al. Resveratrol attenuates inflammation in the rat heart subjected to ischemia-reperfusion: role of the TLR4/NF-κB signaling pathway[J]. Molecular Medicine Reports, 2015, 11(2): 1120-1126. |
| [18] |
韦皓, 许玉霞, 秦莉, 等. HIF-1α通过TLR4/NF-κB信号通路对心肌缺血-再灌注大鼠心肌损伤的保护机制分析[J]. 临床和实验医学杂志, 2019, 18(10): 1017-1020. |
| [19] |
CHEN G H, LI X L, DENG Y Q, et al. The molecular mechanism of EPO regulates the angiogenesis after cerebral ischemia through AMPK-KLF2 signaling pathway[J]. Critical Reviews in Eukaryotic Gene Expression, 2019, 29(2): 105-112. |
| [20] |
BRINES M L, GHEZZI P, KEENAN S, et al. Erythropoietin crosses the blood-brain barrier to protect against experimental brain injury[J]. Proceedings of the National Academy of Sciences of the United States of America, 2000, 97(19): 10526-10531. |
| [21] |
CHEN X, WANG C C, SONG S M, et al. The administration of erythropoietin attenuates kidney injury induced by ischemia/reperfusion with increased activation of Wnt/β-catenin signaling[J]. Journal of the Formosan Medical Association, 2015, 114(5): 430-437. |
| [22] |
VILARINHO K A S, DE OLIVEIRA P P M, SAAD M J A, et al. Erythropoietin protects the systolic function of neonatal hearts against ischaemia/reperfusion injury[J]. European Journal of Cardio-Thoracic Surgery, 2013, 43(1): 156-162. |