结直肠癌(Colorectal Cancer, CRC)是最常见的消化道恶性肿瘤之一。我国结直肠癌发病率呈逐年上升趋势,发病率、死亡率均列全球首位,严重危害人民的生命健康[1]。目前结直肠癌治疗手段以手术结合化疗为主,手术创伤和放化疗引起的严重不良反应、耐药频发等严重影响结直肠癌的预后。因此,积极寻找新的抗结直肠癌治疗靶点及开发新的药物至关重要。
铁死亡(Ferroptosis)是近年来发现的一种新型特征性细胞死亡方式,是指由于细胞内铁依赖性活性氧(Reactive Oxygen Species, ROS)异常堆积,引起细胞质膜系统脂质过氧化物水平升高,导致氧化还原失衡失调,进而造成的细胞死亡。越来越多的抗肿瘤研究发现,铁死亡途径参与多种肿瘤的发生发展过程,激活铁死亡可有效促进肿瘤细胞的死亡[2, 3]。不同于正常细胞,肿瘤细胞的快速增殖能力高度依赖铁离子代谢介导的氧化供能,破坏正常的铁离子代谢可明显打断线粒体呼吸链产能[4]。诱导结直肠癌细胞铁死亡可能是潜在的治疗手段。
消瘤藤(Pileostegia tomentella)是广西传统瑶药材,民间瑶医广泛应用于各种肿瘤治疗[5]。胡筱希等[6]研究发现,消瘤藤总香豆素(Total Coumarins from Pileostegia tomentella, TCPT)活性部位具有显著的抗肿瘤活性,可有效抑制肝癌、乳腺癌、胶质瘤、结直肠癌细胞的增殖能力,同时还能明显减弱结直肠癌的迁移和侵袭能力。但消瘤藤总香豆素是否具有诱导肿瘤细胞死亡的其他方式,其作用机制如何,还尚未阐明。本文以人结直肠癌HT-29细胞为研究对象,探讨TCPT通过诱导结直肠癌细胞铁死亡的作用及其可能机制,为消瘤藤作为抗肿瘤药物的深度开发提供科学依据。
1 材料与方法 1.1 材料 1.1.1 TCPT的制备消瘤藤采自广西金秀瑶族自治县,经广西中医药研究院黄云峰副研究员鉴定为绣球科(Hydrangeaceae)冠盖藤属(Pileostegia)植物星毛冠盖藤(Pileostegia tomentella Hand.-Mazz.)的全草。取250 g消瘤藤药材,粉碎成粗粉,8倍量95%乙醇回流提取5次,2 h/次,过滤,合并提取液,回收溶剂得浸膏46 g。浸膏加水混悬,依次用石油醚(60-90 ℃)、乙酸乙酯萃取,取乙酸乙酯萃取部位,经硅胶色谱柱分离,以乙酸乙酯-甲醇(100∶0→90∶0→80∶20→50∶50)梯度洗脱,收集流分,通过薄层色谱合并香豆素类成分,最终得TCPT 6.28 g。
1.1.2 细胞株人结直肠癌HT-29细胞株购自广州速研生物科技有限公司(STR鉴定通过)。
1.1.3 主要试剂细胞增殖活性检测试剂盒(Cell Counting Kit-8,CCK-8,批号KN658,日本同仁公司),细胞凋亡检测试剂盒(A211-02,南京诺唯赞生物科技有限公司),二氯荧光素(DCFH-DA)探针染料(S0033S-1,上海碧云天生物技术有限公司),Rosup(S0033S-2,上海碧云天生物技术有限公司),BODIPY 581/589 C11探针染料(0622937,美国Cayman公司),兔抗人谷胱甘肽过氧化物酶4(Glutathione Peroxidase 4, GPX4)多克隆抗体(52455T-10,美国CST公司),兔抗人核受体共激活因子4(Nuclear receptor coactivator 4, NCOA4)多克隆抗体(66849T-2,美国CST公司),兔抗人胱氨酸-谷氨酸反向转运体亚基(Cysteine-glutamate antiporter subunit, xCT)多克隆抗体(12691T-5,美国CST公司),兔抗人二价金属离子转运体(Divalent Metal Transporter 1, DMT1)多克隆抗体(15083T-1,美国CST公司),兔抗人GAPDH多克隆抗体[D110016-0100,生工生物工程(上海)有限公司],辣根过氧化物酶(HRP)标记的山羊抗兔IgG(GR3307268-2,美国Abcam公司)。
1.1.4 主要仪器生物安全柜(ESCO AC2-4S1,新加坡ESCO公司),CO2细胞培养箱(MCO-18AIC,日本松下公司),透射电子显微镜(H-7650,日本日立公司),微毛细管细胞流式分析平台(Guava easyCyte HT,美国Merck Millipore公司),倒置荧光显微镜(DMi8,德国徕卡公司),酶标仪(SynergyH,美国BioTek公司),垂直电泳及转印系统(Mini-PROTEAN Tetra/Mini Trans-Blot Module,美国Bio-Rad公司),多功能成像分析系统(ProteinSimpleFluorChem R,美国Protein simple公司)。
1.2 方法 1.2.1 细胞培养用含10%胎牛血清、1%青链霉素双抗的DMEM高糖培养基培养人结直肠癌HT-29细胞,培养环境设置为37 ℃、5% CO2,待细胞融合率达80%-90%时,用0.25%胰蛋白酶消化传代或进行各项功能试验。
1.2.2 细胞活性检测(CCK-8法)收集对数生长期的HT-29细胞,按5×103个细胞/孔接种于96孔板中,继续培养24 h待其贴壁。分为空白对照组及TCPT处理组,向TCPT组细胞加入100 μL含药培养基(TCPT浓度分别为12.5、25.0、50.0、100.0、200.0 μg/mL),向空白对照组加入等体积的细胞培养基,继续培养24 h。试验终点弃去各孔培养基,加入100 μL 10% CCK-8稀释液,于37 ℃孵育1 h,用酶标仪检测450 nm处各孔吸光度,记录光密度(OD)值。公式如下:
| $细胞存活率(\%)=处理组OD\div空白组OD\times 100\%。$ |
取对数生长期的HT-29细胞,按5×105个细胞/孔接种于6孔板中,贴壁生长24 h。TCPT处理组加入不同浓度的TCPT(50.0、100.0 μg/mL),空白对照组加入等体积的培养基,继续培养24 h。消化收集各组细胞和上清液,离心、洗涤,将细胞重悬于100 μL结合缓冲液(Binding buffer)中。加入5 μL Annexin V-FITC和5 μL碘化丙啶(PI)染液,混匀,避光孵育15 min,加入200 μL上样缓冲液(Loading buffer)混匀,过筛,使用微毛细管细胞流式分析平台检测细胞活性。
1.2.4 细胞线粒体形态变化取对数生长期的HT-29细胞,根据TCPT细胞毒性试验半抑制浓度(IC50)结果设置空白对照组和TCPT处理组(100.0 μg/mL),空白对照组加入等体积的培养基,继续培养24 h。干预结束后消化并收集各组细胞,取2×106个细胞,用磷酸缓冲盐溶液(PBS)洗涤3次,接着采用2.5%戊二醛和1%锇酸双固定,常规脱水包埋、切片,醋酸双氧铀-枸橼酸铅染色,透射电子显微镜观察细胞线粒体形态变化。
1.2.5 细胞内ROS含量的变化取对数生长期的HT-29细胞,按3×103个细胞/孔接种于96孔板中,贴壁生长24 h。TCPT处理组加入不同浓度的TCPT(50.0、100.0 μg/mL),ROS阳性对照组加入活性氧阳性对照药Rosup(50 μg/mL),空白对照组加入等体积的培养基,继续培养2 h。各组细胞按分组设置干预结束后,弃去原培养基,将DCFH-DA探针染料按1∶1 000的比例用无血清培养基稀释后,以0.1 mL/孔加入孔板中,置于培养箱孵育30 min,除去含探针的培养基,无血清培养基洗涤3次,倒置荧光显微镜下观察细胞荧光强度。
1.2.6 细胞内脂质过氧化物含量取对数生长期的HT-29细胞,按1×106个细胞/孔接种于6孔板中,贴壁生长24 h。TCPT处理组加入不同浓度的TCPT(50.0、100.0 μg/mL),空白对照组加入等体积的培养基,继续培养6 h。各组细胞按分组设置干预结束后,更换新鲜的培养基,按1∶1 000的比例加入BODIPY 581/589 C11探针染料,配制成工作液(1.5 μmol/L)进行染色,混匀后置于培养箱37 ℃孵育30 min。除去染料,PBS洗涤2次,收集细胞,将细胞重悬于PBS中,过400目筛,使用微毛细管细胞流式分析平台检测分析。
1.2.7 铁死亡相关蛋白的表达水平取对数生长期的HT-29细胞,按1×106个细胞/孔接种于6孔板中,贴壁生长24 h。TCPT处理组加入不同浓度的TCPT(50.0、100.0 μg/mL),空白对照组加入等体积的培养基,继续培养24 h。各组细胞按分组设置干预结束后,RIPA裂解液提取细胞总蛋白,BCA蛋白试剂盒测定蛋白浓度。取10 μg总蛋白用12%分离胶和5%浓缩胶进行SDS-PAGE电泳,转印至聚偏氟乙烯(PVDF)膜上,用含5%脱脂奶粉的磷酸盐吐温缓冲液(Phosphate Buffered Saline-Tween, PBST)封闭1 h后分别用兔抗人GPX4(1∶1 000稀释)、兔抗人xCT(1∶1 000稀释)、兔抗人NCOA4(1∶1 000稀释)、兔抗人DMT1(1∶1 000稀释)、兔抗人GAPDH(1∶2 000稀释)于4 ℃孵育过夜,PBST洗涤3次,HRP标记的山羊抗兔IgG (1∶2 000稀释)室温孵育2 h,PBST洗涤3次,增强型化学放光试剂(Enhanced Chemiluminescence, ECL)发光底物浸泡1 min后用ProteinSimple多功能成像分析系统采集图片。
1.2.8 统计学处理数据以平均数±标准差(x±s)表示,用SPSS 22.0软件进行统计学分析,两组间比较采用t检验,多组间比较采用单因素方差分析(One-way ANOVA),总体方差P>0.05,采用最小显著差异t检验(LSD-t检验),当P<0.05认为差异具有统计学意义。
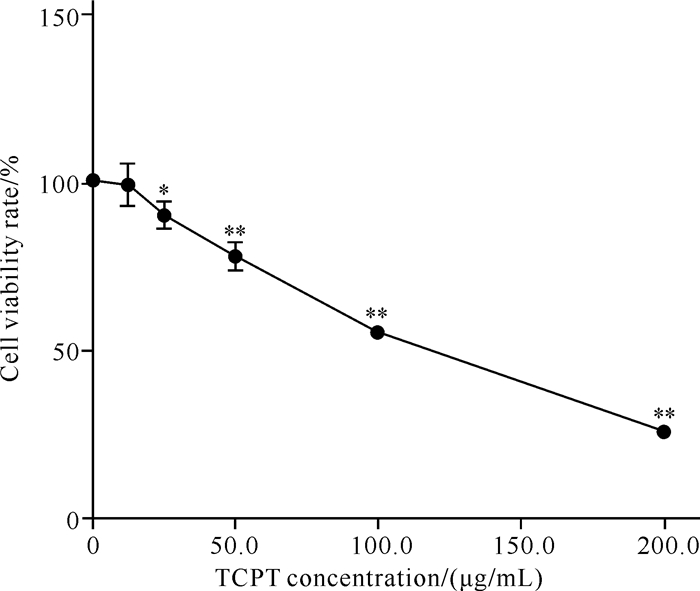
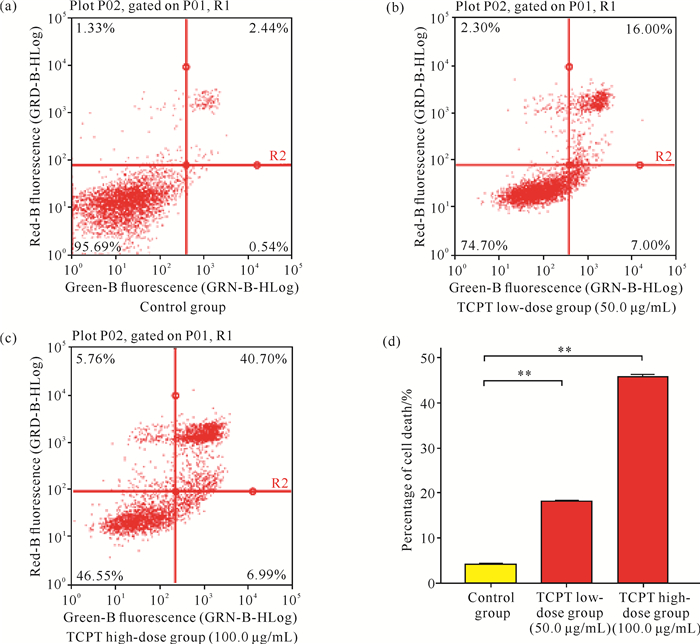
2 结果与分析 2.1 TCPT对HT-29细胞活性的影响CCK-8检测TCPT对人结直肠癌HT-29细胞的活性结果如图 1所示。TCPT处理可明显降低HT-29细胞活性,呈浓度依赖性,且差异具有统计学意义(P<0.05,P<0.01)。此外,采用流式细胞术进行细胞Annexin V-FITC双染,检测结果显示,随着TCPT浓度的增高,HT-29细胞的死亡数量显著增加[图 2: (a)、(b)、(c)],组间差异有统计学意义[图 2(d),P<0.01],说明TCPT可有效降低HT-29细胞的活力,诱导细胞死亡。
|
| *indicates P<0.05,** indicates P<0.01 compared with the control group. 图 1 CCK-8检测TCPT对HT-29细胞活性的影响 Fig. 1 Effect of TCPT on the activity of HT-29 cells detected by CCK-8 |
|
| **indicates P<0.01 compared with the control group.(a) (b) (c): FCM results of cell viability; (d): statistical analysis. 图 2 流式细胞术检测TCPT对HT-29细胞活性的影响 Fig. 2 Effect of TCPT on the activity of HT-29 cells detected by flow cytometry |
2.2 TCPT对HT-29细胞线粒体形态的影响
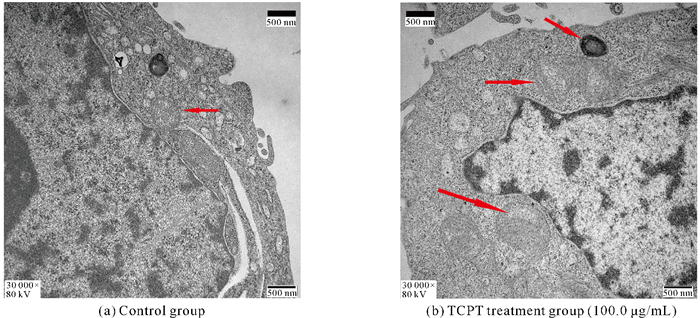
透射电子显微镜下观察,空白对照组HT-29细胞线粒体大小正常,外膜呈连续状,细胞质充盈,线粒体嵴排列均匀。采用TCPT处理后,细胞出现铁死亡特征性形态变化,表现为线粒体膜基质凝聚、密度增高,线粒体嵴减少,部分线粒体肿大,细胞质减少,可见空泡状,但细胞核核膜完整,形态无明显变化(图 3)。
|
| Red arrows indicate normal mitochondrial in control group and damaged mitochondrial in TCPT treatment group. 图 3 透射电子显微镜观测TCPT对HT-29细胞线粒体形态的影响(放大倍数30 000×) Fig. 3 Effect of TCPT on mitochondrial morphology of HT-29 cells observed by transmission electron microscopy (magnification 30 000×) |
2.3 TCPT对HT-29细胞中ROS含量的影响
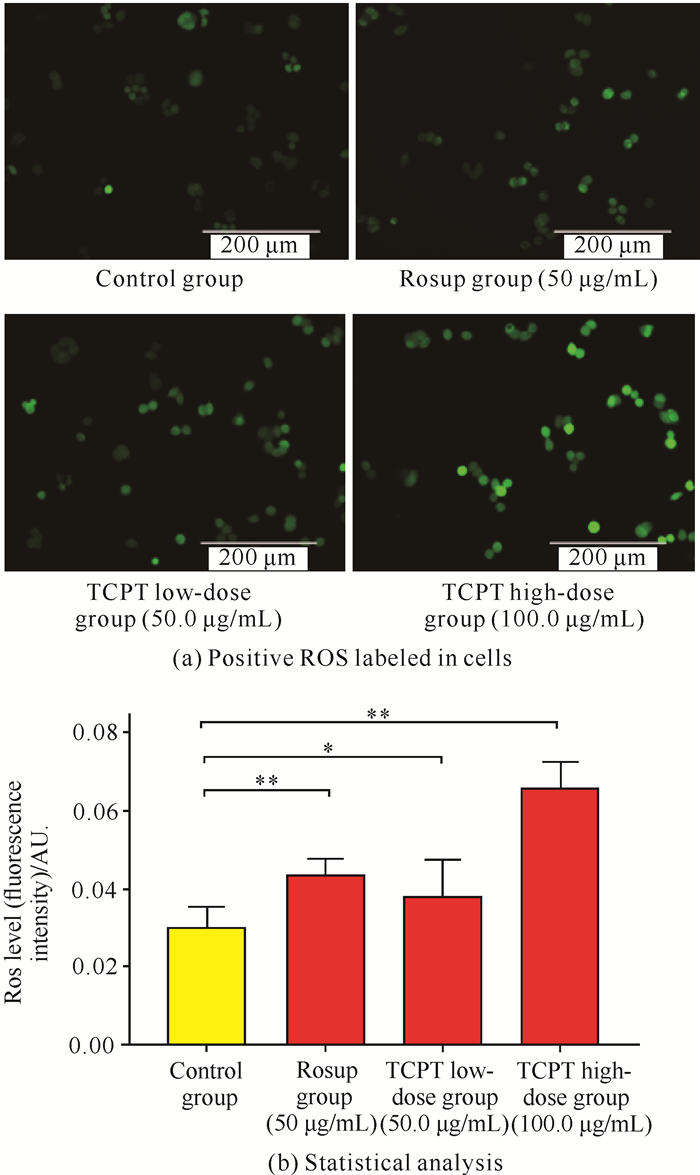
DCFH-DA检测结果显示,空白对照组HT-29细胞有微弱的绿色荧光,表明其本身具有一定的生成ROS的能力。经过TCPT处理后,阳性染色细胞数[图 4(a)]及细胞内荧光强度显著增加[图 4(b),P<0.05,P<0.01],荧光分布于整个细胞中,说明TCPT可有效提高HT-29细胞内ROS的水平。
|
| *indicates P<0.05,**indicates P<0.01 compared with the control group. 图 4 DCFH-DA检测HT-29细胞中ROS的含量(放大倍数200×) Fig. 4 Content of ROS in HT-29 cells detected by DCFH-DA (magnification 200×) |
2.4 TCPT对HT-29细胞内脂质过氧化物水平的影响
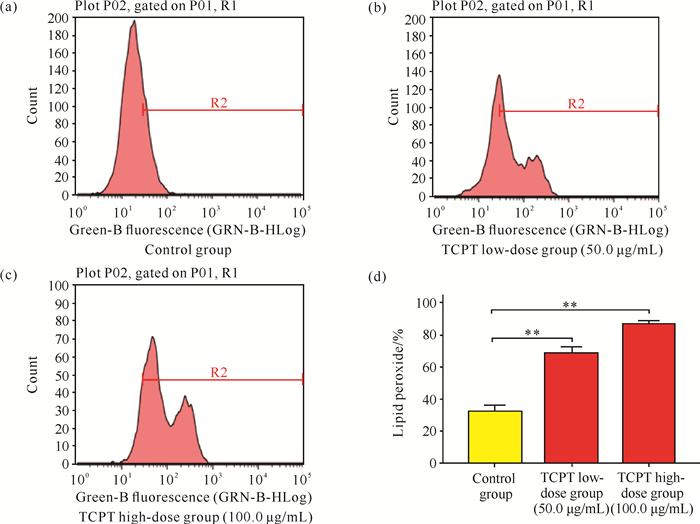
采用特异性荧光探针BODIPY 581/589 C11标记TCPT处理前后的HT-29细胞,通过流式细胞术检测,结果显示空白对照组HT-29细胞内脂质过氧化物的水平较低,与空白对照组相比,TCPT处理可引起HT-29细胞内脂质过氧化物水平显著增高[图 5: (a)、(b)、(c)],呈剂量依赖性,差异有统计学意义[图 5(d),P<0.05,P<0.01],说明TCPT可明显提高HT-29细胞内脂质过氧化物的水平。
|
| **indicates P<0.01 compared with the control group.(a) (b) (c): FCM results of lipid peroxides level in cells; (d): statistical analysis. 图 5 流式细胞术检测HT-29细胞中脂质过氧化物水平 Fig. 5 Level of lipid peroxide in HT-29 cells detected by flow cytometry |
2.5 TCPT对HT-29细胞铁死亡相关标志物蛋白表达水平的影响
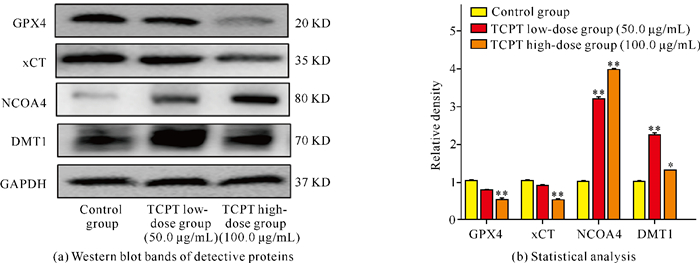
GPX4、xCT、NCOA4、DMT1是与铁死亡相关的关键分子标志物。Western blotting检测结果显示,经过TCPT处理后,与空白对照组相比,HT-29细胞中GPX4、xCT蛋白的表达量呈浓度依赖性降低,而NCOA4、DMT1蛋白的表达量则逐步升高[图 6(a)],差异均有统计学意义[图 6(b),P<0.05,P<0.01],说明TCPT可能通过氧化应激诱导HT-29细胞发生铁死亡。
|
| *indicates P<0.05,**indicates P<0.01 compared with the control group. 图 6 Western blotting检测细胞铁死亡相关标志物蛋白表达水平 Fig. 6 Expression of ferroptosis marker protein detected by Western blotting |
3 讨论
铁死亡是由于细胞内氧化应激过度激活,引起线粒体功能障碍,导致细胞铁代谢失调,进而启动的程序性死亡[4]。与传统的凋亡、自噬不同,铁死亡的诱因主要是铁过载造成的细胞内脂质过氧化物代谢失调,表现为ROS等自由基大量产生,脂质过氧化物水平显著升高,从而引起细胞死亡[7]。铁死亡具有独特的形态学特征和生化指标变化,形态学特征主要表现在细胞形态未出现异常改变,细胞膜以及核膜连续、完整,但线粒体出现明显形态学改变,如体积变小,线粒体嵴减少,双层膜变得致密、厚度增加[4];生化特征表现为细胞内铁离子和ROS积累、蛋白激酶活化、胱氨酸/谷氨酸逆转运体Xc-/GPX4被抑制、谷胱甘肽(GSH)合成减少等[8, 9]。
本研究首先通过CCK-8结合流式细胞术检测不同浓度的TCPT作用下,人结直肠癌HT-29细胞的活性变化,结果显示TCPT对HT-29细胞活性有显著的抑制作用,与TCPT浓度呈剂量正相关性。在高浓度TCPT作用下,透射电子显微镜观察到细胞线粒体体积变小,膜基质凝聚、密度增高,线粒体嵴减少等铁死亡特征性形态学改变,提示细胞可能发生铁死亡。此外,用荧光探针检测高、低浓度TCPT处理下HT-29细胞中的ROS和脂质过氧化物水平,结果发现TCPT处理后的HT-29细胞中的ROS和脂质过氧化物水平明显升高。上述研究结果证实了TCPT可以诱导HT-29细胞发生铁死亡。
多种天然药物可通过诱导肿瘤细胞铁死亡发挥抗肿瘤效应。例如,双氢青蒿素(DHA)可通过诱导头颈部鳞状细胞癌细胞铁死亡,引起反馈性周期阻滞,抑制其增殖[10]。另外,从石斛(Dendrobium nobile)中分离的天然产物毛兰素通过诱导肺癌细胞内ROS积累,提高脂质过氧化物水平,同时耗竭GSH水平,引起细胞铁死亡,进而抑制细胞生长和迁移[11]。具有香豆素母核的仙鹤草(Agrimonia pilosa)内酯可使细胞内ROS水平、总铁和二价铁离子水平升高,诱导卵巢癌细胞铁死亡,从而抑制其恶性进展[12]。这些研究结果表明,中草药天然提取物诱导癌细胞铁死亡可能是一个有效的抗肿瘤治疗靶点。
胱氨酸/谷氨酸反向转运体(System Xc-)是细胞内的重要抗氧化体系,含有2个亚基:跨膜转运蛋白xCT(SLC7A11)和伴侣调节蛋白CD98(SLC3A2)。System Xc-将细胞外胱氨酸转运至细胞内后,在谷氨酸半胱氨酸酶(GCL)和谷胱甘肽合成酶(GSS)的催化下合成GSH[13]。目前研究证实,Xc-/GPX4途径是通过诱导氧化应激途径调控细胞铁死亡的主要步骤[14]。GPX4的表达及活性是反映细胞内GSH代谢平衡的重要因素。当xCT亚基表达降低,细胞内胱氨酸的转运吸收将受影响,继而抑制细胞内GSH的合成,随后导致GPX4活性降低,细胞内活性氧生成与降解失去平衡,细胞抗氧化能力降低。因此,xCT及GPX4表达降低是铁死亡发生的关键标志性指标,表明细胞通过调控xCT/GPX4途径诱发铁死亡。此外,铁死亡特异性标志物DMT1及核受体共激活因子4(NCOA4)的表达变化也是反映细胞是否发生铁死亡的关键指标[15-17]。DMT1是细胞铁代谢中唯一向细胞内转运亚铁离子的蛋白,DMT1的表达量与细胞内铁的含量成正相关,是铁稳态的关键调节剂[18]。DMT1表达上调提示细胞内铁的摄取和沉积增加,进而引起ROS及丙二醛(Malondialdehyde,MDA)水平升高,诱导细胞铁死亡。NCOA4是“铁蛋白自噬”特异性的运输受体,通过调节铁蛋白中铁的储存和释放来维持细胞内的铁稳态,并通过介导的铁蛋白自噬,调控细胞对铁死亡的敏感性[19]。研究表明,NCOA4表达上调反映细胞内过度铁自噬,进而诱发铁死亡[20]。因此,DMT1及NCOA4表达上调提示细胞可能通过影响铁代谢途径诱发细胞铁死亡。
为进一步证实TCPT具有诱导HT-29细胞铁死亡的作用,本研究对铁死亡相关标志物GPX4、xCT、NCOA4、DMT1的蛋白表达进行了检测,Western blotting结果显示,HT-29细胞经TCPT处理后,GPX4、xCT蛋白的表达水平明显降低,NCOA4、DMT1蛋白的表达水平显著升高。结合前述TCPT降低细胞活性,引起线粒体超微结构变化,提高细胞内ROS和脂质过氧化物水平等结果,提示TCPT可通过诱导HT-29细胞ROS积累,引起脂质过氧化物水平升高,进而启动铁死亡程序。
4 结论本研究证实TCPT诱导人结直肠癌HT-29细胞ROS、脂质过氧化物水平升高,并通过下调xCT/GPX4途径中GPX4、xCT蛋白表达,上调铁代谢途径中NCOA4、DMT1蛋白表达,引起细胞启动铁死亡程序,从而抑制细胞增殖活性。这为结直肠癌的治疗提供了一种新的思路,也为TCPT抗结直肠癌作用的深入研究和相关药物的开发提供了理论依据。
| [1] |
BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA: A Cancer Journal for Clinicians, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
XU T, DING W, JI X, et al. Molecular mechanisms of ferroptosis and its role in cancer therapy[J]. Journal of Cellular and Molecular Medicine, 2019, 23(8): 4900-4912. DOI:10.1111/jcmm.14511 |
| [3] |
YU H T, GUO P Y, XIE X Z, et al. Ferroptosis, a new form of cell death, and its relationships with tumourous diseases[J]. Journal of Cellular and Molecular Medicine, 2017, 21(4): 648-657. DOI:10.1111/jcmm.13008 |
| [4] |
STOCKWELL B R, ANGELI J P F, BAYIR H, et al. Ferroptosis: a regulated cell death nexus linking metabolism, redox biology, and disease[J]. Cell, 2017, 171(2): 273-285. DOI:10.1016/j.cell.2017.09.021 |
| [5] |
陆国寿, 卢文杰, 黄周锋, 等. 瑶族药消瘤藤的化学成分分析[J]. 中国实验方剂学杂志, 2017, 23(14): 78-81. |
| [6] |
胡筱希, 刘瑛, 黄建猷, 等. 瑶药消瘤藤体外抗肿瘤活性部位筛选[J]. 中药药理与临床, 2019, 35(5): 52-56. |
| [7] |
周惠敏, 赵午莉, 张业繁, 等. 铁死亡及其在结直肠癌中的作用和机制[J]. 中国医药生物技术, 2022, 17(2): 150-153. |
| [8] |
FENG H, STOCKWELL B R. Unsolved mysteries: how does lipid peroxidation cause ferroptosis?[J]. PLoS Biology, 2018, 16(5): e2006203. DOI:10.1371/journal.pbio.2006203 |
| [9] |
ANGELI J P F, SHAH R, PRATT D A, et al. Ferroptosis inhibition: mechanisms and opportunities[J]. Trends in Pharmacological Sciences, 2017, 38(5): 489-498. DOI:10.1016/j.tips.2017.02.005 |
| [10] |
LIN R Y, ZHANG Z H, CHEN L F, et al. Dihydroartemisinin (DHA) induces ferroptosis and causes cell cycle arrest in head and neck carcinoma cells[J]. Cancer Letters, 2016, 381(1): 165-175. DOI:10.1016/j.canlet.2016.07.033 |
| [11] |
CHEN P, WU Q B, FENG J, et al. Erianin, a novel dibenzyl compound in Dendrobium extract, inhibits lung cancer cell growth and migration via calcium/calmodulin-dependent ferroptosis[J]. Signal Transduction and Targeted Therapy, 2020, 5(1): 51. DOI:10.1038/s41392-020-0149-3 |
| [12] |
LIU Y, LIU X B, WANG H, et al. Agrimonolide inhibits cancer progression and induces ferroptosis and apoptosis by targeting SCD1 in ovarian cancer cells[J]. Phytomedicine: International Journal of Phytotherapy and Phytopharmacology, 2022, 101: 154102. DOI:10.1016/j.phymed.2022.154102 |
| [13] |
DIXON S J, PATEL D N, WELSCH M, et al. Pharmacological inhibition of cystine-glutamate exchange induces endoplasmic reticulum stress and ferroptosis[J]. eLife, 2014, 3: e02523. DOI:10.7554/eLife.02523 |
| [14] |
GAO M H, MONIAN P, QUADRI N, et al. Glutaminolysis and transferrin regulate ferroptosis[J]. Molecular Cell, 2015, 59(2): 298-308. DOI:10.1016/j.molcel.2015.06.011 |
| [15] |
YU H C, YANG C C, JIAN L, et al. Sulfasalazine-induced ferroptosis in breast cancer cells is reduced by the inhibitory effect of estrogen receptor on the transferrin receptor[J]. Oncology Reports, 2019, 42(2): 826-838. |
| [16] |
LI L B, CHAI R, ZHANG S, et al. Iron exposure and the cellular mechanisms linked to neuron degeneration in adult mice[J]. Cells, 2019, 8(2): 198. DOI:10.3390/cells8020198 |
| [17] |
SONG Q X, PENG S X, SUN Z Q, et al. Temozolomide drives ferroptosis via a DMT1-dependent pathway in glioblastoma cells[J]. Yonsei Medical Journal, 2021, 62(9): 843-849. DOI:10.3349/ymj.2021.62.9.843 |
| [18] |
HUBERT N, HENTZE M W. Previously uncharacterized isoforms of divalent metal transporter (DMT)-1: implications for regulation and cellular function[J]. Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(19): 12345-12350. |
| [19] |
SANTANA-CODINA N, GIKANDI A, MANCIAS J D. The role of NCOA4-mediated ferritinophagy in ferroptosis[J]. Advances in Experimental Medicine and Biology, 2021, 1301: 41-57. |
| [20] |
HOU W, XIE Y C, SONG X X, et al. Autophagy promotes ferroptosis by degradation of ferritin[J]. Autophagy, 2016, 12(8): 1425-1428. |



