2. 广西壮族自治区河池生态环境监测中心,广西河池 547003;
3. 中国林业科学研究院热带林业实验中心,广西凭祥 532600;
4. 广西友谊关森林生态系统国家定位观测研究站,崇左凭祥友谊关森林生态系统广西野外科学研究观测站,广西凭祥 532600
2. Guangxi Zhuang Autonomous Region Hechi Eco-Environmental Monitoring Centre, Hechi, Guangxi, 547003, China;
3. Experiment Center of Tropical Forestry, Chinese Academy of Forestry, Pingxiang, Guangxi, 532600, China;
4. Guangxi Youyiguan Forest Ecosystem National Research Station, Youyiguan Forest Ecosystem Observation and Research Station of Guangxi, Pingxiang, Guangxi, 532600, China
磷(Phosphorus, P)是植物生长发育不可缺少的重要营养元素[1],在调节人工林生态系统的生物代谢过程中发挥着重要作用[2]。而P极易被土壤矿物吸附和固定,土壤中只有小部分无机磷(Pi)能被植物直接吸收利用[3],因此土壤P是森林生态系统初级生产力形成和功能发挥的关键限制性因子[4]。明确土壤中各形态P的含量及转化能力,对掌握土壤供P及保P能力极为重要。微生物作为连接“植物-土壤”的关键枢纽,是土壤中P转化的最重要参与者,如微生物通过分泌磷酸酶,促进有机磷(Po)转化为Pi[5]; 许多土壤细菌和真菌可以将不溶性磷酸盐转化为可溶性P供植物吸收利用[6]; 当微生物死亡时,微生物体内的P释放到生物可利用的P库中,被新生长的微生物和植物循环使用[7],在很大程度上会影响林分的生长情况。因此,从土壤微生物生物量、群落结构以及相关酶活性角度探究微生物性质对P组分的贡献及其驱动因素,将有助于理解P组分的调控过程,为有效缓解亚热带地区人工林土壤P限制,推动我国林业可持续发展提供科学依据。
杉木(Cunninghamia lanceolata)是我国亚热带地区的主要造林树种之一[8]。杉木人工林面积约占我国人工林面积的17.3%[9]。杉木人工林长期采取纯林、短轮伐和皆伐等经营方式[10],引起土壤质量和林分生产力不断下降,土壤P大量流失,对人工林生态系统稳定性造成巨大影响[11, 12]。珍贵阔叶树种不仅能够提供高价值木材以满足现代社会的需求,而且比杉木具有更复杂的根系、更多的高质量凋落物和更快的养分回归速率,能够有效改善土壤质量[13]。引入阔叶树种对杉木纯林进行复层异龄混交改造,是当前我国亚热带地区最常用的营林改造模式之一,但到目前为止,这种混交改造模式对土壤P组分及其有效性的影响,尤其是在植物、土壤和微生物耦合作用下的驱动机制我们仍知之甚少。本研究以复层异龄混交改造后的杉木混交林(Mixed C.lanceolata Plantation, MP)为研究对象,以邻近未改造的杉木纯林(Pure C.lanceolata Plantation, PP)作为对照,重点探究复层异龄混交改造对杉木人工林土壤P组分、土壤微生物生物量及其共现网络的结构和土壤酶活性等产生的影响,它们之间的关系,以及影响土壤P组分变化的最主要因素。研究成果将为深入了解并提高杉木人工林土壤P素可利用性提供理论支持,并对其可持续经营管理具有重要的指导意义。
1 材料与方法 1.1 供试材料与试验设计研究区位于广西凭祥市境内中国林业科学研究院热带林业实验中心(106°51′-106°53′E,22°02′-22°04′N),属亚热带地区,阳光及降水充足,为典型的亚热带季风气候,年平均气温为21.7 ℃,年平均降水量为1 400 mm,降雨主要集中在4-9月。地貌以低山丘陵为主,土壤类型主要为酸性红壤,其为长期高温和干湿交替条件下的花岗岩风化形成[14]。研究区域内人工林类型多样,以纯林和混交林为主,杉木和马尾松(Pinus massoniana)是种植最为广泛的人工林针叶树种,而常种植的阔叶树种包括红锥(Castanopsis hystrix)、香梓楠(Michelia hedyosperma)、米老排(Mytilaria laosensis)和格木(Erythrophleum fordii)等。
2021年8月初,在全面踏勘的基础上,为尽量减少立地条件对试验结果的影响,所有选定的立地在海拔、坡度、坡向、土壤类型、土地利用历史和经验管理措施等方面都是相似的。本研究以杉木纯林经间伐后引入阔叶树种进行混交改造形成的杉木/红锥/香梓楠复层异龄混交林(MP)为研究对象,并以邻近未改造的杉木纯林(PP)作为对照。复层异龄混交改造的过程如下:1993年对马尾松人工林进行皆伐并营造杉木人工纯林,初始种植密度为每公顷2 500株,并于2000年和2007年分别进行间伐,最后保持林分密度为每公顷1 200株。在2008年春季对杉木人工林进行复层异龄混交改造,并遵循树间距尽可能均匀的原则,进行强度间伐去除长势较差的树木,将林分密度从每公顷1 200株减少到每公顷450株。随后随机交叉补植2种珍贵阔叶树种(林龄为1年的红锥和香梓楠实生苗,每个树种的补植密度均为每公顷375株),最终使改造后的林分密度保持在每公顷1 200株(杉木∶红锥∶香梓楠=6∶5∶5)。本研究采用随机区组设计原则,一共设立4个区组(代表 4个重复),在每个区组内,PP和MP分别设置1个面积为400 m2(20 m×20 m)的标准样方。区组设计和样地布设图详见Gao等[15]的相关描述。
对每个样方进行林分调查,将20 m×20 m的样方划分为4个10 m×10 m的小样方,测量郁闭度、胸径、密度、树高等指标。每个样方随机布设8个1 m×1 m的凋落物框用于收集每个月的凋落物,凋落物收集后剔除杂质,在65 ℃条件下烘干至恒重,用于计算年凋落物量(Litter Fall,LF)及测定凋落物碳(C)、氮(N)、P的含量。采用土钻法采集0-20 cm土层的细根样品(土钻内径8.7 cm),挑出直径≤2 mm的活细根,将其洗净,并于65 ℃条件下烘干至恒重,测定细根生物量(Fine Root biomass, FR)。样地和植物性质的基本信息详见表 1。
| 林分类型 Plantation type |
郁闭度 Canopy density |
胸径/cm DBH/cm |
密度/(trees·hm-2) Density/(trees·hm-2) |
树高/m Tree height/m |
凋落物量/(kg·hm2· a-1) LF/(kg· hm2·a-1) |
细根生物量/(g·m-2) FR/(g·m-2) |
凋落物碳氮比 CLF/NLF |
凋落物氮磷比 NLF/PLF |
凋落物碳磷比 CLF/PLF |
| PP | 0.62±0.02b | 17.81±1.63a | 1100±34a | 17.03±0.45a | 6201.72±162.56b | 318.47±31.99b | 45.64±0.71a | 18.83±1.15a | 860.10±58.28a |
| MP | 0.78±0.03a | 16.40±2.15b | 950±25b | 14.90±1.08b | 8012.45±196.88a | 473.89±23.63a | 37.30±0.87b | 20.56±1.31a | 767.15±53.14a |
| Note: data=mean±standard error (n=4), different lowercase letters mean significant differences between PP and MP, P < 0.05. | |||||||||
1.2 土壤样品采集和分析 1.2.1 土壤样品采集
于2021年8月对试验样地8个样方的土壤样品进行采集,这一时期处于植物生长旺季,微生物活性处于较高水平。沿0°、45°、90°、135°、180°、225°、270°和315°方向,距离样方中心点5 m处设置8个采样点,清除每个采样点表面的枯枝落叶和石块等杂质后,采集0-20 cm的土壤样品。将每个样方8个采样点采集的土壤均匀混为一个样品,土壤样品带回实验室过2 mm筛后分为两份,一份用于后续土壤理化性质及土壤P组分的测定,一份保存在-80 ℃冰箱中用于土壤微生物相关指标的测定。
1.2.2 土壤理化性质的测定土壤pH值利用pH计测定(土∶水=1∶2.5,W∶V); 采用重铬酸钾外加热法测定土壤有机碳(SOC)[16]; 用凯氏定氮法测定土壤全氮(TN); 铵态氮(
| 林分类型 Plantatin type |
有机碳/(g·kg-1) SOC/(g·kg-1) |
全氮/(g·kg-1) TN/(g·kg-1) | 铵态氮/(mg·kg-1) NH4+-N/(mg·kg-1) |
硝态氮/(mg·kg-1) NO3--N/(mg·kg-1) |
全磷/(g·kg-1) TP/(g·kg-1) |
速效磷/(mg·kg-1) AP/(mg·kg-1) |
pH值 pH value |
土壤碳氮比 Csoil/Nsoil |
土壤氮磷比 Nsoil/Psoil |
土壤碳磷比 Csoil/Psoil |
| PP | 22.40±1.05b | 1.99±0.01b | 19.56±1.80b | 19.06±1.11a | 0.22±0.01a | 2.10±0.12b | 4.17±0.10a | 11.28±0.25b | 9.09±0.21a | 102.14±4.35b |
| MP | 27.90±0.80a | 2.10±0.04a | 27.88±2.45a | 21.65±1.68a | 0.23±0.02a | 2.82±0.16a | 4.04±0.06a | 13.33±0.51a | 9.22±0.27a | 123.51±5.56a |
| Note: data=mean±standard error (n=4), different lowercase letters mean significant differences between PP and MP, P < 0.05. | ||||||||||
1.2.3 土壤微生物生物量和群落结构的测定
微生物生物量碳(MBC)、微生物生物量氮(MBN)和微生物生物量磷(MBP)的测定主要依据氯仿-熏蒸浸提法[18]进行。将称取的新鲜土壤样品(10 g)在25 ℃气温下暴露于氯仿熏蒸24 h,然后将土壤与40 mL硫酸钾(0.5 mol·L-1)振荡混合30 min,过滤后采用TOC/TN同步分析仪(Multi N/C 3100CN,德国耶拿分析仪器有限公司)分别测定滤液中的C和N含量。MBC和MBN的计算通过熏蒸前后可提取的C和N水平的差异来确定,其中,提取的C转换为MBC的系数为0.45,提取的N转换为MBN的系数为0.54。MBP使用碳酸氢钠溶液(0.5 mol·L-1,pH值为8.5)进行提取[19],采用钼锑抗比色法[17]在多功能酶标仪(INFINITE M200 PRO, 瑞士帝肯有限公司)上对滤液的透光率进行测定,提取的P转换为MBP的系数为0.40。
土壤微生物群落测定使用PowerSoil DNA分离试剂盒(MN NucleoSpin 96 Soi)从0.25-0.50 g土壤样本中提取DNA,提取的DNA用纳米滴荧光计定量,并用OMEGA DNA纯化试剂盒对粗DNA提取液进行纯化。使用条形码引物806R以及338F扩增细菌16S rRNA基因的高变量V3-V4区,真菌内部转录间隔区(ITS)2用改良的ITS2F(5′-GCATCGATGAAGAACGCAGC-3′)和ITS2R(5′-TCCTCCGCTTATTGATATGC-3′)引物扩增。PCR产物用Monarch高分子量DNA提取试剂盒(Monarch DNA Extraction kit)进行纯化,在Illumina MiSeq平台上进行高通量对端测序。最后,使用UNITE数据库(Release 8.0 https://unite.ut.ee/)对序列进行分析,置信阈值为70%。
1.2.4 土壤酶活性的测定采用96孔荧光微孔板法测定土壤样品中的β-葡萄糖苷酶(BG)、纤维二糖水解酶(CB)、N-乙酰-葡萄糖苷酶(NAG)、亮氨酸氨基肽酶(LAP)和酸性磷酸酶(ACP)的活性[20]。采用浓度为200 μmol/L的4-methylumbelliferone(MUB)作为上述酶的标记底物,其中,4-MUB-β-D-glucoside用于BG的测定,4-MUB-β-D-cellobioside用于CB的测定,4-MUB-N-acetyl-β-D-glucosaminide用于NAG的测定,L-Leucine-7-amino-4-methylcoumarin用于LAP的测定,4-Methylumbelliferyl phosphate用于ACP的测定。BG、CB、NAG、LAP和ACP活性的单位均统一为nmol·g-1·h-1。
1.2.5 土壤磷组分的测定采用Hedley法[21]逐级分离提取,依次为树脂磷(Resin-P)、活性态磷(NaHCO3-Pi/Po)、微生物细胞磷(Microbial-Pi/Po)、中等活性态磷(NaOH-Pi/Po)、团聚体内磷(Sonic-Pi/Po)、磷灰石型磷(HCl-Pi/Po)和残留态磷(Residual-P)等7种P组分。其中将Resin-P归为极易利用性磷(Resin P, RP),NaHCO3-Pi/Po和Microbial-Pi/Po归为易利用性磷(Labile P, LP),NaOH-Pi/Po归为中等程度利用性磷(Moderately Available P, MAP),而把Sonic-Pi/Po、HCl-Pi/Po和Residual-P归为难利用性磷(Oculude P, OP)[22]。
1.3 数据统计与分析土壤全磷有效性的高低通过土壤磷素活化系数(Phosphorus Activation Coefficient, PAC)来评估[23],计算公式如下:
| $ PAC = \frac{{AP}}{{TP \times 1000}}{\rm{ }} \times 100\% {\rm{ , }} $ |
式中,AP为速效磷(mg·kg-1); TP为全磷(g·kg-1)。
运用Excel 2016和SPSS 25.0对本研究实验数据进行统计分析,得到平均值及标准误。采用独立样本t检验(Independent sample t-test)和最小显著差异法(Least-Significant Difference, LSD)对PP和MP之间的土壤理化性质、土壤P组分、土壤微生物生物量和土壤酶活性等指标进行组间差异分析(P < 0.05);采用Pearson相关性分析土壤各P组分与植物性质、土壤性质、微生物特性和酶活性之间的相关性,显著水平均设置为P < 0.05;使用主成分分析(PCA)区分PP和MP土壤P组分的变化,使用冗余分析(RDA)筛选出影响土壤P组分的关键因子,PCA和RDA相关程序均在Canoco 5.0上完成。运用R 4.3.2进行共现网络分析(Co-occurrence network analysis),探究PP和MP土壤细菌和真菌群落之间的相互作用,并用Gephi 0.10.1软件完成共现网络图的制作。其他作图均在Origin 2023、Microsoft Visio 2013上完成。
2 结果与分析 2.1 土壤磷组分和活化系数特征由图 1可知,与PP相比,MP的RP、LP、MAP和OP含量均极显著提高(P < 0.01),分别提高9.43%、9.20%、11.64%和11.71%,PAC显著提高27.13%(P < 0.05)。
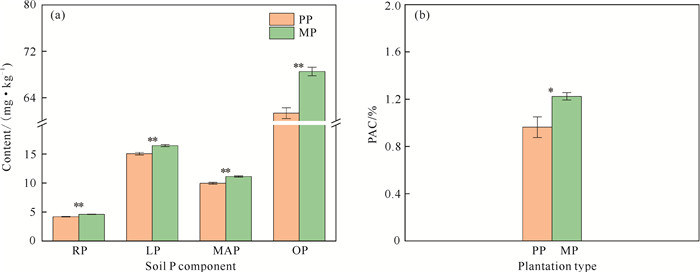
|
| Data=mean±standard error (n=4);* and ** indicate significant differences at 0.05 and 0.01 levels respectively. 图 1 PP和MP土壤P组分含量和P素活化系数(PAC)的变化 Fig. 1 Changes in content of soil P components and P activation coefficient in PP and MP |
2.2 土壤微生物生物量和群落共现网络特征
与PP相比,MP的土壤MBC、MBN和MBP含量分别显著增加13.52%(P < 0.01)、31.11%(P < 0.01)和55.78%(P < 0.01)(图 2)。土壤微生物群落共现网络分析结果如图 3和表 3所示。PP的微生物共现网络中细菌的最关键节点是OTU624[放线菌门(Actinobacteria)],连接度为40;真菌的最关键节点是OTU1905[子囊菌门(Ascomycota)],连接度为32。在门水平上统计所有节点前10位的优势菌种,结果表明细菌共计7种,占比62.22%,分别为酸杆菌门(Acidobacteria, 18.10%)、变形菌门(Proteobacteria, 14.50%)、放线菌门(10.39%)、浮霉菌门(Planctomycetes, 8.58%)、绿弯菌门(Chloroflexi, 5.03%)、疣微菌门(Verrucomicrobia, 3.55%)和WPS-2(2.07%); 真菌2种,占比32.54%,分别为子囊菌门(28.40%)和担子菌门(Basidiomycota, 4.14%)[图 3(a)]。MP的微生物共现网络中细菌的最关键节点是OTU790(放线菌门),连接度为34;真菌的最关键节点是OTU1905(子囊菌门),连接度为34。在门水平上统计所有节点前10位的优势菌种,结果表明细菌共计7种,占比64.77%,分别为酸杆菌门(18.20%)、变形菌门(14.95%)、浮霉菌门(11.14%)、放线菌门(9.70%)、绿弯菌门(4.85%)、疣微菌门(3.50%)和WPS-2(2.43%); 真菌2种,占比29.31%,分别为子囊菌门(25.54%)和担子菌门(3.77%)[图 3(b)]。土壤微生物群落关键的共现网络参数如节点数量、正相关边数、负相关边数、平均度和平均加权度均表现为MP高于PP(表 3)。
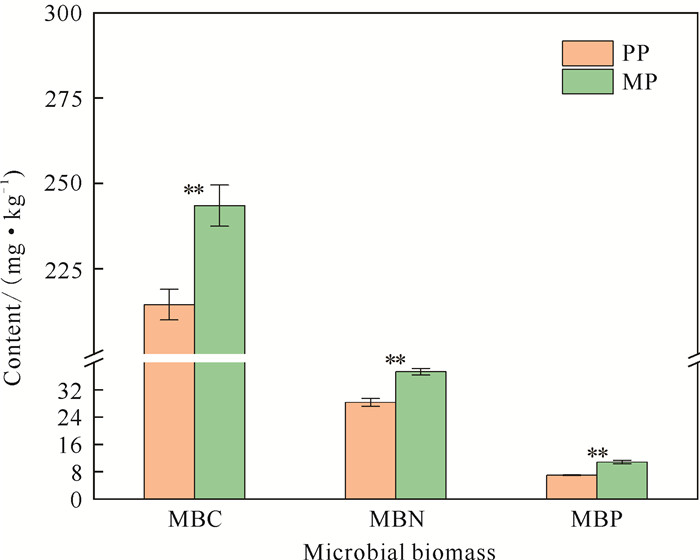
|
| Data=mean±standard error (n=4);** indicates significant differences at 0.01 level. 图 2 PP和MP土壤微生物生物量C、N、P含量的变化 Fig. 2 Changes in soil microbial biomass carbon, nitrogen and phosphorus content in PP and MP |
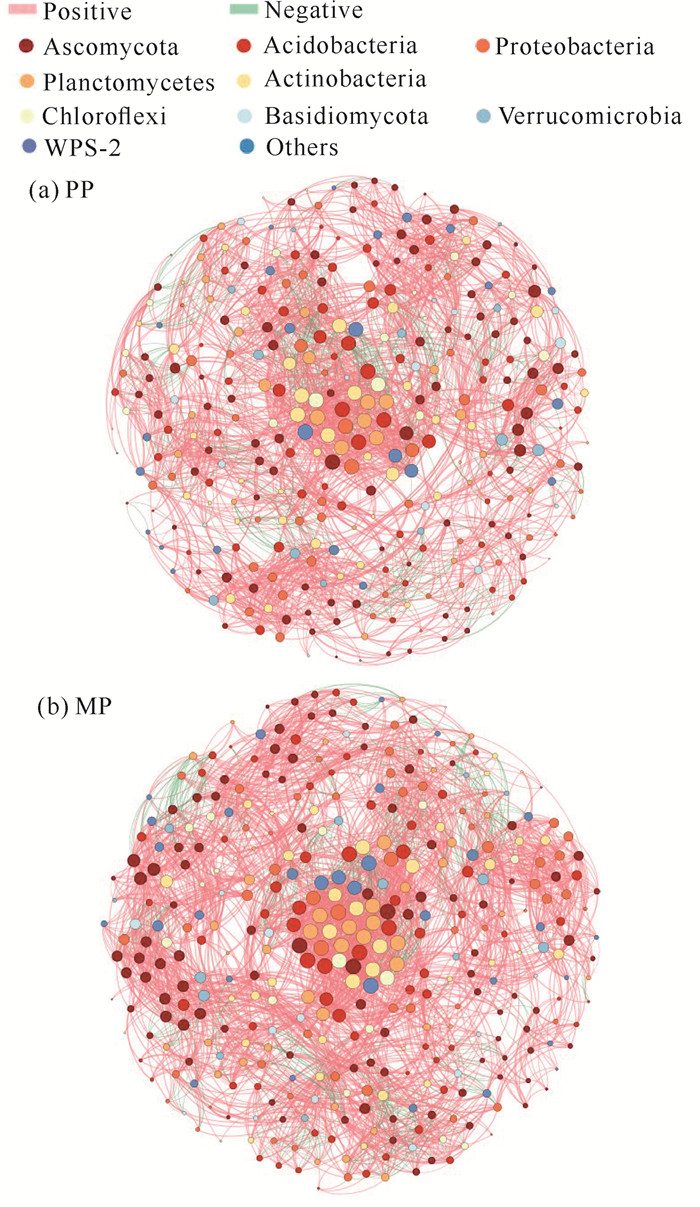
|
| Each node represents an OUT, and the size of the node is proportional to the number of connections. Red and green lines indicate positive and negative correlations between nodes, respectively (Spearman, P < 0.05, R>0.6). 图 3 基于OTU水平的PP和MP的土壤细菌、真菌群落共现网络 Fig. 3 Co-occurrence network of bacteria and fungi at OTU level in PP and MP |
| 林分类型 Plantation type |
节点数量 NN |
正相关边数 PCNE |
负相关边数 NCNE |
平均度 AD |
平均加权度 AWD |
| PP | 338 | 2 823 | 451 | 19.37 | 0.40 |
| MP | 371 | 3 366 | 522 | 20.96 | 0.44 |
| Note: NN indicates number of nodes; PCNE indicates positive correlation number of edges; NCNE indicates negative correlation number of edges; AD indicates average degree; AWD indicates average weighting degree. | |||||
2.3 土壤酶变化特征及其相关性分析
与PP相比,MP中与C代谢相关的BG和CB的土壤酶活性分别增加175.58%(P < 0.01)和21.81%(P<0.05)[图 4(a)],与N代谢相关的NAG的土壤酶活性增加113.30%(P<0.001)[图 4(b)],与P代谢相关的ACP的土壤酶活性增加71.49%(P < 0.01)[图 4(c)]。

|
| Data=mean±standard error (n=4);*, ** and *** indicate significant differences at 0.05, 0.01 and 0.001 levels respectively. 图 4 PP和MP土壤C、N、P代谢酶活性变化 Fig. 4 Changes in activities of soil C, N and P metabolic enzymes in PP and MP |
由图 5可知,土壤中C代谢酶活性与N代谢酶活性、N代谢酶活性与P代谢酶活性之间呈极显著正相关关系(P < 0.01),C代谢酶活性与P代谢酶活性呈显著正相关关系(P < 0.05)。
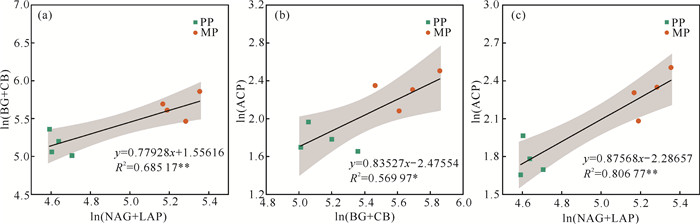
|
| * and ** indicates significant difference at 0.05, 0.01 levels respectively. 图 5 PP和MP土壤C、N、P水解酶之间的关系 Fig. 5 Relationship among soil C, N and P hydrolytic enzymes in PP and MP |
2.4 影响土壤磷组分的因子分析
相关性分析结果表明,在植物性质中,除FR与RP无显著关系外,LF、FR与各P组分均呈显著正相关关系(P < 0.05),而CLF/NLF与各P组分均呈显著负相关关系(P < 0.05);在土壤性质中,SOC、TN与各P组分均呈显著正相关关系(P < 0.05),
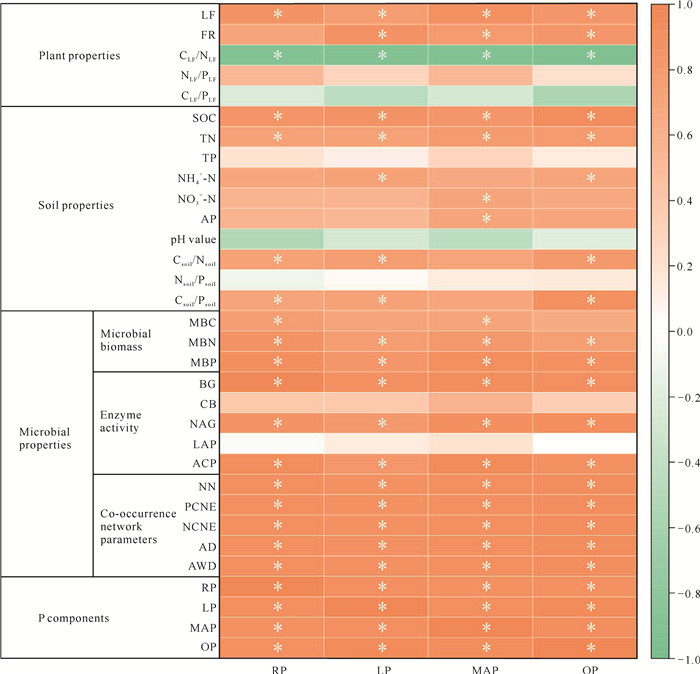
|
| * indicates significant differences at 0.05 level. 图 6 土壤P组分与植物性质、土壤性质、微生物性质的Pearson相关关系 Fig. 6 Pearson correlations of soil phosphorus components with plant properties, soil properties and microbial properties |
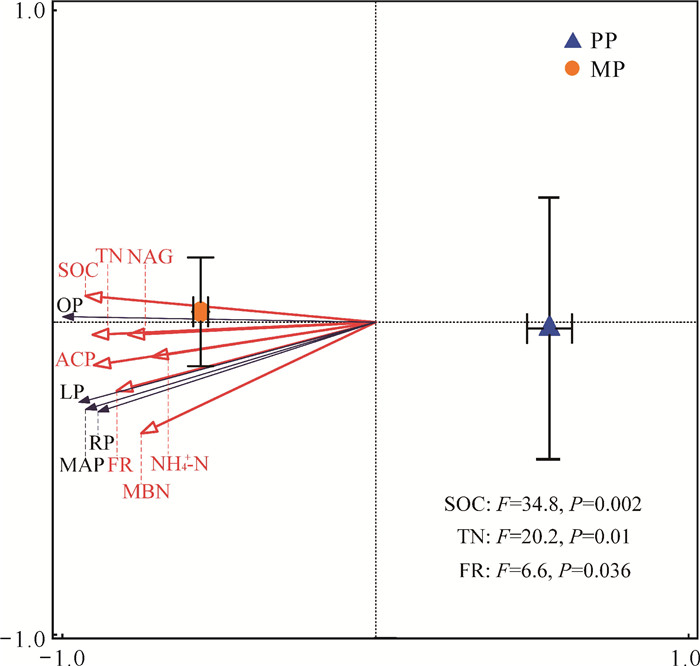
|
| 图 7 植物性质、土壤性质、微生物生物量、酶活性与土壤磷组分的冗余分析 Fig. 7 RDA of plant properties, soil properties, microbial biomass, enzyme activities and soil P components |
3 讨论 3.1 复层异龄混交改造对杉木人工林土壤P组分含量的影响
本研究采用Hedley法[21]提取土壤中的P,并根据植物对P吸收的难易程度将其划分为RP、LP、MAP和OP共4类。研究发现杉木人工纯林经间伐后引入阔叶树种进行复层异龄混交改造能有效提高土壤中各P组分的含量,其中,RP和LP是植物可以直接吸收利用的有效P源,MAP和OP可以作为植物潜在的有效P源,说明杉木人工林进行复层异龄混交改造后其土壤具有较高的P有效性和供应潜力。其原因可能是:(1)间伐改造过程中引入红锥和香梓楠等阔叶树种,改变了地上部分的植被组成,增加了凋落物的数量和质量,也改变了地下细根生物量与分泌物等,这不仅增加了土壤有机质的输入,也促进了酸性条件下有机质向P素的转化及迁移,这与曾晓敏等[24]发现亚热带山地森林土壤P组分变化主要受有机碳调控的结论相似。(2)针阔混交林土壤P的吸附量较低而解吸量较高,也会提高土壤有效P的含量[25]。(3)凋落物中储存的P只有在微生物的分解作用下才能被释放,一部分被植物吸收或固持,另一部分被微生物同化后储存在体内,并在微生物死亡细胞裂解后释放或以有机P化合物的形式储存[26],因此,MP中具有较高的MBP从而提高其土壤各P组分。(4)土壤微生物群落除自身生物量P对土壤P含量有直接的贡献外,还能通过改变其自身活性来促进包括Pi的活化和Po的矿化等P转化活动,从而提高土壤P的有效性[27]。
通过冗余分析对影响土壤P组分的环境因子进行排序后确定SOC和TN是驱动土壤各P组分变化的最关键因子,这一结果与许多研究结论相似[28, 29]。Hou等[30]的研究结果指出SOC含量与P含量呈正相关关系,尤其是Po含量。因为土壤中若含有较多的SOC,其分解后产生的可溶性C等中间产物能够引发土壤中P的反应和吸附作用,最终调节P组分的动态。本研究中,杉木纯林转换为复层异林混交林后显著增加了SOC和TN,导致其土壤养分化学计量(Csoil/Nsoil和Nsoil/Psoil)显著提高,使得土壤微生物群落组成发生变化并最终改变土壤P组分。这可能是由于养分化学计量可以影响土壤有机质的矿化,而复层异林混交林调节生物和非生物因素变化引起土壤微生物群落组成的改变,进而影响土壤P组分[31]。
3.2 复层异龄混交改造对杉木人工林土壤P转化的影响土壤P的可利用性被广泛认为是限制热带亚热带森林生态系统初级生产力的最关键因素之一,土壤P的转化是向植被提供P的基础[32]。本研究中MP的AP含量高于PP(表 2),这种变化似乎与土壤微生物群落生物量和活动的反应更密切相关。土壤酶是参与土壤P组分转化的重要媒介[33],是微生物营养需求和代谢过程中的指标,在土壤养分代谢过程中发挥着重要作用[34]。土壤酶活性受到气候、土壤性质、植被类型、人类活动等多方面的影响[35]。本研究中,PP引入红锥、香梓楠进行异龄混交改造后,与C代谢相关的BG和CB、与N代谢相关的NAG、与P代谢相关的ACP活性均显著提高(图 4),表明对杉木人工林进行复层异龄改造能促进土壤中C、N、P的循环。本研究发现土壤中与C、N和P水解相关的酶活性之间具有很强的协同作用(图 5),表明土壤C、N和P之间的变化具有强烈的相关性,与Zhang等[36]的研究结果相似,其结果显示土壤微生物群落具有相似的养分获取分配模式。此外,Waring等[37]也发现在热带地区土壤酶活性之间存在显著的正相关关系,强调土壤养分和微生物之间的重要联系。杉木人工林复层异龄混交改造可以改变林分根系形态和有机酸分泌,从而使微生物的群落结构更复杂,增强ACP活性,促进植物对土壤P的吸收和利用,最终提高土壤P的转化和有效性[38]。
微生物作为连接地上、地下功能关系的纽带,参与人工林生态系统土壤P组分的转化和迁移过程。Li等[39]研究表明,微生物活性的提高可以加速Pi的固定,其同化吸收的P以MBP的形式储存并在其死亡后被分解,成为植物潜在的AP源。另外,由于土壤微生物活性(与C、N和P循环相关的酶活性)提高后,其与植物间的养分竞争加剧,从而增加P在微生物细胞内的固持[40]。同时,MBP可以减少因化学吸附反应所导致的LP损失。本研究中各P组分均与ACP呈显著正相关关系,与李银等[41]发现森林土壤的P含量与ACP活性显著相关的结果相似,间接表明ACP促进Po的分解并提升其向Pi的转化潜力,提高P的有效性[42]。
4 结论杉木人工林引入红锥、香梓楠进行复层异龄混交改造后,通过影响植物性质和土壤理化性质,可以提高土壤中各P组分含量和与土壤C、N、P相关的代谢酶活性,进而改变土壤P组分的组成,特别是土壤中可被植物直接利用的RP、LP,以及能够转化为被植物吸收利用的潜在P源(即MAP),而SOC、TN和FR是驱动土壤各P组分变化的最关键因子。杉木人工林复层异龄混交改造能使其土壤微生物群落的互作关系变得更复杂,ACP活性增强,最终提高土壤P的转化和有效性,促进植物对土壤P的吸收和利用。
| [1] |
WU H L, CHEN L, OUYANG S, et al. Phosphorus cycling and supply-demand balance across a chronosequence of Chinese fir plantations[J]. Catena, 2023, 228: 107117. DOI:10.1016/j.catena.2023.107117 |
| [2] |
WANG Q, WANG J L, LI Y Z, et al. Influence of nitrogen and phosphorus additions on N2-fixation activity, abundance, and composition of diazotrophic communities in a Chinese fir plantation[J]. The Science of the Total Environment, 2018, 619/620: 1530-1537. DOI:10.1016/j.scitotenv.2017.10.064 |
| [3] |
胡一帆, 刘宣, 李宇, 等. 华西雨屏区不同林龄柳杉人工林土壤磷组分特征[J]. 生态学报, 2024, 44(2): 686-698. |
| [4] |
WANG C Q, XUE L, JIAO R Z. Soil phosphorus fractions, phosphatase activity, and the abundance of phoC and phoD genes vary with planting density in subtropical Chinese fir plantations[J]. Soil and Tillage Research, 2021, 209(4): 104946. |
| [5] |
OBERSON A, FRIESEN D K, RAO I M, et al. Phosphorus transformations in an Oxisol under contrasting land-use systems: the role of the soil microbial biomass[J]. Plant and Soil, 2001, 237(2): 197-210. DOI:10.1023/A:1013301716913 |
| [6] |
KALAYU G. Phosphate solubilizing microorganisms: promising approach as biofertilizers[J]. International Journal of Agronomy, 2019, 2019: 1-7. |
| [7] |
CHEN J, SEVEN J, ZILLA T, et al. Microbial C∶N∶P stoichiometry and turnover depend on nutrients availability in soil: a 14C, 15N and 33P triple labelling study[J]. Soil Biology and Biochemistry, 2019, 131: 206-216. DOI:10.1016/j.soilbio.2019.01.017 |
| [8] |
戴俊, 罗启亮, 董利军, 等. 施肥、造林密度和种植穴规格对杉木幼林生长的影响[J]. 广西林业科学, 2023, 52(3): 284-290. |
| [9] |
林莹, 廖姝, 吴福忠, 等. 米槠和杉木人工林凋落叶和土壤磷淋溶损失[J]. 应用与环境生物学报, 2024, 30(3): 530-536. |
| [10] |
徐海东, 苑海静, 熊静, 等. 杉阔异龄复层林对土壤团聚体稳定性和有机碳及养分储量的影响[J]. 林业科学研究, 2020, 33(3): 107-115. |
| [11] |
李惠通, 张芸, 魏志超, 等. 不同发育阶段杉木人工林土壤肥力分析[J]. 林业科学研究, 2017, 30(2): 322-328. |
| [12] |
谭许脉, 张文, 肖纳, 等. 杉木林改造成乡土阔叶林对林下植物物种组成和多样性的影响[J]. 生态学报, 2022, 42(7): 2931-2942. |
| [13] |
MING A G, YANG Y J, LIU S R, et al. Effects of near natural forest management on soil greenhouse gas flux in Pinus massoniana(Lamb.) and Cunninghamia lanceolata(Lamb.) Hook. plantations[J]. Forests, 2018, 9(5): 229. DOI:10.3390/f9050229 |
| [14] |
陈永康, 谭许脉, 李萌, 等. 珍贵固氮树种降香黄檀与二代巨尾桉混交种植对土壤微生物群落结构和功能的影响[J]. 广西植物, 2021, 41(9): 1476-1485. |
| [15] |
GAO G N, HUANG X M, XU H C, et al. Conversion of pure Chinese fir plantation to multi-layered mixed plantation enhances the soil aggregate stability by regulating microbial communities in subtropical China[J]. Forest Ecosystems, 2022, 9: 100078. DOI:10.1016/j.fecs.2022.100078 |
| [16] |
鲍士旦. 土壤农化分析[M]. 3版. 北京: 中国农业出版社, 2000.
|
| [17] |
MURPHY J, RILEY J P. A modified single solution method for the determination of phosphate in natural waters[J]. Analytica Chimica Acta, 1962, 27: 31-36. DOI:10.1016/S0003-2670(00)88444-5 |
| [18] |
VANCE E D, BROOKES P C, JENKINSON D S. An extraction method for measuring soil microbial biomass C[J]. Soil Biology and Biochemistry, 1987, 19(6): 703-707. DOI:10.1016/0038-0717(87)90052-6 |
| [19] |
BROOKES P C, POWLSON D S, JENKINSON D S. Measurement of microbial biomass phosphorus in soil[J]. Soil Biology and Biochemistry, 1982, 14(4): 319-329. DOI:10.1016/0038-0717(82)90001-3 |
| [20] |
SAIYA-CORK K R, SINSABAUGH R L, ZAK D R. The effects of long term nitrogen deposition on extracellular enzyme activity in an Acer saccharum forest soil[J]. Soil Biology and Biochemistry, 2002, 34(9): 1309-1315. DOI:10.1016/S0038-0717(02)00074-3 |
| [21] |
HEDLEY M J, STEWART J W B, CHAUHAN B S. Changes in inorganic and organic soil phosphorus fractions induced by cultivation practices and by laboratory incubations[J]. Soil Science Society of America Journal, 1982, 46(5): 970-976. DOI:10.2136/sssaj1982.03615995004600050017x |
| [22] |
SUI Y, THOMPSON M L, SHANG C. Fractionation of phosphorus in a mollisol amended with biosolids[J]. Soil Science Society of America Journal, 1999, 63(5): 1174-1180. DOI:10.2136/sssaj1999.6351174x |
| [23] |
YANG Q Q, AI X Y, SHENG M H, et al. Differences in the distribution, availability, and sorption-desorption isotherms of phosphorus fractions in soil aggregates from cut slopes with different restoration methods[J]. Soil and Tillage Research, 2023, 234: 105822. DOI:10.1016/j.still.2023.105822 |
| [24] |
曾晓敏, 范跃新, 林开淼, 等. 亚热带不同海拔黄山松林土壤磷组分及微生物特征[J]. 生态学报, 2018, 38(18): 6570-6579. |
| [25] |
查美琴, 徐海东, 成向荣, 等. 不同林龄杉木+闽楠复层林土壤磷形态及微生物功能多样性变化[J]. 生态学报, 2020, 40(19): 6938-6947. |
| [26] |
李新乐, 侯向阳, 穆怀彬, 等. 连续6年施磷肥对土壤磷素积累、形态转化及有效性的影响[J]. 草业学报, 2015, 24(8): 218-224. |
| [27] |
RICHARDSON A E, SIMPSON R J. Soil microorganisms mediating phosphorus availability update on microbial phosphorus[J]. Plant Physiology, 2011, 156(3): 989-996. DOI:10.1104/pp.111.175448 |
| [28] |
WU W X, ZHOU X G, WEN Y G, et al. Coniferous-broadleaf mixture increases soil microbial biomass and functions accompanied by improved stand biomass and litter production in subtropical China[J]. Forests, 2019, 10(10): 879. DOI:10.3390/f10100879 |
| [29] |
MENEZES-BLACKBURN D, PAREDES C, ZHANG H, et al. Organic acids regulation of chemical-microbial phosphorus transformations in soils[J]. Environmental Science & Technology, 2016, 50(21): 11521-11531. |
| [30] |
HOU E Q, TANG S B, CHEN C R, et al. Solubility of phosphorus in subtropical forest soils as influenced by low-molecular organic acids and key soil properties[J]. Geoderma, 2018, 313: 172-180. DOI:10.1016/j.geoderma.2017.10.039 |
| [31] |
BAI J H, YE X F, JIA J, et al. Phosphorus sorption-desorption and effects of temperature, pH and salinity on phosphorus sorption in marsh soils from coastal wetlands with different flooding conditions[J]. Chemosphere, 2017, 188: 677-688. DOI:10.1016/j.chemosphere.2017.08.117 |
| [32] |
CHEN H, LI D J, XIAO K C, et al. Soil microbial processes and resource limitation in karst and non‐karst forests[J]. Functional Ecology, 2018, 32(5): 1400-1409. DOI:10.1111/1365-2435.13069 |
| [33] |
TURNER B L, BRENES-ARGUEDAS T, CONDIT R. Pervasive phosphorus limitation of tree species but not communities in tropical forests[J]. Nature, 2018, 555(7696): 367-370. DOI:10.1038/nature25789 |
| [34] |
WANG B, XUE S, LIU G B, et al. Changes in soil nutrient and enzyme activities under different vegetations in the Loess Plateau Area, Northwest China[J]. Catena, 2012, 92: 186-195. DOI:10.1016/j.catena.2011.12.004 |
| [35] |
WU J Q, WANG H Y, LI G, et al. Vegetation degradation impacts soil nutrients and enzyme activities in wet meadow on the Qinghai-Tibet Plateau[J]. Scientific Reports, 2020, 10(1): 21271. DOI:10.1038/s41598-020-78182-9 |
| [36] |
ZHANG J Y, AI Z M, LIANG C T, et al. How microbes cope with short-term N addition in a Pinus tabuliformis forest-ecological stoichiometry[J]. Geoderma, 2019, 337: 630-640. DOI:10.1016/j.geoderma.2018.10.017 |
| [37] |
WARING B G, WEINTRAUB S R, SINSABAUGH R L. Ecoenzymatic stoichiometry of microbial nutrient acquisition in tropical soils[J]. Biogeochemistry, 2014, 117(1): 101-113. DOI:10.1007/s10533-013-9849-x |
| [38] |
杨万勤, 王开运. 森林土壤酶的研究进展[J]. 林业科学, 2004, 40(2): 152-159. DOI:10.3321/j.issn:1001-7488.2004.02.027 |
| [39] |
LI M, YOU Y M, TAN X M, et al. Mixture of N2-fixing tree species promotes organic phosphorus accumulation and transformation in topsoil aggregates in a degraded karst region of subtropical China[J]. Geoderma, 2022, 413: 115752. DOI:10.1016/j.geoderma.2022.115752 |
| [40] |
OLANDER L P, VITOUSEK P M. Biological and geochemical sinks for phosphorus in soil from a wet tropical forest[J]. Ecosystems, 2004, 7(4): 404-419. |
| [41] |
李银, 曾曙才, 黄文娟. 模拟氮沉降对鼎湖山森林土壤酸性磷酸单酯酶活性和有效磷含量的影响[J]. 应用生态学报, 2011, 22(3): 631-636. |
| [42] |
WANG J C, REN C Q, CHENG H T, et al. Conversion of rainforest into agroforestry and monoculture plantation in China: consequences for soil phosphorus forms and microbial community[J]. The Science of the Total Environment, 2017, 595: 769-778. DOI:10.1016/j.scitotenv.2017.04.012 |



