2. 中国林业科学研究院热带林业实验中心, 广西凭祥 532600;
3. 广西友谊关森林生态系统国家定位观测研究站, 崇左凭祥友谊关森林生态系统广西野外科学研究观测站, 广西凭祥 532600
2. China Experiment Center of Tropical Forestry, Chinese Academy of Forestry, Pingxiang, Guangxi, 532600, China;
3. Guangxi Youyiguan Forest Ecosystem National Research Station, Youyiguan Forest Ecosystem Observation and Research Station of Guangxi, Pingxiang, Guangxi, 532600, China
土壤胞外酶主要是由微生物活动代谢产生,参与碳(C)、氮(N)、磷(P)等的循环,在一定程度上代表了微生物对养分的需求与环境中养分供应之间的关系。在陆地生态系统中,胞外酶活性(EEA)被视为土壤生产力和养分状况预测的敏感指标[1]。胞外酶化学计量比(EES)反映了土壤养分的供应情况以及微生物活动所受到的养分限制,被广泛用于评估土壤养分状况[2]。为了更准确地评估土壤微生物对养分的利用效率和资源需求状况,越来越多的研究集中于土壤胞外酶活性及其化学计量特征上[3, 4]。森林生态系统因环境条件存在差异,因此养分需求不同,其酶化学计量比也会存在差异[5, 6]。全球范围尺度的数据表明酶化学计量比能够有效地揭示土壤养分特征,但小区域尺度上土壤养分含量往往受林分类型、土壤利用方式以及林下植被类型等因素的影响,使小区域尺度上土壤养分存在差异[2, 7]。尽管不同研究都发现不同的环境因子与酶活性、酶化学计量比密切相关,但是其影响机制尚未明确,因此需进一步研究特定区域中土壤酶活性及酶化学计量比的变化特征及主要驱动因子。
土壤团聚体酶活性及酶化学计量比可有效反映或预测土壤养分利用状况以及土壤质量的变化。土壤团聚体是土壤物理结构的基本单位[8]。团聚体的粒径分布及其含量不仅决定着土壤的孔隙分布和土壤抵抗外界压力的能力,而且还决定着土壤储存养分的能力,土壤养分变化的实质是各级团聚体变化的整合结果[9]。不同粒径土壤团聚体的胶结物质类型和小环境存在差异,导致它们内部物质组成和稳定性不同,进而使得酶活性也产生差异[10, 11]。团聚体具有孔隙小、容积密度高和易弯曲等特征,这些特征减少了外部微生物进入团聚体内部的机会,因此团聚体可有效保护其内部的微生物、有机物质和酶等,防止酶活性下降或失活。另外,相较于小团聚体,大团聚体的物理结构减少了有机物质、微生物和酶之间的接触,因此小团聚体具有更强的酶活性[12, 13]。
马尾松(Pinus massoniana)是我国亚热带地区常见的乡土针叶树种,因其生长快、适应环境能力强、材质优良等被广泛种植。马尾松人工林大规模单一纯林种植对我国人工林的可持续发展产生了一系列影响,例如病虫害频发、土地退化、土壤肥力下降、水土流失和生物多样性降低等,严重阻碍了其可持续发展[14]。引入乡土阔叶树种对马尾松人工纯林进行异龄混交改造被认为是提高土壤肥力和林地生产力的重要管理措施之一[15]。然而,改造后土壤团聚体粒径的改变对土壤酶活性、酶化学计量比的影响及其机制仍缺乏深入探究。因此,本研究选取马尾松人工纯林间伐后引入一种或多种阔叶树种混交改造形成的异龄复层混交林作为研究对象,以邻近未改造的马尾松纯林为对照,测定土壤原土和不同粒径团聚体的C、N和P相关水解酶活性,计算土壤酶化学计量比,结合土壤理化性质及微生物生物量,探讨土壤酶活性和酶化学计量比的差异及其与土壤理化性质、微生物生物量间的关系,揭示马尾松人工林异龄混交改造对土壤团聚体中的养分特征和微生物对养分资源的利用机制,为马尾松人工林的可持续经营管理提供理论支持。
1 材料与方法 1.1 研究地概况研究地位于广西壮族自治区凭祥市中国林业科学研究院热带林业实验中心伏波试验场内(106°39′-106°59′E,21°57′-22°19′N),地处亚热带季风气候区,降雨量充足,年降水量1 400 mm,年平均气温21 ℃,年平均无霜期340 d。地貌类型为典型的红壤丘陵地貌,土壤类型主要为由花岗岩在高温、干湿交替条件下风化形成的酸性红壤,人工林类型丰富,以纯林、针阔混交林两种经营模式为主。典型的针叶树种有马尾松和杉木(Cunninghamia lanceolata),阔叶树种有红锥(Castanopsis hystrix)、香子含笑(Michelia hedyosperma)、格木(Erythrophleum fordii)、大叶栎(Quercus griffithii)、火力楠(Michelia macclurei)等。
1.2 样地设置和调查本试验选取马尾松纯林(1993年种植)经3次(2000、2004和2007年)间伐后,于2008年春季引入一种阔叶树(红锥,1年生实生苗)改造后形成的混交林(Mixed Plantation, MP),以及引入多种阔叶树(包括红锥、香子含笑、格木和大叶栎,均为1年生实生苗)改造后形成的复合混交林(Multiple species Mixed Plantation, MMP)为研究对象,以邻近具有相似立地条件的未改造马尾松纯林(Pure Plantation, PP)为对照。在人工林经营期间,3种林分都采用相似的林分管理制度进行经营管理。每种林分类型分别布置5个30 m×30 m的独立样方,共设置15个样方。
2022年8月,对林分中的每个样方采用传统样方调查法进行调查,将每个样方分成4个小样方(15 m×15 m),采用每木检尺的方法调查乔木层树木的树高(Tree Hight,TH)和胸径(Diameter at Breats Height,DBH),并记录林分的郁闭度(Canopy Density,CD)和林分密度(Stand Density,SD)。每个样方随机布置9个凋落物收集框(1 m×1 m),用于收集凋落物并统计其年产量; 同时在每个样方随机布设9个取样点并采用根钻法获取细根(直径≤2 mm),根钻内径5 cm,取样深度为0-10 cm。样地基本信息见表 1。
| 林分类型 Plantation types |
树种 Tree species |
郁闭度 CD |
胸径/cm DBH/cm |
树高/m TH/m |
林分密度/ (株/hm2) SD/(tree/hm2) |
凋落物量/(kg·ha-1·年-1) Litter amount/(kg·ha-1·yr-1) |
细根生物量/(g·m-2) Fine root biomass/(g·m-2) |
| PP | Pinus massoniana | 0.74±0.03b | 25.87±0.65 | 22.64±0.85 | 848±159 | 7 682.10±290.21b | 149.43±1.72c |
| MP | 0.87±0.02a | 10 064.12±497.26a | 178.56±5.14a | ||||
| P.massoniana | 33.34±0.63 | 20.17±0.38 | 236±11 | ||||
| Castanopsis hystrix | 13.28±0.75 | 12.13±0.59 | 342±20 | ||||
| MMP | 0.83±0.01a | 9 125.01±201.00a | 161.75±1.38b | ||||
| P.massoniana | 36.69±0.96 | 21.74±0.10 | 276±19 | ||||
| Various broadleaved trees | 13.46±0.42 | 11.48±0.26 | 611±49 | ||||
| Note:data are means±SE, n=5;Different lowercase letters in the same column indicated significant difference between different plantation types (P < 0.05). | |||||||
1.3 样品采集处理
于2022年8月在每个30 m×30 m的样方内采集土壤样品,每个样方分成16个7.5 m×7.5 m的正方形,网格交点设置为采样点。按照系统采样法,每个样方设置9个采样点。清理采样点土壤表面杂质后采集0-10 cm土层的原状土,为避免土壤团聚体的结构被破坏,样品采集后保存在无菌的方形塑料盒,放置于低温保温箱中运往实验室进行处理。土壤样品按照自然纹理轻轻破碎并剔除石头、植物根系等杂质,并将每个样方内9个采样点的土壤样品混合为1个复合土壤样品。将复合土壤样品分为两部分,一部分过2 mm孔径的土壤筛,得到原土土壤样品; 另一部分分别过孔径为2、1和0.25 mm的土壤套筛,得到4种不同粒径的土壤团聚体(>2 mm、1-2 mm、0.25-1 mm、<0.25 mm),分别测定原土和各粒径土壤团聚体的土壤理化性质、微生物生物量和酶活性等指标。
1.4 样品测定方法土壤基本理化性质指标参照《土壤农化分析》[16]测定,土壤pH值使用pH计直接测定; 土壤有机碳(SOC)采用重铬酸钾氧化法测定; 土壤全氮(TN)采用凯氏定氮法测定; 硝态氮(
土壤微生物生物量碳(MBC)、微生物生物量氮(MBN)、微生物生物量磷(MBP)采用氯仿熏蒸浸提法测定。参照吴金水等[17]的步骤,MBC和MBN用K2SO4溶液作为提取液,提取液中的C、N含量采用总有机碳分析仪(MULTIN/C 3100,德国耶拿公司)测定; MBP用NaHCO3溶液作为提取液,采用钼蓝比色法测定。土壤MBC、MBN、MBP的计算如下:MBC=EC/KEC,MBN=EN/KEN,MBP=EP/(KEP×RPi),其中EC、EN、EP分别为熏蒸与未熏蒸土壤浸提液中SOC、有机氮和TP的差值,KEC、KEN、KEP表示转换系数,分别为0.45、0.45、0.40,RPi为加入无机磷的回收率。
酶活性测定均采用96微孔酶标板荧光法[18], 包括与C循环相关酶(CB+BG)[半纤维素酶(CB)和β-1, 4-葡萄糖苷酶(BG)]、N循环相关酶(NAG+LAP)[β-1, 4-N-乙酰葡糖氨糖苷酶(NAG)和亮氨酸氨基肽酶(LAP)]以及与P循环相关的酸性磷酸酶(ACP)[19]。往新鲜土壤(1.25 g)中加入125 mL乙酸钠缓冲液(pH值为4.0)制备土壤悬浊液,分别吸取200 μL的土壤悬浮液和50 μL的底物溶液混合到每个96微孔板中,25 ℃黑暗中培养4 h,用10 μL氢氧化钠溶液(1 mol·L-1)终止反应,使用多功能酶标仪(INFINITE M200 PRO,瑞士帝肯有限公司)测定其荧光值。酶活性以nmol·g-1·h-1表示。
土壤C∶N、C∶P、N∶P的酶化学计量比的表达方式[20, 21]如下:
| $ {\rm{酶C}}:{\rm{N = ln}}\left( {{\rm{CB + BG}}} \right):{\rm{ln}}\left( {{\rm{LAP + NAG}}} \right), $ | (1) |
| $ {\rm{酶C}}:{\rm{P = ln}}\left( {{\rm{CB + BG}}} \right){\rm{:ln}}\left( {{\rm{ACP}}} \right), $ | (2) |
| $ {\rm{酶N:P = ln}}\left( {{\rm{LAP + NAG}}} \right){\rm{:ln}}\left( {{\rm{ACP}}} \right), $ | (3) |
式中,(CB+BG)表示与C循环相关酶的活性,(LAP+NAG)表示与N循环相关酶的活性,ACP表示与P循环相关酶的活性。土壤C∶N、C∶P、N∶P的养分化学计量比可分别表示为Soil C∶N、Soil C∶P、Soil N∶P,计算公式如下:
| $ {\rm{SoilC:N = SOC:TN,}} $ | (4) |
| $ {\rm{SoilC:P = SOC:TP}}, $ | (5) |
| $ {\rm{SoilN:P = TN:TP。}} $ | (6) |
微生物生物量化学计量比的表达方式分别为MBC∶MBN、MBC∶MBP、MBN∶MBP。
1.5 数据分析向量长度(Vector Length,VL)和向量角度[Vector Angle (°),VA]的计算公式[20, 22]如下:
| $ \begin{aligned} & \mathrm{VL}=\mathrm{SQRT} \cdot \\ & {\left[\left(\frac{\ln (\mathrm{CB}+\mathrm{BG})}{\ln (\mathrm{LAP}+\mathrm{NAG})}\right)^2+\left(\frac{\ln (\mathrm{CB}+\mathrm{BG})}{\ln (\mathrm{ACP})}\right)^2\right],} \\ & \mathrm{VA}=\text { degrees ·} \end{aligned} $ | (7) |
| $ \left\{\operatorname{ATAN} 2\left[\left(\frac{\ln (\mathrm{CB}+\mathrm{BG})}{\ln (\mathrm{ACP})}\right), \left(\frac{\ln (\mathrm{CB}+\mathrm{BG})}{\ln (\mathrm{LAP}+\mathrm{NAG})}\right)\right]\right\}, $ | (8) |
式中, VL值越大表示微生物受到C限制越强; VA与微生物受到N或P限制有关,VA>45°和VA < 45°分别表示微生物受到P限制和N限制,VA偏离45°的程度越大表示限制性越强。
利用SPSS 27.0和Origin 2023b软件对数据进行统计。采用单因素方差分析(One-way ANOVA)检验PP、MP和MMP之间土壤理化性质、微生物生物量、酶活性和酶化学计量比之间的差异(P < 0.05表示存在显著差异),Pearson相关性分析探讨土壤理化性质、微生物生物量、酶活性和酶化学计量比之间的相关性; 通过方差分解分析(Variance Partition Analysis, VPA)探究凋落物量(LF)、细根生物量(FR)、土壤理化性质、微生物生物量、酶活性和酶化学计量比的单独效应及综合效应,并将结果以Venn图的形式表示; 采用冗余分析(Redundancy Analysis,RDA)来筛选和排序影响酶活性及酶化学计量比的因子,以确定最关键的影响因子(P<0.05表示存在显著差异)。所有的作图均在Origin 2023b和Canoco 5软件中完成。
2 结果与分析 2.1 异龄混交改造对土壤理化性质及微生物生物量影响如表 2所示,两种不同模式的阔叶树种异龄混交改造对土壤理化性质和微生物生物量均有显著影响。MP的SOC、TN、
| 林分类型 Plantation types |
有机碳/(g·kg-1) SOC/(g·kg-1) |
全氮/(g·kg-1) TN/(g·kg-1) |
硝态氮/(mg·kg-1) NO3--N/(mg·kg-1) |
铵态氮/(mg·kg-1) NH4+-N/(mg·kg-1) |
全磷/(g·kg-1) TP/(g·kg-1) |
速效磷/(mg·kg-1) AP/(mg·kg-1) |
土壤碳氮比 Soil C∶N |
土壤碳磷比 Soil C∶P |
| PP | 20.71±0.57b | 1.48±0.06b | 13.82±1.08a | 6.32±0.54c | 0.30±0.02b | 2.77±0.31c | 14.03±0.5b | 70.26±4.4ab |
| MP | 30.87±1.92a | 2.01±0.07a | 14.12±2.32a | 9.18±0.89b | 0.49±0.03a | 7.87±0.37a | 15.34±0.77b | 63.08±4.76b |
| MMP | 28.02±1.01a | 1.53±0.07b | 12.42±1.79a | 12.79±0.63a | 0.35±0.01b | 3.93±0.29b | 18.51±1.19a | 81.07±1.63a |
| 林分类型 Plantation types |
土壤氮磷比 Soil N∶P |
pH值 pH value |
微生物生物量碳/(mg·kg-1) MBC/(mg·kg-1) |
微生物生物量氮/(mg·kg-1) MBN/(mg·kg-1) |
微生物生物量磷/(mg·kg-1) MBP/(mg·kg-1) |
微生物生物量碳氮比 MBC∶MBN |
微生物生物量碳磷比 MBC∶MBP |
微生物生物量氮磷比 MBN∶MBP |
| PP | 5.02±0.29a | 4.14±0.06a | 206.29±7.15b | 20.38±0.73b | 11.43±0.42c | 10.18±0.57c | 18.16±1.02b | 1.79±0.08b |
| MP | 4.13±0.31a | 4.02±0.01b | 435.72±10.87a | 32.19±1.15a | 25.44±0.81a | 13.56±0.29a | 17.20±0.73b | 1.26±0.04c |
| MMP | 4.45±0.29a | 4.13±0.03ab | 406.33±14.78a | 33.86±1.71a | 15.26±1.80b | 12.05±0.34b | 28.07±3.36a | 2.31±0.24a |
| Note: different lowercase letters in the same column indicated significant difference between different plantation types (P<0.05). | ||||||||
2.2 异龄混交改造对酶活性和酶化学计量比的影响
在马尾松纯林中引入一种阔叶树种或多种阔叶树种异龄混交种植,均显著影响了土壤C、N、P循环相关的酶活性。MP、MMP的CB+BG、LAP+NAG、ACP活性在原土和各粒径土壤团聚体中(>2 mm、1-2 mm、0.25-1 mm、<0.25 mm)均显著高于PP,但MMP和MP之间的酶活性基本上没有显著差异(图 1)。MP的与C循环相关酶的活性(CB+BG)在原土和各粒径土壤团聚体中比PP分别显著增加41.70%、36.09%、25.60%、24.78%、25.23%(P<0.05),MMP相比PP分别显著增加29.95%、39.24%、35.82%、33.40%、28.24%[P<0.05,图 1(a)]。MP的与N循环相关酶的活性(LAP+NAG)在原土和各粒径土壤团聚体中比PP分别显著增加79.79%、86.81%、43.82%、114.91%、59.10%(P<0.05),MMP相比PP分别显著增加44.47%、77.27%、66.46%、82.19%、41.00%[P<0.05,图 1(b)]。MP的与P循环相关酶的活性(ACP)在原土和各粒径土壤团聚体中比PP分别显著增加53.36%、38.81%、47.18%、37.03%、35.51%(P<0.05),MMP相比PP分别显著增加47.20%、33.91%、87.30%、47.82%、37.56%[P<0.05, 图 1(c)]。
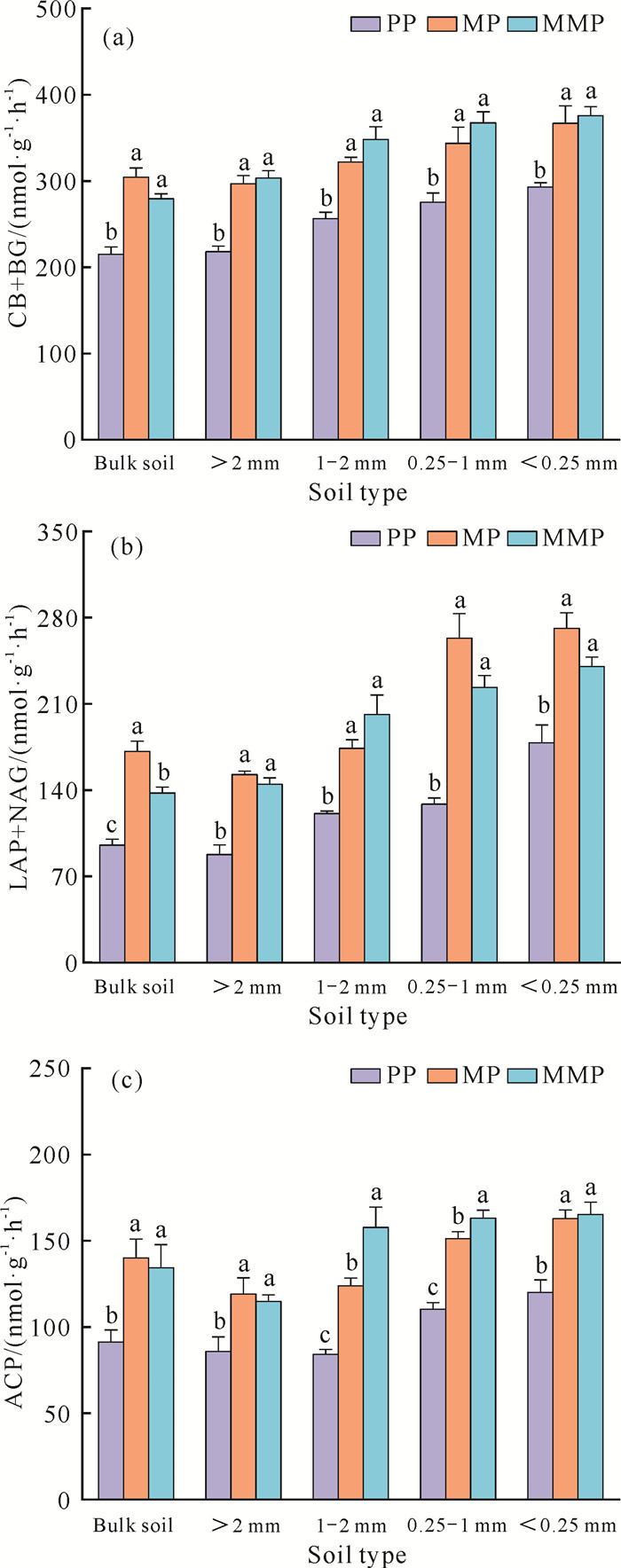
|
| Different lowercase letters indicated significant difference between different plantation types (P < 0.05). 图 1 土壤C、N、P循环相关酶活性的变化 Fig. 1 Changes in soil C, N, P cycling-related enzyme activities |
MP和MMP的土壤酶C∶N在原土和大多数粒径土壤团聚体中(<0.25 mm除外)均显著低于PP(P<0.05),在<0.25 mm粒径土壤团聚体中,MP显著低于PP,但MMP和PP没有显著差异[图 2(a)]。MP和MMP的土壤酶C∶P仅在1-2 mm粒径土壤团聚体中显著低于PP(P<0.05),在原土和其他粒径土壤团聚体(>2 mm、0.25-1 mm、<0.25 mm)中有降低的趋势但未达到显著性[图 2(b)]。相比于PP,MMP的土壤酶N∶P仅在1-2 mm粒径土壤团聚体中显著低于PP(P<0.05);在0.25-1 mm粒径土壤团聚体中MP和MMP的土壤N∶P酶化学计量比显著增加(P<0.05),在原土和<0.25 mm粒径土壤团聚体中没有显著差异[图 2(c)]。

|
| 图 2 土壤酶化学计量比的变化 Fig. 2 Changes in soil enzyme stoichiometric ratios |
根据向量分析,原土和各粒径土壤团聚体中的VL值为1.57-1.72(VL>1.00)。其中,MP的VL值在原土和所有粒径土壤团聚体中均显著低于PP(P<0.05),分别显著下降4.20%、3.97%、3.71%、6.26%、3.62%[图 3(a)]; MMP的VL值仅在>2 mm、1-2 mm、0.25-1 mm 3个粒径土壤团聚体中显著低于PP(P<0.05),分别显著下降2.83%、5.95%、4.67%,在原土和<0.25 mm粒径土壤团聚体中虽然低于PP但是未达到显著水平[图 3(a)]。原土和不同粒径土壤团聚体中的VA值为42.06-44.69°,均小于45°[图 3(b)]。
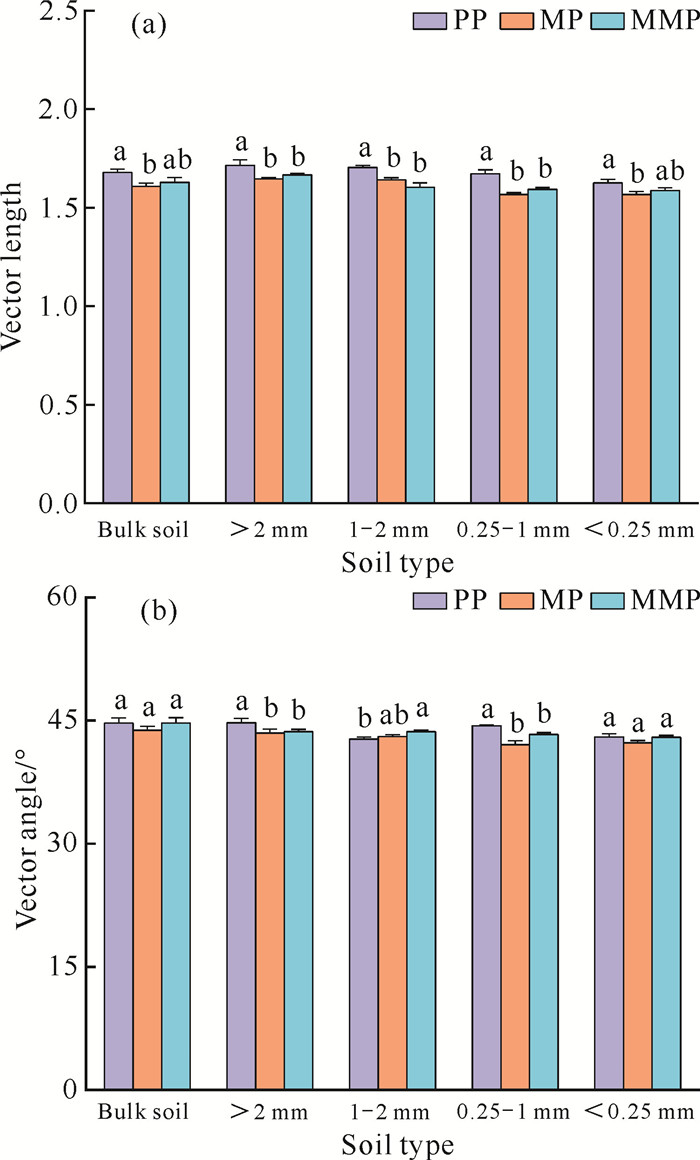
|
| 图 3 向量长度(VL)和向量角度(VA)的变化 Fig. 3 Changes in Vector Length (VL) and Vector Angle (VA) |
2.3 酶活性及酶化学计量比变化的主要影响因素
Pearson相关性分析表明(表 3),凋落物量(LF)、细根生物量(FR)、土壤理化性质(SOC、TN、
| 因子 Factors |
ln(BG+ CB) | ln(LAP+ NAG) | ln(ACP) | 酶C∶N Enzyme C∶N |
酶C∶P Enzyme C∶P |
酶N∶P Enzyme N∶P |
VL | VA |
| Litterfall mass | 0.520** | 0.532** | 0.453** | -0.478** | -0.231* | 0.316** | -0.419** | -0.318** |
| Fine root biomass | 0.404** | 0.462** | 0.370** | -0.452** | -0.233* | 0.307** | -0.375** | -0.283* |
| SOC | 0.344** | 0.454** | 0.352** | -0.469** | -0.254* | 0.309** | -0.403** | -0.289* |
| TN | 0.452** | 0.604** | 0.410** | -0.606** | -0.249* | 0.476** | -0.481** | -0.456** |
| 0.336** | 0.450** | 0.318** | -0.454** | -0.199 | 0.339** | -0.376** | -0.329** | |
| 0.381** | 0.389** | 0.300** | -0.320** | -0.138 | 0.253** | -0.252* | -0.236* | |
| TP | 0.514** | 0.527** | 0.640** | -0.469** | -0.515** | 0.066 | -0.552** | -0.037 |
| AP | 0.461** | 0.566** | 0.436** | -0.566** | -0.277* | 0.392** | -0.472** | -0.372** |
| Soil C∶N | -0.073 | -0.125 | -0.038 | 0.121 | -0.005 | -0.149 | 0.067 | 0.149 |
| Soil C∶P | -0.003 | -0.011 | 0.016 | -0.001 | -0.047 | -0.032 | -0.006 | 0.050 |
| Soil N∶P | 0.082 | 0.115 | 0.039 | -0.116 | -0.014 | 0.137 | -0.050 | -0.117 |
| pH value | -0.227 | -0.283* | -0.161 | 0.271* | 0.043 | -0.263* | 0.196 | 0.272* |
| MBC | 0.695** | 0.706** | 0.661** | -0.620** | -0.398** | 0.337** | -0.581** | -0.320** |
| MBN | 0.596** | 0.642** | 0.619** | -0.590** | -0.428** | 0.283* | -0.569** | -0.254* |
| MBP | 0.576** | 0.616** | 0.551** | -0.568** | -0.343** | 0.327** | -0.518** | -0.312** |
| MBC∶MBN | 0.504** | 0.399** | 0.359** | -0.271* | -0.083 | 0.206 | -0.237* | -0.235* |
| MBC∶MBP | 0.324** | 0.293* | 0.298** | -0.234* | -0.169 | 0.110 | -0.228* | -0.101 |
| MBN∶MBP | 0.090 | 0.105 | 0.137 | -0.103 | -0.140 | 0.001 | -0.121 | 0.022 |
| Note: * indicates significant correlations (P<0.05),** indicates extremely significant correlations (P<0.01). | ||||||||
由酶活性的VPA可知,凋落物量、细根生物量、土壤理化性质和微生物生物量对酶活性变异的单独解释量分别为2.0%、6.8%、10.3%,土壤理化性质和微生物生物量两者的交互作用对酶活性变异的解释能力最大,解释量为23.1%;其次是凋落物量和细根生物量、土壤理化性质和微生物生物量的综合作用对酶活性变异的解释量,为16.9%[图 4(a)]。此外,以土壤酶活性为响应变量,凋落物量和细根生物量、土壤理化性质、养分化学计量比、微生物生物量及其化学计量比等因子为解释变量进行RDA,所有的影响因子共同解释了土壤酶活性变异的73.29%,其中第一主轴和第二主轴的解释率分别为71.58%和1.71% [图 4(b)]。对所有的影响因子进行先后排序后发现MBC(F=66.5,P=0.002)、TN(F=16.5,P=0.002)、TP(F=5.9,P=0.010)、MBP(F=5.1,P=0.018)、MBC∶MBP(F=5.2,P=0.022)是影响土壤酶活性的主要驱动因子[图 4(b)]。此外,第一主轴将MP和MMP与PP明显分开[图 4(b)]。
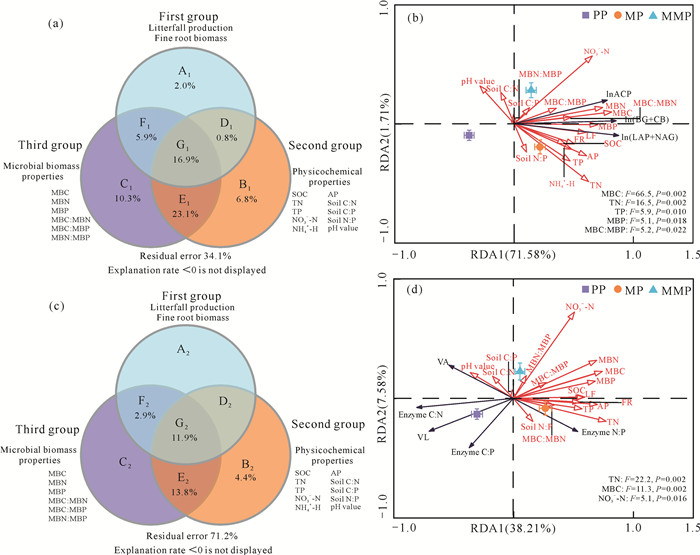
|
| A, B, C in (a)(c) represent individual variations explainable; D, E, F, G represent combined variations explainable. 图 4 方差分解分析(a, c)和冗余分析(b, d) Fig. 4 Variance partitioning analysis (a, c) and redundancy analysis(b, d) |
酶化学计量比的VPA表明,土壤理化性质和微生物生物量两者的交互作用对酶化学计量比变异的解释能力最大,为13.8%;其次是凋落物量和细根生物量、土壤理化性质和微生物生物量的综合作用,对化学计量比变异的解释量为11.9%[图 4(c)]。酶化学计量比与各个因子的RDA结果显示,第一主轴和第二主轴分别解释酶化学计量比变量的38.21%和7.58%,TN(F=22.2,P=0.002)、MBC(F=11.3,P=0.002)和NO3--N(F=5.1,P=0.016)是影响酶化学计量比的主要影响因子[图 4(d)]。
3 讨论 3.1 异龄混交改造对土壤酶活性的影响马尾松人工纯林引入一种或多种阔叶树种异龄混交改造后,林分类型和林分结构的变化直接导致养分需求和养分利用率的差异。研究表明,由于不同林分类型凋落物和根系存在差异,导致凋落物分解速率、养分含量和归还量的不同,并对土壤的理化性质和微生物活性等产生影响,酶活性也会随之改变[11, 23]。本研究中,引入阔叶树种后显著增加了马尾松人工林的有机碳、养分有效性和微生物生物量(表 2)。与明安刚等[24]的研究结果一致,马尾松人工纯林引入阔叶树种后,土壤中的根系网络更为复杂,根系释放的分泌物、凋落物输入量的增加都对森林土壤有机养分的供应和归还起到重要作用。此外,输入的C源和N源增加也为微生物提供大量的养分和能量,促进其繁殖和生长。
土壤酶作为评价土壤微生物活动及养分需求的重要指标之一,其活性与土壤养分有效利用密切相关,微生物根据其生长时对C、N、P等养分的需求来分配酶资源,因此通过观察酶的表达程度可以了解微生物生理调节过程[25]。本研究结果表明,引入阔叶树种混交种植显著提高了原土和各粒径团聚体中与C循环相关的酶(CB+BG)活性,CB和BG是两种主要的纤维素水解酶,其活性的增加表明微生物加速了有机质的分解。微生物在获取更多C的同时,也需要分解相应的N、P来满足自身的生长发育需求。本研究中,引入阔叶树种后土壤原土和各粒径土壤团聚体中的(LAP+NAG)酶活性显著增加,表明引入阔叶树种后土壤微生物对N的需求增加。土壤ACP主要由微生物分泌,可将P从不可用的有机结合形式转化为可被微生物和植物直接吸收利用的有效磷[26, 27]。谢欢等[28]研究发现,在马尾松纯林中引入阔叶树种能显著提高ACP的活性,其原因可能是土壤N的有效性增加后,微生物为了维持体内的养分平衡增加了对P的需求,刺激微生物分泌更多的ACP来获取土壤中的有效P。
土壤团聚体在调节物质能量转化和代谢过程起着重要作用。酶活性在不同粒径团聚体中的分布规律较为复杂,并受多种因素的影响,如土地利用方式、植被类型、生物群落结构组成等[10, 29]。马尾松人工林异龄混交改造后土壤碳氮磷循环相关酶活性在不同粒径土壤团聚体中的变化情况具有一致性,酶活性在小团聚体和微团聚体(0.25-1 mm和<0.25 mm)中表现最高,可见在微小粒径团聚体中的微生物活动更能促进酶的合成。雷蕾等[30]对三峡库区两种马尾松混交林模式下土壤酶活性在团聚体粒径中分布特征的研究中也发现,由于土壤团聚体物理结构的差异性,微团聚体中的酶活性比大团聚体的高。这可能是因为大团聚体的孔径大,酶活性更易受环境因素的影响; 小粒径团聚体中的有机和无机复合体可以吸附土壤酶从而起保护作用[31]。但王晟强等[32]研究认为,大团聚体的酶活性更高。因此,不同粒径团聚体中的酶活性由多种因素影响或者存在一些不确定的因素,仍需综合考虑多方面的因素并开展进一步研究。
3.2 异龄混交改造对土壤酶化学计量比的影响土壤酶化学计量比与养分获取情况密切相关,可作为反映土壤微生物受何种养分限制的重要指标。根据资源分配理论,微生物消耗大量的能源产生胞外酶以获得相对有限的养分。Sinsabaugh等[19]进行全球范围的荟萃分析结果表明,土壤C∶N∶P的酶化学计量比趋近于1∶1∶1,当偏离这个值时,微生物活性受到相对能量(C)或养分(N、P)的限制。本研究中,根据图 2的酶化学计量比可计算出PP、MP和MMP的酶活性C∶N∶P自然对数比分别为1.20∶1.03∶1、1.17∶1.07∶1、1.16∶1.04∶1,比值中C相对偏高,说明该区域土壤微生物对C源的需求最明显。酶化学计量比并不是动态平衡的,而是受土壤资源有效性的影响。研究区域土壤中的酶C∶N(1.12)低于全球水平(1.41),酶C∶P(1.18)高于全球水平(0.62),酶N∶P(1.05)高于全球水平(0.44)(图 2)。土壤酶C∶N和酶C∶P越高,反映微生物的生长发育更多是受C源限制,微生物对于C的投资高于N和P。
此外,3种林分类型的土壤酶化学计量比的向量角度稍小于45°,表明这3种林分土壤微生物总体上受N限制[21]。在N限制下,植物体需要更多的养分N,因此微生物会增加NAG和LAP酶活性来获取养分N以满足自身的养分需求,进而缓和N限制[33]。因此,研究区3种林分土壤主要受C和N的共同限制。通常认为,VL值越大,C限制作用越明显。本研究中,引入阔叶树种异龄混交改造,MP和MMP的VL值显著降低[图 3(a)],说明针阔树种异龄混交能削弱土壤微生物受到的C限制。马尾松人工林异龄混交改造在提高土壤养分有效性的同时,通过增加地上和地下C输入来提高土壤SOC浓度和储量[34]。土壤N的增加主要依赖于外源N的输入、大气氮沉降和微生物固氮作用等途径,比如固氮树种可以通过与固氮菌结合来增加土壤N[35],然而本研究中的红锥并非固氮树种,马尾松/红锥混交林土壤N的提高可能是其他机制的作用,比如深层土壤的N通过根系吸收并以凋落物归还的方式在表层土壤积累。因此,马尾松纯林引入阔叶树种可以有效改善人工林C、N和P的供给问题,同时有助于缓解马尾松人工林单一经营模式所导致的土壤养分退化和肥力下降等问题。
相关性检验结果表明,凋落物量和细根生物量、土壤养分含量(SOC、TN、TP等)与酶C∶N、酶C∶P间存在显著负相关性,与酶N∶P间呈显著正相关,这表明凋落物量和细根生物量、土壤养分的增加将加剧微生物N限制[33]。养分化学计量比只能反映养分现状,酶化学计量比可以揭示微生物对养分的利用情况。本研究中,酶化学计量比与养分及其有效性之间存在着相关关系,但与养分化学计量比之间没有显著的相关关系,说明土壤-酶化学计量比并未呈现良好的耦合性,酶化学计量比和养分计量比之间存在着一定的对立关系。莫雪青等[36]在对桉树人工纯林引入固氮树种的研究中也发现土壤酶化学计量比与养分计量比之间没有显著的相关关系,可能是酶化学计量比更易受其他因子(如土壤容重、温度、含水率等)的影响或者受多种因子的综合影响,导致养分化学计量比对酶化学计量比的影响减弱。RDA结果显示,TN、MBC、
在马尾松人工纯林中引入一种或多种阔叶树种异龄混交改造能有效提高土壤团聚体养分、微生物生物量和酶活性; 酶化学计量比结果表明PP、MP和MMP 3种林分的土壤团聚体微生物均对C源的需求较高,微生物生长代谢受C、N共同限制,而异龄混交改造能有效缓解马尾松人工林土壤的C限制; MBC、TN、TP、MBP、MBC∶MBP是驱动土壤酶活性变化的主要因子,而TN、MBC和
| [1] |
CUI Y X, BING H J, FANG L C, et al. Extracellular enzyme stoichiometry reveals the carbon and phosphorus limitations of microbial metabolisms in the rhizosphere and bulk soils in alpine ecosystems[J]. Plant and Soil, 2021, 458(1): 7-20. |
| [2] |
YANG Y, LIANG C, WANG Y Q, et al. Soil extracellular enzyme stoichiometry reflects the shift from P-to N-limitation of microorganisms with grassland restoration[J]. Soil Biology and Biochemistry, 2020, 149: 107928. DOI:10.1016/j.soilbio.2020.107928 |
| [3] |
刘仁, 陈伏生, 方向民, 等. 凋落物添加和移除对杉木人工林土壤水解酶活性及其化学计量比的影响[J]. 生态学报, 2020, 40(16): 5739-5750. |
| [4] |
HUANG Y X, WU Z J, ZONG Y Y, et al. Mixing with coniferous tree species alleviates rhizosphere soil phosphorus limitation of broad-leaved trees in subtropical plantations[J]. Soil Biology and Biochemistry, 2022, 175: 108853. DOI:10.1016/j.soilbio.2022.108853 |
| [5] |
袁萍, 周嘉聪, 张秋芳, 等. 中亚热带不同森林更新方式生态酶化学计量特征[J]. 生态学报, 2018, 38(18): 6741-6748. |
| [6] |
史丽娟, 王辉民, 付晓莉, 等. 中亚热带典型人工林土壤酶活性及其化学计量特征[J]. 应用生态学报, 2020, 31(6): 1980-1988. |
| [7] |
焦鹏宇, 郭文, 陈泽龙, 等. 中亚热带不同林龄马尾松林土壤酶学计量特征[J]. 环境科学, 2022, 43(2): 1059-1068. |
| [8] |
LIU H F, WANG X K, LIANG C T, et al. Glomalin-related soil protein affects soil aggregation and recovery of soil nutrient following natural revegetation on the Loess Plateau[J]. Geoderma, 2020, 357: 113921. DOI:10.1016/j.geoderma.2019.113921 |
| [9] |
陈天, 程瑞梅, 沈雅飞, 等. 氮添加对三峡库区马尾松人工林土壤团聚体有机氮组分和氮矿化的影响[J]. 应用生态学报, 2023, 34(10): 2601-2609. |
| [10] |
FANG X, ZHOU G Y, LI Y L, et al. Warming effects on biomass and composition of microbial communities and enzyme activities within soil aggregates in subtropical forest[J]. Biology and Fertility of Soils, 2016, 52(3): 353-365. |
| [11] |
WANG H, LIU S R, WANG J X, et al. Mixed-species plantation with Pinus massoniana and Castanopsis hystrix accelerates C loss in recalcitrant coniferous litter but slows C loss in labile broadleaf litter in Southern China[J]. Forest Ecology and Management, 2018, 422: 207-213. |
| [12] |
NIE M, PENDALL E, BELL C, et al. Soil aggregate size distribution mediates microbial climate change feedbacks[J]. Soil Biology and Biochemistry, 2014, 68: 357-365. |
| [13] |
LI Z J, REICHEL R, LI Z M, et al. Effects of snow absence on available N pools and enzyme activities within soil aggregates in a spruce forest on the eastern Tibetan Plateau[J]. Soil Ecology Letters, 2022, 4(4): 376-382. |
| [14] |
ALI A, DAI D, AKHTAR K, et al. Response of understory vegetation, tree regeneration, and soil quality to manipulated stand density in a Pinus massoniana plantation[J]. Global Ecology and Conservation, 2019, 20: e00775. |
| [15] |
MARRON N, EPRON D. Are mixed-tree plantations including a nitrogen-fixing species more productive than monocultures?[J]. Forest Ecology and Management, 2019, 441: 242-252. |
| [16] |
鲍士旦. 土壤农化分析[M]. 3版. 北京: 中国农业出版社, 2000.
|
| [17] |
吴金水, 林启美, 黄巧云, 等. 土壤微生物生物量测定方法及其应用[M]. 北京: 气象出版社, 2006.
|
| [18] |
SAIYA-CORK K R, SINSABAUGH R L, ZAK D R. The effects of long term nitrogen deposition on extracellular enzyme activity in an Acer saccharum forest soil[J]. Soil Biology and Biochemistry, 2002, 34(9): 1309-1315. |
| [19] |
SINSABAUGH R L, LAUBER C L, WEINTRAUB M N, et al. Stoichiometry of soil enzyme activity at global scale[J]. Ecology Letters, 2008, 11(11): 1252-1264. |
| [20] |
YAN J L, HUANG X M, SU X Y, et al. Introducing N2-fixing tree species into eucalyptus plantation in subtropical China alleviated carbon and nitrogen constraints within soil aggregates[J]. Forests, 2022, 13(12): 2102. |
| [21] |
GUAN H L, FAN J W, LU X. Soil specific enzyme stoichiometry reflects nitrogen limitation of microorganisms under different types of vegetation restoration in the karst areas[J]. Applied Soil Ecology, 2022, 169: 104253. |
| [22] |
MOORHEAD D L, RINKES Z L, SINSABAUGH R L, et al. Dynamic relationships between microbial biomass, respiration, inorganic nutrients and enzyme activities: informing enzyme-based decomposition models[J]. Frontiers in Microbiology, 2013, 4: 223. |
| [23] |
王晶晶, 黄刚, 吕坤, 等. 热带-亚热带森林不同植被类型的土壤酶活性及化学计量特征[J]. 应用与环境生物学报, 2023, 29(2): 423-431. |
| [24] |
明安刚, 刘世荣, 李华, 等. 近自然化改造对马尾松和杉木人工林生物量及其分配的影响[J]. 生态学报, 2017, 37(23): 7833-7842. |
| [25] |
CHEN H, LI D J, MAO Q G, et al. Resource limitation of soil microbes in karst ecosystems[J]. The Science of the Total Environment, 2019, 650(Pt 1): 241-248. |
| [26] |
杨海滨, 李中林, 邓敏, 等. 不同施肥措施对重庆茶园土壤氮转化酶活性的影响[J]. 应用与环境生物学报, 2020, 26(5): 1107-1114. |
| [27] |
林惠瑛, 元晓春, 周嘉聪, 等. 海拔梯度变化对武夷山黄山松林土壤磷组分和有效性的影响[J]. 生态学报, 2021, 41(14): 5611-5621. |
| [28] |
谢欢, 张秋芳, 曾泉鑫, 等. 施氮通过改变微生物生物量磷驱动杉木人工林土壤磷组分转化[J]. 生态学杂志, 2020, 39(12): 3934-3942. |
| [29] |
LAGOMARSINO A, GREGO S, KANDELER E. Soil organic carbon distribution drives microbial activity and functional diversity in particle and aggregate-size fractions[J]. Pedobiologia, 2012, 55(2): 101-110. |
| [30] |
雷蕾, 肖文发, 曾立雄, 等. 三峡库区2种马尾松混交林土壤团聚体酶活性分布特征[J]. 生态学报, 2020, 40(17): 6179-6188. |
| [31] |
钟晓兰, 李江涛, 李小嘉, 等. 模拟氮沉降增加条件下土壤团聚体对酶活性的影响[J]. 生态学报, 2015, 35(5): 1422-1433. |
| [32] |
王晟强, 张喆, 叶绍明. 桂南茶园土壤团聚体酶活性对植茶年限的响应[J]. 生态学报, 2020, 40(18): 6532-6541. |
| [33] |
WARING B G. Exploring relationships between enzyme activities and leaf litter decomposition in a wet tropical forest[J]. Soil Biology and Biochemistry, 2013, 64: 89-95. |
| [34] |
YOU Y M, HUANG X M, ZHU H G, et al. Positive interactions between Pinus massoniana and Castanopsis hystrix species in the uneven-aged mixed plantations can produce more ecosystem carbon in subtropical China[J]. Forest Ecology and Management, 2018, 410: 193-200. |
| [35] |
HUANG X M, LIU S R, YOU Y M, et al. Microbial community and associated enzymes activity influence soil carbon chemical composition in Eucalyptus urophylla plantation with mixing N2-fixing species in subtropical China[J]. Plant and Soil, 2017, 414(1): 199-212. |
| [36] |
莫雪青, 肖纳, 谭许脉, 等. 固氮树种对桉树人工林土壤团聚体酶活性及其化学计量比的影响[J]. 广西植物, 2022, 42(4): 569-579. |
| [37] |
LUO X Z, HOU E Q, CHEN J Q, et al. Dynamics of carbon, nitrogen, and phosphorus stocks and stoichiometry resulting from conversion of primary broadleaf forest to plantation and secondary forest in subtropical China[J]. Catena, 2020, 193: 104606. |



