2. 中国林业科学研究院森林生态环境与自然保护研究所,国家林业和草原局森林生态环境重点实验室,北京 100091;
3. 广西友谊关森林生态系统国家定位观测研究站,崇左凭祥友谊关森林生态系统广西野外科学研究观测站,广西凭祥 532600;
4. 中国林业科学研究院热带林业实验中心,广西凭祥 532600
2. Key Laboratory of Forest Ecology and Environment of National Forestry and Grassland Administration, Ecology and Nature Conservation Institute, Chinese Academy of Forestry, Beijing, 100091, China;
3. Guangxi Youyiguan Forest Ecosystem National Research Station, Youyiguan Forest Ecosystem Observation and Research Station of Guangxi, Pingxiang, Guangxi, 532600, China;
4. Experimental Center of Tropical Forestry, Chinese Academy of Forestry, Pingxiang, Guangxi, 532600, China
在森林生态系统中,土壤微生物积极参与有机物的降解、腐殖质的合成与养分转化等过程,对维持森林植物生长、生态系统稳定和功能发挥至关重要[1-5]。森林土壤中微生物群落组成及其多样性,取决于林下凋落物性质、根系和根系分泌物等生物因素,以及土壤理化性质等非生物因素的协同作用。另外,土壤微生物通过影响土壤养分及其理化性质,间接影响地上植被的生物量和生产力[6]。Chen等[7]通过不同树种混交试验,揭示树种混交主要影响林分的凋落物、根系分泌物和小气候等因素从而对土壤微生物群落产生影响。
马尾松(Pinus massoniana)具有适应能力强、生长速度快、产量高和水土保持功能良好等特点,在我国南方地区被广泛种植[8]。但是,长期的马尾松纯林种植模式极易产生诸如生物多样性降低、病虫害频发、土壤养分循环变慢和肥力下降等问题,导致其生态系统结构和功能退化[9]。阔叶树种不仅能够提供高价值木材以满足现代社会的需求,而且比针叶树种具有更复杂的根系、更多的高质量凋落物和更快的养分归还速率,能够有效改善土壤质量,发挥更强的生态功能。因此,引入阔叶树种与马尾松混交种植已成为目前我国亚热带地区调整林分结构,建立生产力更高、服务功能更强的森林生态系统的常用营林模式之一,极具应用前景[10, 11]。有研究表明,在人工纯林中引入阔叶树种混交种植可以增加土壤微生物群落的物种多样性,促进土壤微生物与根系的相互作用,从而增加土壤养分的有效性[12, 13]。
然而,如何通过调控树种丰富度和优化树种组合来提升人工林的生产力和生态系统服务功能,仍是目前林学和生态学领域亟需深入研究和解决的热点问题。本研究以南亚热带马尾松与非固氮树种[红锥(Castanopsis hystrix)]、固氮树种[格木(Erythrophleum fordii)]、非固氮和固氮兼具的多树种[红锥、格木、火力楠(Michelia macclurei)、灰木莲(Manglietia glauca)、米老排(Mytilaria laosensis)]混交种植形成的混交林为研究对象,并以马尾松纯林作为对照,重点探究不同混交模式对土壤细菌、真菌群落组成和多样性特征产生的影响,并明确其主要生物和非生物影响因子,为定向提高我国南亚热带人工林土壤质量和微生物物种多样性的树种选择、优化配置以及种植模式等方面提供科学依据。
1 材料与方法 1.1 研究区概况研究区位于广西凭祥市中国林业科学研究院热带林业实验中心的伏波实验场(21°57′47″-22°19′27″N,106°39′50″-106°59′30″E)。该地区具有典型的南亚热带季风气候特征,属南亚热带季风气候类型。年均降水量为1 200-1 500 mm,年均气温为20.5-21.7 ℃,雨季主要集中在每年的4-9月。实验样地海拔约350 m,地形以低山丘陵为主,土壤类型主要为由花岗岩风化形成的酸性红壤[14]。
1.2 试验设计基于2015年建立的多样性梯度的树种配置实验平台,本研究采用随机区组设计原则,设置4个区组(代表 4个重复),每个区组包含1个马尾松纯林(PP)和3个混交林[马尾松/红锥混交林(MPC)、马尾松/格木混交林(MPE)、马尾松/(红锥+格木+火力楠+灰木莲+米老排)混交林(MPM)]。2020年,每个区组中每种林分均设置1个20 m×20 m的样方,共计16个样方。其中,实验设计和样地分布的具体描述详见文献[15]。样地的基本信息见表 1。
| 混交模式 Mixing type |
树龄/年 Tree age/years |
胸径/cm DBH/cm |
树高/m Tree height/m |
| PP | 5 | 8.93±0.58 | 5.80±0.22 |
| MPC | 5 | 7.73±0.14 | 5.50±0.07 |
| MPE | 5 | 7.35±0.22 | 4.70±0.11 |
| MPM | 5 | 6.91±0.30 | 5.13±0.12 |
1.3 样品采集与测定 1.3.1 土壤样品采集
于2020年8-9月,在20 m×20 m样地内,均匀划分16个5 m×5 m的小样方,每个小样方随机选1个点,去除凋落物及腐殖质层后,使用直径(内径)为3.8 cm的土钻采集土壤深度为0-10 cm的土壤样品;挑出植物根系和石砾等杂质后,将16个土样混合成1个样地土壤样品,过2 mm筛网后低温保存。
1.3.2 植物样品采集与分析在每个20 m×20 m样地内随机布设9个距离地面1 m的凋落物收集框(1 m×1 m),定期(每个月20日左右)收集凋落物并带回实验室,为期1年,共12次。采用根钻法获取0-10 cm土层的细根。收集的凋落物和细根经65 ℃烘箱烘干至恒重后用于计算每种林分类型的年凋落物量和细根生物量。
1.3.3 土壤理化性质测定采用重铬酸盐氧化法测定土壤的有机碳(SOC)含量,用凯氏定氮法测定土壤全氮(TN)含量[16]。采用碱熔钼锑比色法测定土壤的总磷(TP)含量;土壤的有效磷(AP)含量经盐酸和硫酸浸取后,使用分光光度法测定[17]。全钾(TK)采用NaOH烧融火焰光度法测定;土壤速效钾(AK)采用1 mol∙L-1乙酸铵(pH=7.0)浸提。使用靛酚蓝分光光度法和紫外分光光度法分别测定土壤中的铵态氮(
将储存在-80 ℃条件下的土壤样本转移至无菌离心管中,并送至微基生物科技(上海)有限公司分析土壤微生物。使用MIO-BIO PowerSoil DNA Isolation Kit提取样本基因组DNA。DNA样本经PCR扩增和AxyPrepDNA凝胶回收后,使用FTC-3000TM实时荧光PCR仪(加拿大Funglyn Biotech公司)进行定量。最后,进行Illumina高通量测序和生物信息学分析。在PCR扩增中,细菌使用16S rRNA基因的V4-V5区引物,真菌使用ITS1基因的引物,具体引物信息详见文献[1]。
1.5 数据分析利用线性判别分析(LDA)识别PP、MPC、MPE和MPM 4个林分中特定微生物的影响程度。通过单因素方差分析(One-way Analysis of Variance, One-way ANOVA)检验4种人工林的凋落物量、细根生物量、土壤理化性质、土壤微生物群落的相对丰度和α-多样性指数的差异,采用Mantel test检验土壤微生物群落α-多样性指数与植物性质、土壤理化性质的相关性,采用冗余分析(RDA)方法确定影响土壤微生物群落组成的主要因素。采用Origin 2024、R 4.3.2作图。文中图表数据均为平均值±标准误(n=4)。
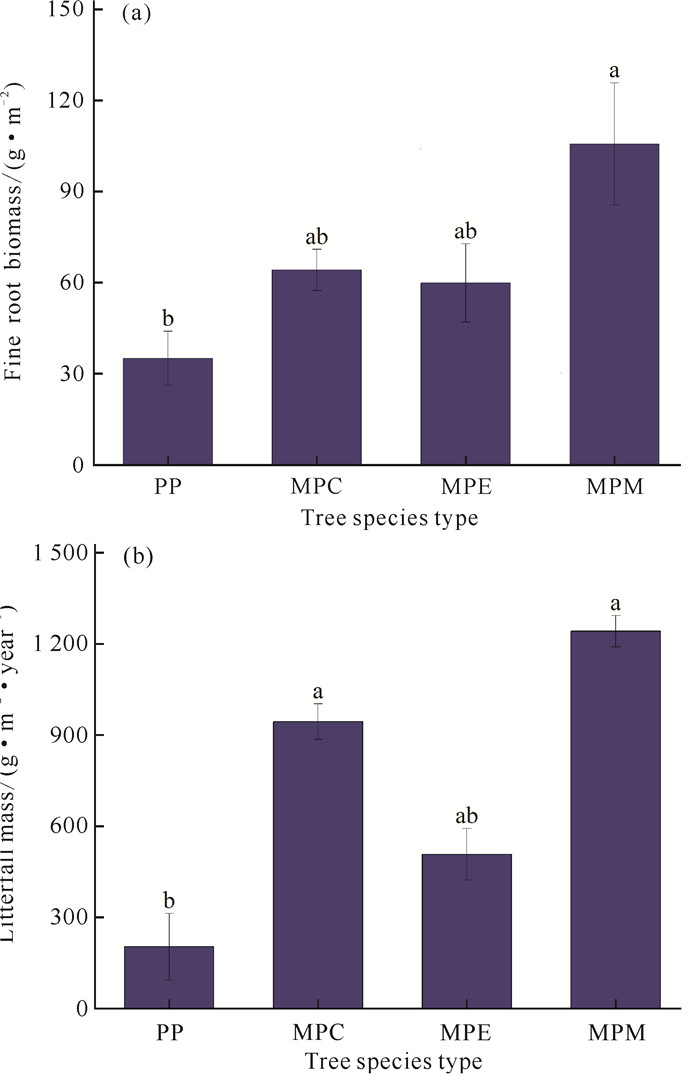
2 结果与分析 2.1 马尾松与不同阔叶树种混交种植对植物及土壤性质的影响与PP相比,3种混交林的细根生物量和凋落物量均有不同程度增加,其中MPM细根生物量和凋落物量显著提高,分别提高201.58%和511.29%;MPC凋落物量显著提高364.91%,细根生物量无显著变化;MPE细根生物量和凋落物量均无显著变化(图 1)。不同林分类型中,不同树种之间的凋落物占比具有一定差异性,其中,MPC中马尾松的凋落物占17.91%,红锥的凋落物占82.09%;MPE中马尾松和格木的凋落物占比分别为73.65%和26.35%;而在MPM中,凋落物占比从大到小依次为米老排(36.79%)、马尾松(24.22%)、格木(19.39%)、红椎(15.82%)、灰木莲(2.95%)、火力楠(0.83%)(表 2)。
|
| Different lowercase letters mean significant difference at 0.05 level. 图 1 不同林分类型细根生物量(a)和凋落物量(b)变化 Fig. 1 Changes in fine root biomass (a) and litterfall mass (b) in different plantation |
| Unit: % | |||||||||||||||||||||||||||||
| 林分类型 Plantation type |
马尾松 Pinus massoniana |
红锥 Castanopsis hystrix |
格木 Erythrophleum fordii |
火力楠 Michelia macclurei |
米老排 Mytilaria Laosensis |
灰木莲 Manglietia glauca |
|||||||||||||||||||||||
| PP | 100 | ||||||||||||||||||||||||||||
| MPC | 17.91 | 82.09 | |||||||||||||||||||||||||||
| MPE | 73.65 | 26.35 | |||||||||||||||||||||||||||
| MPM | 24.22 | 15.82 | 19.39 | 0.83 | 36.79 | 2.95 |
|||||||||||||||||||||||
此外,不同林分类型对土壤理化性质也产生不同程度影响。相较于PP,MPE的
| 林分类型 Plantation type |
pH值 pH value |
全氮/(g·kg-1) TN/(g·kg-1) |
全磷/(g·kg-1) TP/(g·kg-1) |
全钾/(g·kg-1) TK/(g·kg-1) |
有机碳/(g·kg-1) SOC/(g·kg-1) |
速效钾/(mg·kg-1) AK/(mg·kg-1) |
速效磷/(mg·kg-1) AP/(mg·kg-1) |
土壤容重/(g·cm3) SBD/(g·cm3) |
含水率/% SWC/% |
||
| PP | 4.50±0.06a | 0.78±0.06a | 0.19±0.01a | 1.97±0.16a | 13.14±0.33a | 10.77±1.09b | 1.76±0.03a | 41.04±3.21a | 25.68±0.17a | 1.19±0.02a | 29.49±1.47a |
| MPC | 4.51±0.05a | 0.85±0.02a | 0.21±0.01a | 2.17±0.06a | 12.73±0.95a | 11.26±0.48b | 1.85±0.05a | 48.73±3.73a | 23.58±0.08a | 1.11±0.04a | 26.92±1.95a |
| MPE | 4.37±0.02a | 0.93±0.05a | 0.17±0.01a | 2.62±0.13a | 13.46±0.25a | 14.33±0.25a | 2.28±0.21a | 43.89±0.57a | 21.28±0.26a | 1.08±0.08a | 26.32±2.10a |
| MPM | 4.48±0.07a | 1.09±0.23a | 0.20±0.02a | 2.24±0.19a | 15.57±0.97a | 5.15±0.66c | 0.92±0.19b | 43.61±0.81a | 23.30±2.44a | 0.93±0.05a | 26.08±2.72a |
| Note:Different lowercase letters indicate significant differences among different plantations at 0.05 level. | |||||||||||
2.2 马尾松与不同阔叶树种混交种植对土壤微生物群落组成和多样性特征的影响
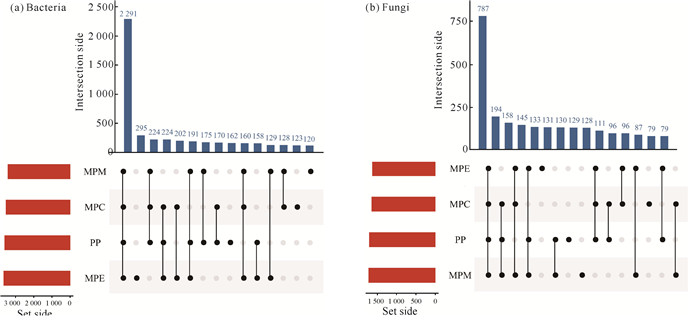
图 2为高阶韦恩Upset图,左下角柱状图表示各林分操作性分类单元(OTUs)的分布情况,上方柱状图和下方点线图分别表示不同林分类型独有的和共有的OTUs数量。在土壤的细菌群落中,4种林分共获得2 291个OTUs,其中PP、MPC、MPE、MPM独有的OTUs分别为162、123、295和120;而所有林分的土壤真菌群落共有787个OTUs,其中PP、MPC、MPE、MPM特有的OTUs数量分别为130、87、133和129。
|
| 图 2 不同林分类型细菌(a)和真菌(b)高阶韦恩Upset图 Fig. 2 Higher-order Venn Upset plots of bacteria (a) and fungi (b) in different plantations |
高通量测序分析得到的数据涵盖土壤细菌32门42纲75目125科229属。在土壤真菌中,涵盖7门30纲78目166科310属(表 4)。土壤细菌群落的α-多样性指数(Chao1指数、ACE指数和Shannon指数)在PP、MPC、MPE、MPM之间未表现出明显差异;而土壤真菌群落中,相比于PP,MPC、MPE和MPM的Chao1指数分别显著提高7.26%、9.07%、7.20%,MPC和MPE的ACE指数分别显著提高10.94%、10.10%(P < 0.05)(表 5)。
| 微生物类型 Microor-ganisms |
林分类型 Plantation |
门数 Number of phyla |
纲数 Number of classes |
目数 Number of orders |
科数 Number of families |
属数 Number of genus |
| Bacteria | PP | 32 | 42 | 75 | 125 | 229 |
| MPC | 29 | 42 | 72 | 112 | 221 | |
| MPE | 28 | 42 | 75 | 122 | 232 | |
| MPM | 32 | 41 | 75 | 122 | 212 | |
| Total | 32 | 42 | 75 | 125 | 229 | |
| Fungi | PP | 7 | 28 | 73 | 150 | 260 |
| MPC | 7 | 30 | 76 | 164 | 310 | |
| MPE | 7 | 29 | 78 | 166 | 300 | |
| MPM | 7 | 27 | 75 | 165 | 294 | |
| Total | 7 | 30 | 78 | 166 | 310 |
| 微生物类型 Microor-ganisms |
林分类型 Plantation |
Chao1指数 Chao1 index |
ACE指数 ACE index |
Shannon指数 Shannon index |
Simpson指数 Simpson index |
| Bacteria | PP | 1 206.14±21.41a | 1 239.52±35.93a | 4.41±0.15a | 0.04±0.01ab |
| MPC | 1 246.00±67.90a | 1 263.59±68.28a | 4.43±0.35a | 0.04±0.01ab | |
| MPE | 1 154.69±77.96a | 1 180.80±96.06a | 4.08±0.10a | 0.07±0.01a | |
| MPM | 1 206.95±113.82a | 1 213.66±112.10a | 4.59±0.16a | 0.03±0.01b | |
| Fungi | PP | 2 676.91±36.43b | 2 642.99±18.49b | 5.87±0.06a | 0.01±0.00b |
| MPC | 2 871.19±63.24a | 2 932.04±79.91a | 5.90±0.05a | 0.01±0.00a | |
| MPE | 2 919.71±30.51a | 2 910.03±70.35a | 5.97±0.00a | 0.01±0.00a | |
| MPM | 2 869.58±67.47a | 2 840.32±59.58ab | 5.92±0.03a | 0.01±0.00a | |
| Note: different lowercase letters indicate significant differences among different plantations at 0.05 level. | |||||
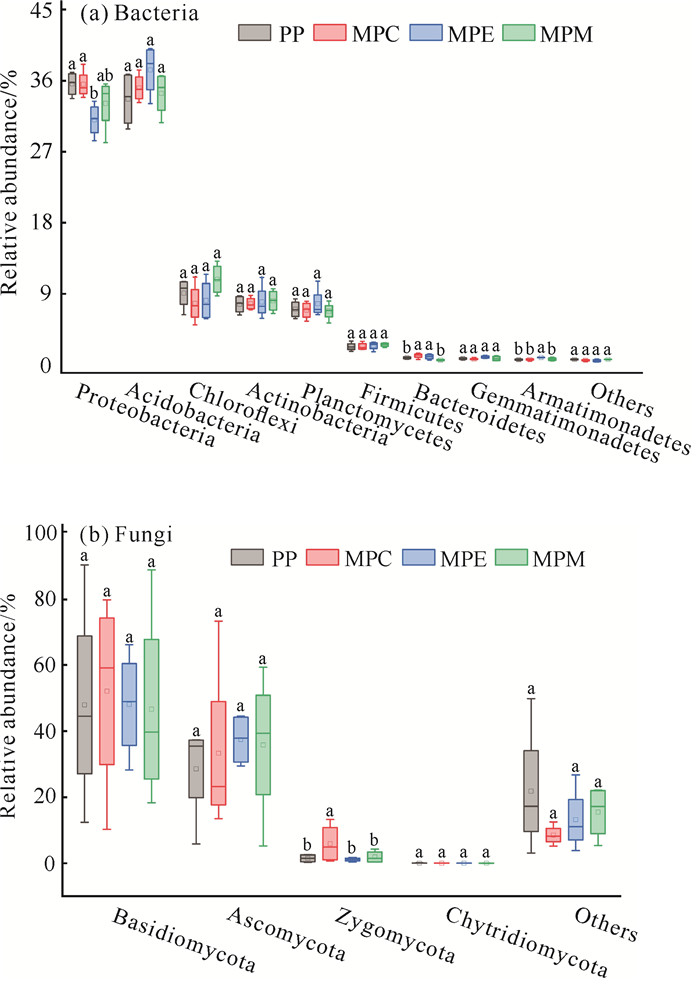
不同林分类型土壤细菌群落的前4个优势细菌门基本相同;真菌群落的前4个优势真菌门也相同。变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)和绿弯菌门(Chloroflexi)是细菌群落的优势菌门,它们的相对丰度占比超过76%。相较于PP,MPC和MPE的拟杆菌门(Bacteroidetes)、MPE的装甲菌门(Armatimonadetes),相对丰度显著提高(P < 0.05)。担子菌门(Basidiomycota)、子囊菌门(Ascomycota)和接合菌门(Zygomycota)是真菌群落的优势菌门,它们的相对丰度占比超过78%,MPC的接合菌门相对丰度较PP显著提高297.32%(图 3)。
|
| Different lowercase letters indicate significant differences among different plantations at 0.05 level. 图 3 不同林分类型细菌(a)和真菌(b)群落相对丰度箱型图 Fig. 3 Box plots of relative abundance of bacteria (a) and fungi (b) communities in different plantations |
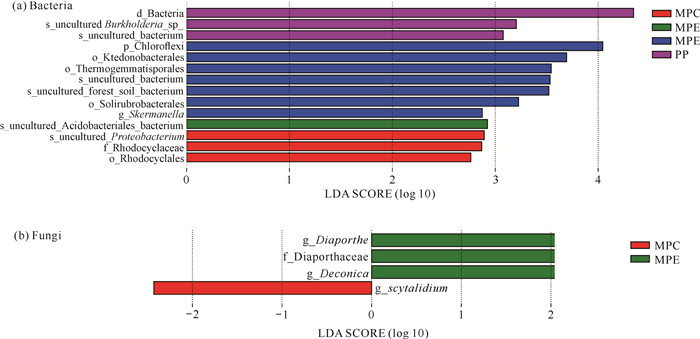
LDA分析结果(图 4)表明,在细菌群落中,PP中变形菌门未计算的伯克霍尔德氏菌属(Burkholderia)、黄单胞菌属(Xanthomonas)细菌显著增加;MPC中变形菌门红环菌目(Rhodocyclales)细菌、根瘤菌目(Rhizobiales)未计算的变形菌属(Proteobacterium)细菌显著富集;MPE中酸杆菌门未计算的酸杆菌属(Acidobacterium)细菌显著增加,MPM中绿弯菌门细菌显著富集,放线菌门(Actinobacteria)红色假单胞菌目(Solirubrobacterales)细菌显著增加,变形菌门斯克曼氏菌属(Skermanella)细菌显著增加,酸杆菌门未计算的酸杆菌属细菌显著富集。在真菌群落中,MPM中子囊菌门间座壳科(Diaporthaceae)间座壳属(Diaporthe)和担子菌门黄囊菇属(Deconica)真菌显著富集;MPC中子囊菌门节格孢属(Scytalidium)真菌显著富集。
|
| 图 4 细菌(a)和真菌(b)群落线性判别分析图(LDA=2) Fig. 4 Linear discriminant analysis plots for bacterial (a) and fungal (b) communities (LDA=2) |
2.3 土壤微生物群落与植物、土壤性质之间的关系
Mantel test检验结果如图 5所示。Croot∶Nroot、Croot∶Proot和AP与细菌群落α-多样性指数呈显著相关(P < 0.05),SWC与真菌群落α-多样性指数呈极显著相关(P < 0.01),TN和SBD与真菌群落α-多样性指数呈显著相关(P < 0.05),而TL、Nroot∶Proot、FRB、
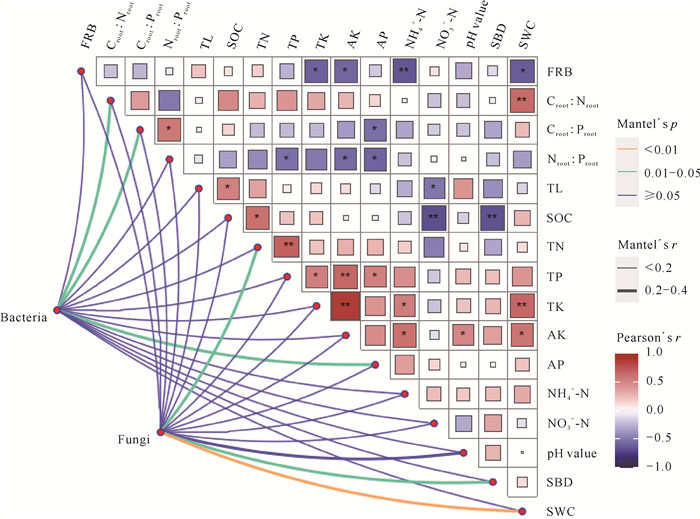
|
| TL indicates total litterfall mass; FRB indicates fine root biomass. 图 5 土壤微生物(细菌和真菌)群落α-多样性指数与植物、土壤性质的相关性 Fig. 5 Correlations of soil microbial (bacteria and fungi) α-diversity indices with plant and soil properties |
冗余分析揭示了SOC和pH值是影响细菌群落组成的关键因素[P < 0.05,图 6(a)],而含水率(SWC)是影响真菌群落组成的最主要驱动因子[P < 0.01,图 6(b)]。
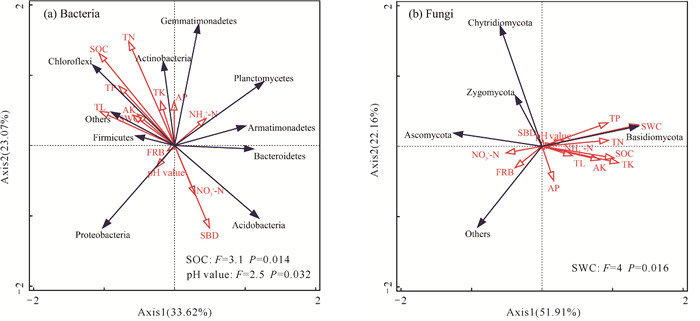
|
| 图 6 细菌(a)和真菌(b)群落组成与植物、土壤理化性质的冗余分析 Fig. 6 Redundancy analysis of bacterial (a) and fungal (b) community composition with plant and soil physical and chemical properties |
3 讨论
不同树种组成的林分,其凋落物种类和根系分泌物特性存在差异,这些差异会进一步影响土壤中的有机碳及养分含量。本研究中,笔者对比了马尾松纯林和马尾松/阔叶树种的混交林,发现混交种植后,凋落物量和细根生物量均显著增加。当马尾松与多种阔叶树种混交种植时,增加最为明显。许多研究也表明,混交林的根系相较于纯林,其结构更为复杂且丰富多样[19-21]。这种复杂的根系结构不仅提高了根系周转率,也使得混交林土壤通常表现出更高的碳汇能力。这一发现对于我们理解和优化森林生态系统的碳循环过程,以及提高土壤肥力和生态系统稳定性具有重要意义[22, 23]。但在本研究中,混交林的SOC含量与马尾松纯林相比并未显著提高,其原因除了种植年限较短外,也和SOC的固持过程极其复杂有关。SOC积累是一个十分缓慢的过程,不仅与地上凋落物、地下根系有机物输入有关,还受土壤微生物介导的有机碳输出过程影响[24]。格木作为一种固氮树种,可以与固氮菌形成互利共生关系,即固氮菌能固定大量的氮并提高其有效性,从而有助于改善土壤养分,特别是提高土壤氮的有效性[25],而本研究也发现马尾松与格木混交种植能显著提高土壤
土壤微生物作为土壤的重要组成部分,其群落组成和多样性特征是反映土壤生态功能的重要指标之一,在土壤有机质分解和养分循环过程中发挥着不可替代的作用。由于地上凋落物和地下根系有机物输入数量和质量不同,不同林分类型的土壤微生物群落组成和多样性特征可能存在明显差异。本研究中,真菌群落的ACE指数在马尾松/红锥混交林和马尾松/格木混交林中均显著高于马尾松纯林,Chao1指数在3种混交林中也均显著高于马尾松纯林。许多研究表明,纯林和混交林在土壤微生物群落组成和多样性特征方面存在显著差异,认为混交林由于其树种组成数量增加,从而提供更加多样的环境和养分条件,更有利于不同微生物群落的生长和繁殖[26, 27]。与一些研究认为针/阔混交林土壤对细菌群落多样性的形成更有利的结论不同[28],本研究发现,不管单一阔叶树种或多种阔叶树种,马尾松混交种植5年后,其土壤细菌群落的α-多样性指数与马尾松纯林相比均无显著变化。其原因可能包括:(1)土壤细菌群落多样性通常受土壤理化性质的直接影响,但在本研究中,混交林土壤理化性质除个别指标外,SWC、SBD、SOC、TN、TP和pH值等大部分指标与纯林相比均无显著变化,相似的土壤条件可能是土壤细菌群落α-多样性指数没有发生显著变化的主要原因之一。(2)虽然混交林在树种组成上更为复杂,但由于其混交种植的年限较短,凋落物、根系及其根系分泌物对土壤细菌群落多样性的影响并不足以造成显著差异。(3)混交林和纯林所处的环境相似,这些相似的环境因素可能掩盖了树种组成对细菌群落多样性的影响。本研究结果显示,细菌群落α-多样性指数与Croot∶Nroot、Croot∶Proot和AP呈显著相关,真菌群落α-多样性指数与TN、SBD存在显著相关。这一发现与杨慧琴等[29]的研究结果相契合,即土壤养分含量的变化对土壤微生物活性产生影响,从而推动微生物群落结构的多样性发生变化。另有研究表明,土壤真菌群落通过增加土壤孔隙度来提升微生物活性,进而实现其多样性的提升[30]。这些发现共同揭示了土壤理化性质与微生物群落多样性之间的紧密联系。
针/阔混交林作为一种常见的营林类型,与传统的针叶纯林相比能够优化人工林的林分群落结构,增强生态系统服务功能,同时也会对凋落物量、凋落物和根的性质特征、土壤养分特征、水分、孔隙度等方面产生影响,从而促进凋落物分解和养分循环,进而影响微生物群落组成,其优势菌门的相对丰度也随之发生改变[31]。本研究发现土壤细菌的主要门类包括变形菌门、酸杆菌门和绿弯菌门,这与张宏锦等[32]的研究结果一致,即土壤中通常包含这3个细菌群;但与马尾松纯林相比,除了马尾松/红锥混交林土壤的拟杆菌门的相对丰度,以及马尾松/格木混交林土壤的变形菌门、拟杆菌门和装甲菌门的相对丰度外,混交林土壤的其他细菌门类均无显著变化。真菌是有机物分解的重要参与者,能够分泌与碳循环相关的胞外酶降解土壤中的纤维素和木质素等物质。真菌群落的主要门类则为子囊菌门和担子菌门,其中子囊菌门主要是糖类分解菌,含有大量的纤维素,从而促进凋落物的分解[33-36];而担子菌门更易在生产力较高的生态系统中生存[37, 38],主要降解富含木质素的有机物,促进土壤养分循环[39]。本研究中,除马尾松/红锥混交林土壤的接合菌门相对丰度与马尾松纯林相比显著提高外,其他真菌门类的相对丰度均无显著变化。本研究结果显示,细菌的绿弯菌门与SOC呈显著正相关,而真菌的担子菌门则与TN呈正相关。这一发现具有重要意义,因为SOC和TN作为土壤理化性质的核心指标,在土壤养分循环中扮演着举足轻重的角色[40, 41]。SOC和TN的含量变化不仅显著影响土壤肥力的动态,还深刻塑造微生物群落的分布格局。值得注意的是,土壤微生物群落的组成和活性受到多重因素的影响。除土壤养分含量和孔隙结构等理化性质外,植物种类也发挥着不可或缺的作用[42, 43]。植物通过调节凋落物的种类[44]和根部代谢产物的释放[45],能够有效调节微生物群落的丰富度和多样性,从而塑造出更有利于自身生长发育的微生物群落结构和功能类群。然而,在本研究中,无论是马尾松纯林还是混交林,都是在种植5年后开展的研究。尽管在此期间微生物群落发生了一定程度的变化,但尚未达到显著差异的水平。为了更深入地理解树种类型及其混交种植方式对土壤微生物群落结构和功能的影响,需要开展更为持久和系统的研究。期望通过持续监测和研究,构建一个生产力更高、经济价值更优越且生态系统功能更强大的针/阔混交林。这种新型的森林结构将有效替代我国原有大面积分布的单一树种林,不仅有助于提升土壤微生物群落的多样性和活性,还能够为森林生态系统的可持续发展注入新的活力。
4 结论马尾松与单一或多种阔叶树混交种植5年后,虽然细根生物量和凋落物量有所增加,但对土壤理化性质的影响有限。相对于马尾松纯林,混交林土壤的真菌群落物种多样性显著提高,而细菌群落物种多样性变化不显著。土壤有效磷(AP)、细根碳氮比(Croot∶Nroot)、细根碳磷比(Croot∶Proot)与细菌群落物种多样性指数显著相关,而土壤有机碳(SOC)和pH值是影响细菌群落组成的关键因素。土壤中的全氮(TN)、容重(BD)与真菌群落物种多样性指数显著相关,含水率(SWC)是影响真菌群落组成的主要因素。后期还需开展更为长期和系统的研究,深入探讨树种类型及其混交种植模式对土壤微生物群落结构和功能的影响,为南亚热带人工林多功能经营策略的树种选择提供科学依据。
| [1] |
宋战超, 王晖, 刘世荣, 等. 南亚热带混交人工林树种丰富度与土壤微生物多样性和群落组成的关系[J]. 生态学报, 2020, 40(22): 8265-8273. |
| [2] |
CHEN F L, ZHENG H, ZHANG K, et al. Changes in soil microbial community structure and metabolic activity following conversion from native Pinus massoniana plantations to exotic Eucalyptus plantations[J]. Forest Ecology and Management, 2013, 291: 65-72. DOI:10.1016/j.foreco.2012.11.016 |
| [3] |
LIU B R, JIA G M, CHEN J, et al. A review of methods for studying microbial diversity in soils[J]. Pedosphere, 2006, 16(1): 18-24. DOI:10.1016/S1002-0160(06)60021-0 |
| [4] |
FIERER N, JACKSON R B. The diversity and biogeography of soil bacterial communities[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(3): 626-631. |
| [5] |
LING N, DENG K Y, SONG Y, et al. Variation of rhizosphere bacterial community in watermelon continuous mono-cropping soil by long-term application of a novel bioorganic fertilizer[J]. Microbiological Research, 2014, 169(7/8): 570-578. |
| [6] |
SALEEM M, HU J, JOUSSET A. More than the sum of its parts: microbiome biodiversity as a driver of plant growth and soil health[J]. Annual Review of Ecology, Evolution, and Systematics, 2019, 50: 145-168. DOI:10.1146/annurev-ecolsys-110617-062605 |
| [7] |
CHEN L, XIANG W H, WU H L, et al. Tree species identity surpasses richness in affecting soil microbial richness and community composition in subtropical forests[J]. Soil Biology and Biochemistry, 2019, 130: 113-121. DOI:10.1016/j.soilbio.2018.12.008 |
| [8] |
张小波, 郭兰萍, 赵曼茜, 等. 马尾松生产适宜性区划研究[J]. 中国中药杂志, 2016, 41(17): 3113-3121. |
| [9] |
李鹏, 零天旺, 杨章旗, 等. 不同林龄马尾松人工林叶片-土壤碳氮磷生态化学计量特征研究[J]. 西南林业大学学报(自然科学), 2023, 43(1): 88-98. |
| [10] |
刘志龙, 蔡道雄, 贾宏炎, 等. 我国南方人工林近自然化改造模式和效益分析: 基于中国林科院热林中心实践研究[J]. 林业科技通讯, 2016(10): 3-7. |
| [11] |
PRETZSCH H, FORRESTER D I, BAUHUS J. Mixed-species forests: ecology and management[M]. Berlin: Springer Nature, 2017.
|
| [12] |
DIXON R, KAHN D. Genetic regulation of biological nitrogen fixation[J]. Nature Reviews Microbiology, 2004, 2(8): 621-631. DOI:10.1038/nrmicro954 |
| [13] |
DE A PEREIRA A P, SANTANA M C, ZAGATTO M R G, et al. Nitrogen-fixing trees in mixed forest systems regulate the ecology of fungal community and phosphorus cycling[J]. The Science of the Total Environment, 2021, 758: 143711. DOI:10.1016/j.scitotenv.2020.143711 |
| [14] |
GAO G N, HUANG X M, XU H C, et al. Conversion of pure Chinese fir plantation to multi-layered mixed plantation enhances the soil aggregate stability by regulating microbial communities in subtropical China[J]. Forest Ecosystems, 2022, 9: 100078. DOI:10.1016/j.fecs.2022.100078 |
| [15] |
YE X D, LUAN J W, WANG H, et al. Tree species richness and N-fixing tree species enhance the chemical stability of soil organic carbon in subtropical plantations[J]. Soil Biology and Biochemistry, 2022, 174: 108828. DOI:10.1016/j.soilbio.2022.108828 |
| [16] |
SPARKS D L, PAGE A L, HELMKE P A, et al. Methods of soil analysis.Part 3-chemical methods[M]. Madison: Soil Science Society of America Incorporated, 1996.
|
| [17] |
鲍士旦. 土壤农化分析[M]. 3版. 北京: 中国农业出版社, 2013.
|
| [18] |
刘光崧. 土壤理化分析与剖面描述[M]. 北京: 中国标准出版社, 1996.
|
| [19] |
梁艳, 明安刚, 何友均, 等. 南亚热带马尾松-红椎混交林及其纯林土壤细菌群落结构与功能[J]. 应用生态学报, 2021, 32(3): 878-886. |
| [20] |
BRASSARD B W, CHEN H Y H, CAVARD X, et al. Tree species diversity increases fine root productivity through increased soil volume filling[J]. Journal of Ecology, 2013, 101(1): 210-219. DOI:10.1111/1365-2745.12023 |
| [21] |
MA Z, CHEN H Y H. Effects of species diversity on fine root productivity in diverse ecosystems: a global meta-analysis[J]. Global Ecology and Biogeography, 2016, 25(11): 1387-1396. DOI:10.1111/geb.12488 |
| [22] |
王峰, 常云妮, 孙君, 等. 武夷山不同种植模式下茶园土壤理化性质和酶活性的季节变化特征[J]. 茶叶科学, 2024, 44(2): 231-245. DOI:10.3969/j.issn.1000-369X.2024.02.005 |
| [23] |
WANG J, WANG H, LI X, et al. Effects of environmental factors and tree species mixtures on the functional groups of soil organic carbon across subtropical plantations in southern China[J]. Plant and Soil, 2022, 480(1): 265-281. |
| [24] |
汪景宽, 徐英德, 丁凡, 等. 植物残体向土壤有机质转化过程及其稳定机制的研究进展[J]. 土壤学报, 2019, 56(3): 528-540. |
| [25] |
张文, 李佳君, 向明珠, 等. 固氮树种马占相思对巨尾桉人工林土壤团聚体粒径分布及稳定性的影响[J]. 广西植物, 2024, 44(7): 1245-1256. |
| [26] |
KHLIFA R, PAQUETTE A, MESSIER C, et al. Do temperate tree species diversity and identity influence soil microbial community function and composition?[J]. Ecology and Evolution, 2017, 7(19): 7965-7974. DOI:10.1002/ece3.3313 |
| [27] |
LI W Y, SUN H M, CAO M M, et al. Diversity and structure of soil microbial communities in Chinese fir plantations and Cunninghamia lanceolata-Phoebe bournei mixed forests at different successional stages[J]. Forests, 2023, 14(10): 1977. DOI:10.3390/f14101977 |
| [28] |
李勋, 张艳, 宋思梦, 等. 西南地区马尾松与乡土阔叶树种凋落叶混合分解过程中的细菌群落特征[J]. 生态环境学报, 2024, 33(1): 12-27. |
| [29] |
杨慧琴, 向涌旗, 吕倩, 等. 3种混交林造林初期土壤真菌群落结构特征[J]. 生态学报, 2024, 44(8): 3360-3371. |
| [30] |
DING Y H, GAO X D, SHU D T, et al. Enhancing soil health and nutrient cycling through soil amendments: improving the synergy of bacteria and fungi[J]. The Science of the Total Environment, 2024, 923: 171332. DOI:10.1016/j.scitotenv.2024.171332 |
| [31] |
董学德, 高鹏, 李腾, 等. 土壤微生物群落对麻栎-刺槐混交林凋落物分解的影响[J]. 生态学报, 2021, 41(6): 2315-2325. |
| [32] |
张宏锦, 王娓. 生态系统多功能性对全球变化的响应: 进展、问题与展望[J]. 植物生态学报, 2021, 45(10): 1112-1126. |
| [33] |
BACHAR A, AL-ASHHAB A, SOARES M I M, et al. Soil microbial abundance and diversity along a low precipitation gradient[J]. Microbial Ecology, 2010, 60(2): 453-461. DOI:10.1007/s00248-010-9727-1 |
| [34] |
WANG K B, ZHANG Y W, TANG Z S, et al. Effects of grassland afforestation on structure and function of soil bacterial and fungal communities[J]. The Science of the Total Environment, 2019, 676: 396-406. DOI:10.1016/j.scitotenv.2019.04.259 |
| [35] |
ZHOU Z Y, YU M H, DING G D, et al. Effects of Hedysarum leguminous plants on soil bacterial communities in the Mu Us Desert, Northwest China[J]. Ecology and Evolution, 2020, 10(20): 11423-11439. DOI:10.1002/ece3.6779 |
| [36] |
WANG G Z, LIU Y G, CUI M, et al. Effects of secondary succession on soil fungal and bacterial compositions and diversities in a Karst Area[J]. Plant and Soil, 2022, 475(1): 91-102. |
| [37] |
YANG W, JEELANI N, XIA L, et al. Soil fungal communities vary with invasion by the exotic Spartina alternifolia Loisel.in coastal salt marshes of Eastern China[J]. Plant and Soil, 2019, 442(1): 215-232. |
| [38] |
MORRISON E W, FREY S D, SADOWSKY J J, et al. Chronic nitrogen additions fundamentally restructure the soil fungal community in a temperate forest[J]. Fungal Ecology, 2016, 23: 48-57. DOI:10.1016/j.funeco.2016.05.011 |
| [39] |
GE Z, LI S Y, BOL R, et al. Differential long-term fertilization alters residue-derived labile organic carbon fractions and microbial community during straw residue decomposition[J]. Soil and Tillage Research, 2021, 213: 105120. DOI:10.1016/j.still.2021.105120 |
| [40] |
张秀, 赵永存, 谢恩泽, 等. 土壤有机碳时空变化研究进展与展望[J]. 农业环境科学学报, 2020, 39(4): 673-679. |
| [41] |
李贵才, 韩兴国, 黄建辉, 等. 森林生态系统土壤氮矿化影响因素研究进展[J]. 生态学报, 2001, 21(7): 1187-1195. DOI:10.3321/j.issn:1000-0933.2001.07.023 |
| [42] |
DING X X, LIU G L, FU S L, et al. Tree species composition and nutrient availability affect soil microbial diversity and composition across forest types in subtropical China[J]. Catena, 2021, 201: 105224. DOI:10.1016/j.catena.2021.105224 |
| [43] |
XU Z Y, HU Z H, JIAO S, et al. Depth-dependent effects of tree species identity on soil microbial community characteristics and multifunctionality[J]. The Science of the Total Environment, 2023, 878: 162972. DOI:10.1016/j.scitotenv.2023.162972 |
| [44] |
YAN J F, WANG L, HU Y, et al. Plant litter composition selects different soil microbial structures and in turn drives different litter decomposition pattern and soil carbon sequestration capability[J]. Geoderma, 2018, 319: 194-203. DOI:10.1016/j.geoderma.2018.01.009 |
| [45] |
PAN J W, WU H L, XIANG W H, et al. Soil microbial richness and community composition are primarily mediated by functional trait diversity of fine roots in subtropical forests[J]. Plant and Soil, 2024, 497(1): 485-501. |



