2. 贵州师范大学国际教育学院,贵州贵阳 550025
2. School of International Education, Guizhou Normal University, Guiyang, Guizhou, 550025, China
苔藓植物包括苔类植物、藓类植物和角苔植物三大类群,其中角苔植物是在4.6亿年前从苔类和藓类植物两个单系类群中分化出来的第三个分支[1-3]。3个类群中角苔植物物种丰富度最低,只有200-250种。因具有不确定的基部分生组织产生的孢子体,以及类似于苔藓、维管植物的气孔使角苔植物成为研究陆地植物进化的关键类群[4, 5]。因此,对角苔植物深入研究并挖掘更多的基因资源至关重要。目前,苔类植物和藓类植物的遗传转化体系已经成熟,但关于褐角苔(Folioceros fuciformis)的遗传转化方法还未见报道,仍是一个有待攻克的领域。
植物遗传转化是指有目的地将外源基因或DNA片段插入受体植物基因组中,所导入的基因在植物中能够稳定地表达和遗传[6, 7]。当前常见的植物遗传转化方法包括聚乙二醇(Polyethylene Glycol,PEG)介导转化法、基因枪介导转化法(Gene gun mediated transformation)、限制内切酶介导转化法(Restriction Enzyme-Mediated DNA Integration, REMI)及农杆菌(Agrobacterium)介导的转化法(Agrobacterium-Mediated Transformation, ATMT),其中农杆菌介导法是最常用的转基因方法[8, 9]。与其他转化方法相比,农杆菌介导的遗传转化具有显著优势,除易操作、转化成本低外,还具有受体范围选择广、转化效率高、低拷贝、能够稳定复制及表达等特点[10]。1991年,Schaefer等[11]通过聚乙二醇介导转化法介导DNA转染至原生质体,使得小立碗藓(Physcomitrium patens)首次转化成功,这使不育突变体的遗传优势研究和互补分析成为可能,小立碗藓成为藓类植物发育遗传学的模式生物。Ishizaki等[12]利用农杆菌介导将带有β葡萄糖苷酸酶(GUS)和潮霉素(Hygromycin)标记的载体转化到地钱(Marchantia polymorpha)中,为苔类植物提供遗传转化方法以促进比较基因组学的发展。因此,在角苔植物中建立高效稳定的遗传转化方法尤为重要。本研究以褐角苔为受体材料,对潮霉素浓度、外植体预培养时间、农杆菌菌液OD值、菌液添加量、乙酰丁香酮(AS)浓度和共培养时间等影响遗传转化效率的因素进行筛选,构建高效稳定的褐角苔遗传转化体系,拟为进一步研究角苔植物的演化历史和基因功能奠定基础。
1 材料与方法 1.1 材料 1.1.1 供试植物、菌株和质粒褐角苔为本实验室保存,基因组DNA和RNA提取试剂盒均购自宝日医生物技术(北京)有限公司,潮霉素、头孢(Cephalosporins)、农杆菌AGL1感受态细胞和AS均购自贵阳超研远诚生物科技有限公司,植物表达载体pCAMBIA1305.2购自长沙瑞英生物科技有限公司。
1.1.2 培养基KNOP培养基:KH2PO4 250 mg/L、KCl 250 mg/L、MgSO4·7H2O 250 mg/L、Ca(NO3)2·4H2O 1 000 mg/L和FeSO4·7H2O 12.5 mg/L,pH值为5.8。YEP培养基:称取胰蛋白胨(Tryptone)10 g,氯化钠5 g,酵母浸粉10 g,琼脂粉15 g,水1 L,调节pH值为5.8。共培养基:在KNOP培养基中加入2%的蔗糖和100 μmol/L的AS。筛选培养基:在KNOP培养基中加入15 mg/L潮霉素。
1.2 方法 1.2.1 褐角苔对潮霉素的敏感实验设置潮霉素浓度为0、5、10、15、20、25 mg/L。将褐角苔植株接种在筛选培养基中进行培养,于22 ℃恒温组培室中培养,每个浓度设置3个重复,观察褐角苔的生长情况。
1.2.2 农杆菌菌液的制备将质粒pCAMBIA1305.2通过冻融法转化至农杆菌AGL1菌株中,于28 ℃在含有卡那霉素[Kanamycin (Kan),50 mg/L]的YEP培养基中培养,获得单菌落的转化子。将2-3个农杆菌菌落接种在含有Kan (50 mg/L)和利福平(10 mg/L)的YEP培养基中,在28 ℃、120 r/min振荡下培养2 d。
1.2.3 外植体的预培养在50 mL无菌离心管中装入0.5 g的褐角苔无菌叶状体组织和15 mL无菌水,用均质器将其均质化。使用100 μm细胞筛将均质化的组织过滤后铺在KNOP培养基上,并在22 ℃恒温组培室中培养。培养4周后,将培养组织重新均质化,并使用100 μm细胞筛过滤。将再次均质化的褐角苔组织置于KNOP培养基中预培养。预培养时间(A)设置为0、1、2、3、4 d。
1.2.4 农杆菌菌液OD值、农杆菌添加量、AS浓度和共培养时间设置为初步筛选遗传转化因素的最佳条件,设置农杆菌菌液OD600值(B)梯度为0.4、0.6、0.8、1.0和1.2,用以上5个梯度农杆菌菌液侵染褐角苔预培养外植体;设置KNOP培养基中的农杆菌添加量(C)为30、50、80、100、120 μL;设置AS浓度梯度(D)为0、50、100、150、200 μmol/L,在添加了农杆菌的KNOP培养基中加入不同浓度的AS;将上述添加了不同浓度农杆菌菌液和AS的5 mL KNOP培养基再加入褐角苔预培养外植体共培养,设置共培养时间(E)梯度为0.5、1.0、2.0、3.0、4.0 d。设计上述5因素5水平的正交试验对褐角苔进行农杆菌介导的遗传转化实验(表 1),用Excel 2016和SPSS 27.0.1软件对数据进行极差分析,最终得出遗传转化效率较高的参数组合。
| 水平 Level |
预培养时间(A)/d Preculture time (A)/d |
菌液OD600值(B) OD600 value of bacterial suspension (B) |
菌液添加量(C)/μL Bacterial suspension addition (C)/μL |
AS浓度(D)/(μmol/L) AS concentration (D)/(μmol/L) |
共培养时间(E)/d Coincubation time (E)/d |
| 1 | 0 | 0.4 | 30 | 0 | 0.5 |
| 2 | 1 | 0.6 | 50 | 50 | 1.0 |
| 3 | 2 | 0.8 | 80 | 100 | 2.0 |
| 4 | 3 | 1.0 | 100 | 150 | 3.0 |
| 5 | 4 | 1.2 | 120 | 200 | 4.0 |
1.2.5 共培养及转化
首先,将1.2.2节方法下培养的25 mL农杆菌菌液离心沉淀,弃去上清液,在沉淀物中加入5 mL含有2%(W∶V)蔗糖和相应浓度AS的KNOP培养基中,用酶标仪测定农杆菌菌液OD600值后在28 ℃下振荡(120 r/min)孵育5 h。其次,将预培养后的褐角苔组织放到孵育5 h后的KNOP培养基中,在黑暗、22 ℃和110 r/min振荡条件下共培养。然后,用100 μm细胞筛过滤共培养的褐角苔组织,并移至含有100 μmol/L头孢和15 mg/L潮霉素的固体KNOP培养基中,在22 ℃恒温组培室中培养。3-4周后,将存活下来的植物转移到含有15 mg/L潮霉素的固体KNOP培养基中,最后筛选抗性转化子,计算转化效率。
转化效率(%)=转化植株数(个)/总接种数(个)×100%。
1.2.6 转基因褐角苔阳性植株的鉴定提取褐角苔转基因阳性苗和野生组培苗总DNA,设计潮霉素引物和载体引物进行PCR验证。提取T2代转基因褐角苔阳性苗总RNA并反转录得到cDNA,以内参基因(Actin)引物和载体引物进行RT-qPCR验证(表 2)。实验结果采用2-ΔΔCt法计算[13]。
| 引物名称 Primer name |
引物序列(5′→3′) Primer sequence (5′→3′) |
| Hygromycin-F | CCCAAGCTGCATCATCGAAA |
| Hygromycin-R | GCGCCGATGGTTTCTACAAA |
| pCAMBIA1305.2-F(PCR) | CAAACAAACCACCGCTGGTA |
| pCAMBIA1305.2-R(PCR) | ATAGAGTAGATGCCGACCGGA |
| Actin-F | ACGCCTGAACATCTCCTGAA |
| Actin-R | CGTGCAGAACAAGAACTCGT |
| pCAMBIA1305.2-F(RT-qPCR) | TCTTCCCCGATATCCTCCCT |
| pCAMBIA1305.2-R(RT-qPCR) | TGTGGATTGCGAAAACTGGG |
1.2.7 转基因植株β葡萄糖苷酸酶(GUS)染色检测
取出褐角苔野生型(WT)植株和转基因植株,置于GUS染色液中,37 ℃恒温染色6 h。使用70%酒精脱色两次以除去叶绿素,观察植株染色情况。
2 结果与分析 2.1 褐角苔对潮霉素的敏感性实验将褐角苔外植体分别接种于含有不同浓度潮霉素的KNOP培养基上培养50 d后,发现潮霉素浓度为5 mg/L时,褐角苔外植体还能存活;随着潮霉素浓度增加,浓度10 mg/L及以上的潮霉素会导致褐角苔外植体褐化死亡(图 1)。因此,褐角苔外植体在浓度10 mg/L以下的潮霉素中才能存活,而且浓度适量增大可提高筛选成功率,因此15 mg/L潮霉素可作为抗性植株筛选的最适浓度。

|
| (a)-(e) are the explants of Folioceros fuciformis cultured in KNOP medium for 0 d, there was no hygromycin added in (a), and the concentrations of hygromycin added in (b)-(e) were 5, 10, 20 and 25 mg/L, respectively; (f)-(j) are explants of F.fuciformis cultured in KNOP medium for 50 d, there was no hygromycin added in (f), and the hygromycin added in (g)-(j) was 5, 10, 20 and 25 mg/L, respectively. 图 1 潮霉素对褐角苔生长的影响 Fig. 1 Effect of hygromycin on the growth of F.fuciformis |
2.2 褐角苔遗传转化体系条件筛选
通过正交试验确定农杆菌介导的褐角苔遗传转化条件的最佳组合。比较5个因素转化效率的极差R值,R值越大,其对应的因素对转化效率的影响越大,因此根据极性R值的大小可以确定主要影响因素和次要影响因素,从而确定最优组合。由表 3可以看出,R值的大小顺序为B=C=E>A=D,即各因素对转化效率的影响大小顺序为菌液OD600值=菌液添加量=共培养时间>预培养时间=AS浓度,说明菌液OD600值、菌液添加量和共培养时间对转化效率的影响最大。根据各因素水平所对应转化效率的平均值来看,A因素的第五水平、B因素的第三水平、C因素的第三水平、D因素的第三水平和E因素的第四水平均为最高,即可以确定各因素的最佳组合为A5B3C3D3E4,即预培养4 d、菌液OD600值=0.8、菌液添加量80 μL、AS浓度100 μmol/L和共培养时间3 d。在该条件下褐角苔的遗传转化效率最高,可达30%。
| 处理 Treatment |
A | B | C | D | E | 接种数/个 Number of explants |
转化植株数/个 Number of transformed plants |
转化效率/% Transformati on rate/% |
| 1 | 1(0) | 1(0.4) | 1(30) | 1(0) | 1(0.5) | 10 | 0 | 0 |
| 2 | 1 | 2(0.6) | 3(80) | 4(150) | 5(4) | 10 | 0 | 0 |
| 3 | 1 | 3(0.8) | 5(120) | 2(50) | 4(3) | 10 | 0 | 0 |
| 4 | 1 | 4(1.0) | 2(50) | 5(200) | 3(2) | 10 | 0 | 0 |
| 5 | 1 | 5(1.2) | 4(100) | 3(100) | 2(1) | 10 | 0 | 0 |
| 6 | 2(1) | 1 | 5 | 4 | 3 | 10 | 0 | 0 |
| 7 | 2 | 2 | 2 | 2 | 2 | 10 | 0 | 0 |
| 8 | 2 | 3 | 4 | 5 | 1 | 10 | 0 | 0 |
| 9 | 2 | 4 | 1 | 4 | 5 | 10 | 0 | 0 |
| 10 | 2 | 5 | 3 | 1 | 2 | 10 | 0 | 0 |
| 11 | 3(2) | 1 | 4 | 2 | 5 | 10 | 0 | 0 |
| 12 | 3 | 2 | 1 | 5 | 4 | 10 | 0 | 0 |
| 13 | 3 | 3 | 3 | 3 | 3 | 10 | 1 | 10 |
| 14 | 3 | 4 | 5 | 1 | 2 | 10 | 0 | 0 |
| 15 | 3 | 5 | 2 | 4 | 1 | 10 | 0 | 0 |
| 16 | 4(3) | 1 | 1 | 5 | 2 | 10 | 0 | 0 |
| 17 | 4 | 2 | 5 | 3 | 1 | 10 | 0 | 0 |
| 18 | 4 | 3 | 2 | 1 | 5 | 10 | 1 | 10 |
| 19 | 4 | 4 | 4 | 4 | 4 | 10 | 2 | 20 |
| 20 | 4 | 5 | 1 | 2 | 3 | 10 | 0 | 0 |
| 21 | 5(4) | 1 | 2 | 3 | 4 | 10 | 0 | 0 |
| 22 | 5 | 2 | 4 | 1 | 3 | 10 | 0 | 0 |
| 23 | 5 | 3 | 3 | 3 | 4 | 10 | 3 | 30 |
| 24 | 5 | 4 | 3 | 2 | 1 | 10 | 1 | 10 |
| 25 | 5 | 5 | 5 | 5 | 5 | 10 | 0 | 0 |
| K1 | 0 | 0 | 0 | 10 | 10 | |||
| K2 | 0 | 0 | 10 | 10 | 0 | |||
| K3 | 10 | 50 | 50 | 40 | 10 | |||
| K4 | 30 | 30 | 20 | 20 | 50 | |||
| K5 | 40 | 0 | 0 | 0 | 10 | |||
| k1 | 0.00 | 0.00 | 0.00 | 3.33 | 3.33 | |||
| k2 | 0.00 | 0.00 | 3.33 | 3.33 | 0.00 | |||
| k3 | 3.33 | 16.67 | 16.67 | 13.33 | 3.33 | |||
| k4 | 10.00 | 10.00 | 6.67 | 6.67 | 16.67 | |||
| k5 | 13.33 | 0.00 | 0.00 | 0.00 | 3.33 | |||
| R | 13.33 | 16.67 | 16.67 | 13.33 | 16.67 | |||
| Note: the values in brackets indicate the specific levels of the five factors (see Table 1 for details). | ||||||||
2.3 转基因植株分子鉴定
分别提取转化实验中获得的携带潮霉素抗性的转基因植株[图 2(a)]及WT植株叶片DNA,以潮霉素引物和载体引物进行PCR扩增检测,其中共有5株转基因植株扩增出与阳性质粒一致的条带,而WT、空白对照(CK)均未扩增出条带[图 2(b)]。
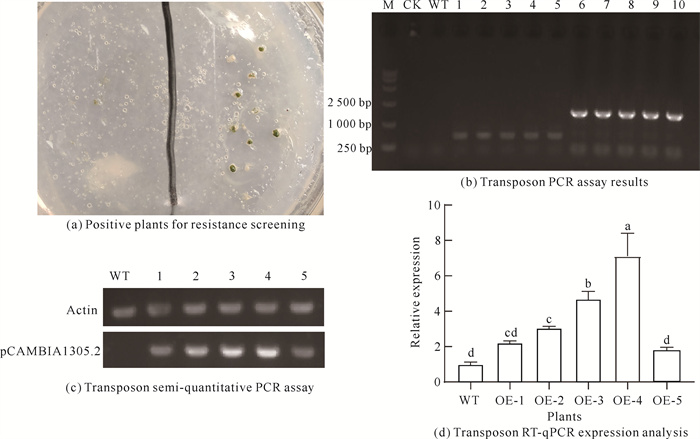
|
| M: marker(15 000 bp); CK: blank control; WT: wild type plant; Lane 1-5:hygromycin amplification test, Lane 6-10:vector primer amplification detection; OE1-OE5:transgenic plants. 图 2 褐角苔转基因植株分子鉴定 Fig. 2 Molecular characterization of F.fuciformis transgenic plants |
为进一步检测目的载体在褐角苔转化植株中是否转录,对上述转基因阳性植株与野生型植株作半定量PCR[图 2(c)]和实时荧光定量PCR(RTqPCR)分析[图 2(d)]。转基因阳性植株基因表达水平均高于野生型植株,为野生型植株1.7-7.1倍,表明目的载体已转入褐角苔并稳定表达,可用于后续实验。
2.4 GUS染色鉴定抗性植株分别对褐角苔WT植株和转基因阳性植株进行GUS染色,其中转基因阳性植株呈现蓝色,而WT植株无色(图 3),表明携带目的基因的载体已转入褐角苔中,并获得了正确表达。
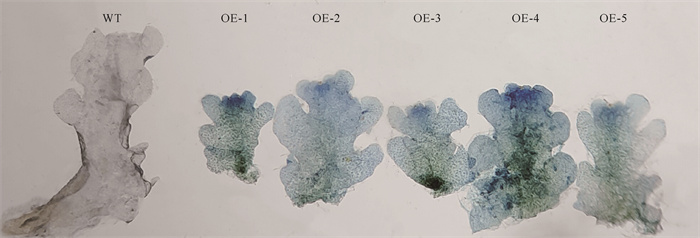
|
| WT: wild type plant; OE1-OE5:transgenic plants. 图 3 转化子GUS染色检测情况 Fig. 3 Transposon GUS staining |
3 讨论
常用的植物遗传转化方法是使用农杆菌介导,该技术是目前最成熟、应用最广泛的遗传转化方法[14-16]。Hood等[17]用农杆菌转化方法感染生长3个月的挪威云杉(Picea abies)幼苗,转化率达31%。王晶莹[18]通过比较发现用农杆菌介导转化地钱胞芽的转化效率较高,均可达到50%以上。目前尚未有关于农杆菌介导的褐角苔遗传转化体系的报道,因此本研究对农杆菌AGL1菌株介导褐角苔遗传转化过程中的主要影响因素(预培养时间、农杆菌菌液OD600值、农杆菌添加量、共培养时间、AS浓度)进行筛选,构建了褐角苔的遗传转化体系,为角苔的后续研究提供了一定的参考。
在植物的遗传转化过程中首要步骤应确定筛选转化体的筛选剂。潮霉素是一种氨基糖苷类抗生素,通过竞争叶绿体、线粒体中的核糖体与延长因子EF2的结合位点,破坏核糖体的功能、抑制蛋白质的合成,从而使敏感组织褐化死亡。不同物种对潮霉素的耐受性存在一定差异[19]:李瑞美等[20]发现50 mg/L潮霉素为果蔗胚性愈伤组织遗传转化筛选的最佳浓度,姚丽等[21]发现潮霉素浓度30 mg/L为甘蔗遗传转化时芽分化阶段的最佳筛选浓度,孙靖等[22]估测潮霉素琼脂处理筛选转基因小立碗藓的最适浓度为60 mg/L。本研究选择了潮霉素作为转化植物的筛选剂,结果发现潮霉素浓度达到10 mg/L时褐角苔外植体不能正常生长,且开始褐化死亡。所以,潮霉素浓度为15 mg/L可作为最适筛选浓度。
农杆菌介导的遗传转化所受影响因素较多,包括植物材料类型、外植体的预处理方式、菌液OD值、共培养时间等[23, 24]。外植体经过预培养后可以促进细胞分裂,更容易整合外源基因,从而提高外源基因的遗传转化效率[25]。肖艳华等[26]以天绿香(Sauropus androgynus)进行农杆菌转化时发现,预培养2 d的外植体转化率最高。Ishizaki等[12]研究发现地钱预培养5-7 d为最佳转化条件。不同的菌液OD值对转移DNA(TDNA)进入植株内的效果有不同的影响。在沾化冬枣(Ziziphus jujuba Mill.)和薄壳山核桃(Carya illinoinensis)的遗传转化研究中发现,菌液OD600为0.8时的转化率最高[27, 28]。Duan等[29]对芍药(Paeonia lactiflora)遗传转化体系进行优化时发现,农杆菌菌液OD600为0.6时转化效果最好。可见不同物种在遗传转化过程中对预培养时间和菌液OD值的要求均有所不同。本研究中褐角苔预培养时间为4 d时转化效率最高,0 d时转化效率最低(可能是因为愈伤组织还未形成)。农杆菌菌液OD600为0.8时转化效率最高;当OD600低于0.8时转化效率低,可能是因为菌液浓度未达到而不能侵入愈伤组织;OD600高于0.8的转化效率同样也较低,可能是菌液浓度过高导致外植体死亡造成的。
董喜才等[30]研究表明AS浓度和外植体共培养时间对遗传转化效率至关重要,菌液中添加AS能够将农杆菌中TDNA片段成功插入到受体基因组中,显著诱导增强农杆菌的侵染活力。在向日葵(Helianthus annuus)[31]和地钱[12]的遗传转化共培养基中加入100 μmol/L AS最有利于转化率的提高。共培养是为了使附着在外植体伤口处的农杆菌不断繁殖,促进TDNA的转入从而提高转化率[32]。研究表明,共培养时间在2-4 d所得到的转化子最多[33, 34]。本研究发现,在装有预培养外植体的5 mL KNOP培养基中添加80 μL OD600为0.8的农杆菌和100 μmol/L AS时转化效率最高,这与Frangedakis等[35]的研究结果基本一致。当共培养时间低于3 d和高于3 d时转化率降低,这可能是由于培养时间过短或过长,导致农杆菌TDNA片段未成功插入到受体基因组中或在褐角苔外植体内过度增殖致使外植体死亡。
4 结论随着分子生物技术的发展,角苔植物在基因层面的研究越来越深入,农杆菌介导的遗传转化技术可为角苔植物的研究奠定基础。本研究通过农杆菌介导法建立了褐角苔的遗传转化体系,该体系稳定且遗传转化效率高。该体系的最优组合为外植体预培养4 d后转入含有80 μL OD600为0.8的农杆菌菌液和100 μmol/L AS的5 mL KNOP培养基中共培养3 d。通过潮霉素筛选、PCR、RTqPCR和GUS染色鉴定阳性转化子,极大地提高了阳性转化子的筛选效率。
| [1] |
MORRIS J L, PUTTICK M N, CLARK J W, et al. The timescale of early land plant evolution[J]. Proceedings of the National Academy of Sciences of the United States of America, 2018, 115(10): E2274-E2283. |
| [2] |
INITIATIVE O T P T. One thousand plant transcriptomes and the phylogenomics of green plants[J]. Nature, 2019, 574(7780): 679-685. DOI:10.1038/s41586-019-1693-2 |
| [3] |
LI F W, NISHIYAMA T, WALLER M, et al. Anthoceros genomes illuminate the origin of land plants and the unique biology of hornworts[J]. Nature Plants, 2020, 6(3): 259-272. DOI:10.1038/s41477-020-0618-2 |
| [4] |
FRANGEDAKIS E, SHIMAMURA M, VILLARREAL J C, et al. The hornworts: morphology, evolution and development[J]. The New Phytologist, 2021, 229(2): 735-754. DOI:10.1111/nph.16874 |
| [5] |
RENZAGLIA K S, VILLARREAL J C, PIATKOWSKI B T, et al. Hornwort stomata: architecture and fate shared with 400-million-year-old fossil plants without leaves[J]. Plant Physiology, 2017, 174(2): 788-797. DOI:10.1104/pp.17.00156 |
| [6] |
任永霞, 季静, 王罡, 等. 植物遗传转化方法概述[J]. 河北北方学院学报(自然科学版), 2005, 21(6): 38-42. |
| [7] |
康庆华. 植物遗传转化及其在亚麻中的应用[J]. 中国麻业科学, 2011, 33(6): 298-301. DOI:10.3969/j.issn.1671-3532.2011.06.008 |
| [8] |
DE CARVALHO TEIXEIRA YASSITEPE J E, DA SILVA V C H, HERNANDESLOPES J, et al. Maize transformation: from plant material to the release of genetically modified and edited varieties[J]. Frontiers in Plant Science, 2021, 12: 766702. DOI:10.3389/fpls.2021.766702 |
| [9] |
张慧颖, 王颖, 韩成贵. 转基因技术在中国主要粮食作物改良中的研究进展[J]. 农学学报, 2022, 12(10): 44-50. |
| [10] |
HWANG H H, YU M, LAI E M. Agrobacterium-mediated plant transformation: biology and applications[J]. The Arabidopsis Book, 2017, 15: e0186. DOI:10.1199/tab.0186 |
| [11] |
SCHAEFER D, ZRYD J P, KNIGHT C D, et al. Stable transformation of the moss Physcomitrella patens[J]. Molecular & General Genetics: MGG, 1991, 226(3): 418-424. |
| [12] |
ISHIZAKI K, CHIYODA S, YAMATO K T, et al. Agrobacterium-mediated transformation of the haploid liverwort Marchantia polymorpha L., an emerging model for plant biology[J]. Plant and Cell Physiology, 2008, 49(7): 1084-1091. DOI:10.1093/pcp/pcn085 |
| [13] |
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [14] |
陈思, 张从合, 王慧, 等. 农杆菌介导水稻遗传转化的影响因素及应用研究进展[J]. 现代农业科技, 2023(5): 1-4, 8. |
| [15] |
姚冉, 石美丽, 潘沈元, 等. 农杆菌介导的植物遗传转化研究进展[J]. 生物技术进展, 2011, 1(4): 260-265. |
| [16] |
吴水涵. 农杆菌介导的雪落樱瞬时遗传转化体系的初步构建[D]. 南京: 南京林业大学, 2023.
|
| [17] |
HOOD E E, CLAPHAM D H, EKBERG I, et al. TDNA presence and opine production in tumors of Picea abies (L.) Karst induced by Agrobacterium tumefaciens A281[J]. Plant Molecular Biology, 1990, 14(2): 111-117. DOI:10.1007/BF00018552 |
| [18] |
王晶莹. 地钱遗传转化体系的建立及芥子油苷代谢工程的初探[D]. 哈尔滨: 东北农业大学, 2019.
|
| [19] |
王坚, 李永玲, 刘炜. 潮霉素B在遗传转化中应用的研究进展[J]. 宁夏农林科技, 2017, 58(12): 36-43. |
| [20] |
李瑞美, 何炎森. 果蔗'拔地拉'植株再生与农杆菌介导的遗传转化研究[J]. 热带亚热带植物学报, 2009, 17(6): 567-570. |
| [21] |
姚丽, 吴才文, 曾千春. 甘蔗遗传转化中不同阶段潮霉素抗性筛选[J]. 中国糖料, 2010(2): 17-19. |
| [22] |
孙靖, 歩佳佳. 潮霉素对小立碗藓生长的影响[J]. 现代农业科技, 2012(2): 36, 39. |
| [23] |
CHEN K, HU K Q, XI F H, et al. High-efficient and transient transformation of moso bamboo (Phyllostachys edulis) and ma bamboo (Dendrocalamus latiflorus Munro)[J]. Journal of Plant Biology, 2023, 66(1): 75-86. |
| [24] |
QIN Y Q, WANG D, FU J X, et al. Agrobacterium rhizogenes-mediated hairy root transformation as an efficient system for gene function analysis in Litchi chinensis[J]. Plant Methods, 2021, 17(1): 103. |
| [25] |
李猷, 尹蕾, 唐凯悦, 等. 外植体预培养时间对番茄外源基因转化的影响[J]. 湖北农业科学, 2014, 53(17): 4208-4210. |
| [26] |
肖艳华, 曾幼玲, 兰海燕, 等. 农杆菌介导的天绿香遗传转化影响因素的研究[J]. 植物研究, 2008, 28(5): 564-567, 573. |
| [27] |
孟辉. 沾化冬枣基因工程改良的基础研究[D]. 济南: 山东大学, 2005.
|
| [28] |
谢晓婷, 黄巧宇, 温广超, 等. 非组培依赖的发根农杆菌介导的薄壳山核桃转化体系构建[J]. 果树学报, 2022, 39(1): 131-140. |
| [29] |
DUAN S Y, XIN R J, GUAN S X, et al. Optimization of callus induction and proliferation of Paeonia lactiflora Pall. and Agrobacterium-mediated genetic transformation[J]. Frontiers in Plant Science, 2022, 13: 996690. |
| [30] |
董喜才, 杜建中, 王安乐, 等. 乙酰丁香酮在植物转基因研究中的作用[J]. 中国农学通报, 2011, 27(5): 292-299. |
| [31] |
郝彦玲, 朱本忠, 朱鸿亮, 等. 根癌农杆菌介导的向日葵遗传转化体系的建立[J]. 农业生物技术学报, 2005, 13(6): 713-717. |
| [32] |
NAKANO M, OTANI M. Plant regeneration and Agrobacterium-mediated genetic transformation systems in liliaceous ornamental plants[J]. Plant Biotechnology, 2020, 37(2): 129-140. |
| [33] |
ZHANG P Y, XU B, WANG Y Z, et al. Agrobacterium tumefaciens-mediated transformation as a tool for insertional mutagenesis in the fungus Penicillium marneffei[J]. Mycological Research, 2008, 112(Pt 8): 943-949. |
| [34] |
SØRENSEN L Q, LYSØE E, LARSEN J E, et al. Genetic transformation of Fusarium avenaceum by Agrobacterium tumefaciens mediated transformation and the development of a USERBrick vector construction system[J]. BMC Molecular Biology, 2014, 15: 15. |
| [35] |
FRANGEDAKIS E, WALLER M, NISHIYAMA T, et al. An Agrobacterium-mediated stable transformation technique for the hornwort model Anthoceros agrestis[J]. The New Phytologist, 2021, 232(3): 1488-1505. |



