2. 广西柏湾农牧有限公司,广西南宁 530201
2. Guangxi Baiwan Agriculture and Animal Husbandry Co., Ltd., Nanning, Guangxi, 530201, China
氨氮是水体中的主要污染物之一,其来源包括农业排放、工业废水和生活污水等,对水体生态环境和人类健康造成严重影响。目前,对于氨氮废水的处理方法有物理化学法和生物法两类,其中物理化学法包括吸附法、膜分离法、吹脱法、离子交换法、化学沉淀法等[1]。生物法主要为微生物法,微生物脱氮是目前脱氮技术中的一种重要手段,具有脱氮彻底、易操作、经济安全等特点,其中硝化反硝化是处理含氨氮废水的有效方法[2]。通过筛选高耐氨氮菌株,可以有效提高脱氮效率,降低脱氮成本,对解决水体氨氮污染问题具有重要意义。
目前,国内外已有较多关于氨氮降解菌株筛选及其脱氮性能的研究。蒋慧慧等[3]从福建某水产养殖池底的污泥中筛选出氨氮降解菌株阿氏芽孢杆菌(Bacillus aryabhattai JN01),在氨氮初始浓度为200 mg/L时,该菌株对氨氮的降解率可达92.78%,并且具有良好的好氧反硝化特性。张国伟等[4]从北京南宫垃圾堆肥厂的垃圾渗滤液中筛选出具有氨氮降解能力的褐红篮状菌(Talaromyces pinophilus)菌株Z-5,当接种量为1.0%、氨氮初始浓度为100 mg/L、碳源为红糖、pH值为7时,该菌株对氨氮的去除率达到了94.75%。一些特定的微生物菌株在脱氮过程中具有较高的耐受性和脱氮效率。如向书迪[5]从水田土壤中筛选分离得到一株变形假单胞菌(Pseudomonas plecoglossicida Y-1),在温度仅为15 ℃且pH值高达12的条件下,该菌株仍能有效去除硝态氮;高雅娟等[6]从垃圾渗滤液中筛选出一株高效脱氮的铜绿假单胞菌(P.aeruginosa U1),在氨氮浓度为1 000 mg/L的培养基中,该菌对氨氮的去除率为76.73%;Wang等[7]从污泥混合物中筛选出一株高效脱氮的香茅假单胞菌(P.citronellolisaWXP-4),该细菌可以耐受硝态氮浓度为100-1 000 mg/L,最大氮去除率为32.05 mg/(L·h)。此外,从自然环境中筛选出的氨氮降解菌种类还有枯草芽孢杆菌(B.subtiliis)[8]、克雷伯氏菌属(Klebsiella)[9]、假单胞菌属(Pseudomonas)[10]、不动杆菌属(Acinetobacter)[11]等。然而,目前大部分已筛选到的氨氮降解菌株因生长缓慢、对高氨氮环境适应性差等原因,仍然无法满足实际应用。因此,高效脱氮菌株的筛选及其脱氮性能的探究仍有待深入。本研究拟从污水生化处理池水样中筛选耐高氨氮菌株,并探究不同环境因子对其生长和氨氮降解效率的影响,同时对其生长过程及培养基中化学需氧量(Chemical Oxygen Demand,COD)的变化进行动力学分析。
1 材料与方法 1.1 材料 1.1.1 样品实验所用污水样品取样于广西贵港市港北区港泰种猪场的污水生化处理池。
1.1.2 培养基异养硝化富集培养基:NH4Cl 0.5 g,CH3COONa 3.5 g,MgSO4·7H2O 0.05 g,K2HPO4 0.2 g,NaCl 0.12 g,MnSO4·7H2O 0.01 g,FeSO4·7H2O 0.01 g,蒸馏水1 000 mL,pH值为7。
异养硝化液体培养基:NH4Cl 0.382 g,CH3COONa 5.67 g,MgSO4·7H2O 0.05 g,K2HPO4 0.2 g,NaCl 0.12 g,MnSO4·7H2O 0.01 g,FeSO4·7H2O 0.01 g,蒸馏水1 000 mL,pH值为7。
异养硝化固体培养基:在异养硝化液体培养基的基础上添加琼脂粉20 g。
1.2 方法 1.2.1 菌株的驯化及分离纯化取回的污水样品立即进行富集培养:取200 μL污水悬浊液转接于50 mL异养硝化富集培养基,在30 ℃、200 r/min的条件下培养24 h,进行两次富集培养后将菌液依次接种于氨氮浓度分别为100、200、500、800、1 000 mg/L的异养硝化液体培养基中进行驯化。将驯化后的菌液稀释涂布于异养硝化固体平板,挑取单菌落进行多次划线分离。
1.2.2 菌株鉴定观察纯化后的菌株的菌落颜色和形态等特征,并参考《伯杰细菌鉴定手册(第八版)》[12]以及《常见细菌系统鉴定手册》[13]对菌株进行初步鉴定。
取纯化后的菌液送至生工生物工程(上海)股份有限公司进行16S rRNA序列鉴定,将测序结果与GenBank中已提交的16S rRNA序列进行核苷酸同源性比较,然后应用软件MEGA 7.0构建菌株系统发育树。
1.2.3 不同因素对菌株生长和氨氮降解效率的影响选取温度、初始pH值、摇床转速、接种量、初始氨氮浓度5个因素,探究不同因素对菌株生长情况和氨氮降解效率的影响。在初始条件为温度30 ℃、转速200 r/min、接种量1.0%(V/V)、pH值7、初始氨氮浓度200 mg/L的基础上,温度梯度设置为10、20、30、37、40 ℃,摇床转速梯度设置为80、120、160、200、240 r/min,接种量梯度设置为0.5%、1.0%、1.5%、2.0%、2.5%(V/V),初始pH值梯度设置为5、6、7、8、9,初始氨氮浓度梯度设置为200、500、1 000 mg/L。以初始条件作为对照组,根据不同的因素水平设置单一变量,将菌株接种于异养硝化液体培养基中,摇床振荡培养48 h后,取样检测培养液OD595值,采用靛酚蓝比色法[14]检测培养液氨氮浓度,并使用公式(1)计算菌株氨氮降解效率。
| $ \text { 氨氮降解效率 }=\left(A_1-A_2\right) / A_1 \times 100 \% \text {, } $ | (1) |
式中,A1表示空白培养基反应液在620 nm下的吸光度值,A2表示菌液上清反应液在620 nm下的吸光度值。
1.2.4 最适氨氮降解条件下菌株硝化反硝化能力的测定① 菌株氨氮降解能力测定
根据1.2.3节所得结果,将菌株接种于异养硝化液体培养基中,培养条件为温度30 ℃、转速200 r/min、接种量2.0%(V/V)、初始pH值8、初始氨氮浓度200 mg/L。培养48 h后取样检测培养液OD595值和氨氮浓度,并计算菌株氨氮的降解效率。
② 菌株亚硝态氮降解能力测定
将菌株按2.0%(V/V)接种量接种到10 mL初始亚硝态氮浓度为200 mg/L的亚硝酸盐异养反硝化液体培养基中(将异养硝化液体培养基中的NH4Cl替换为NaNO2),在30 ℃、200 r/min、pH值为8的条件下培养48 h,采用盐酸萘乙二胺分光光度法[15]测定培养液中亚硝酸盐浓度,按公式(2)计算菌株亚硝态氮的降解效率。
| $ \text { 亚硝态氮降解效率 }=\left(A_3-A_4\right) / A_3 \times 100 \% \text {, } $ | (2) |
式中,A3表示空白培养基反应液在540 nm下的吸光度值,A4表示菌液上清反应液在540 nm下的吸光度值。
③ 菌株硝态氮降解能力测定
将菌株按2.0%(V/V)接种量接种到10 mL初始硝态氮浓度为200 mg/L的硝酸盐异养反硝化液体培养基中(将异养硝化液体培养基中的NH4Cl替换为KNO3),在30 ℃、200 r/min、pH值为8的培养条件下培养48 h,采用分光光度法[16]测定菌液中硝酸盐浓度,按公式(3)计算菌株硝态氮的降解效率。
| $ \text { 硝态氮降解效率 }=\left(A_5-A_6\right) / A_5 \times 100 \% \text {, } $ | (3) |
式中,A5=A220(空白)-2A275(空白),A6=A220(菌液)-2A275(菌液)。其中,A220(空白)和A275(空白)表示空白培养基反应液分别在220和275 nm下的吸光度值,A220(菌液)和A275(菌液)表示菌液上清反应液分别在220和275 nm下的吸光度值。
1.2.5 菌株生长及COD变化动力学分析① 菌株生长动力学分析
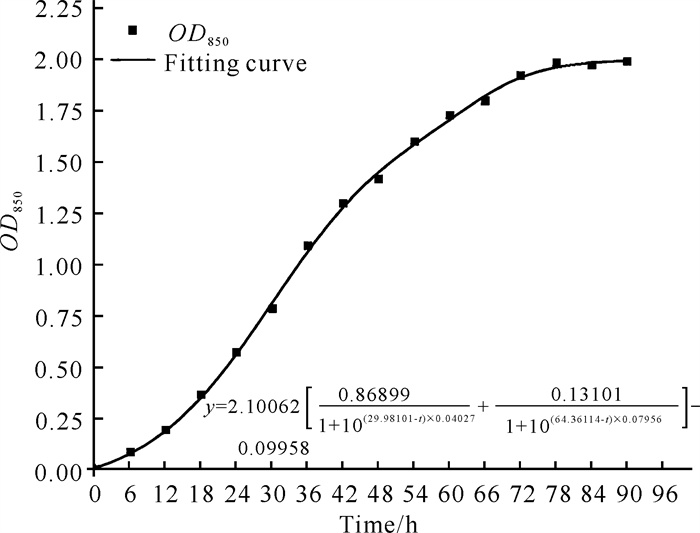
采用Biosan公司生长曲线测定仪器RTS1C,将菌株按2.0%(V/V)接种量接种到含15 mL异养硝化液体培养基的仪器配套反应器TubeSpin® Bioreactor中,在30 ℃、200 r/min培养条件下,每隔30 min检测1次OD850值,测定菌株的生长情况,绘制生长曲线,并采用公式(4)拟合菌株生长动力学曲线。
| $ O{D_{850}} = - 0.100 + 2.100 \times [0.869/(1 + {10^{(29.981 - t) \times 0.040}}) + 0.131/(1 + {10^{(64.361 - t) \times 0.080}})], $ | (4) |
式中,t表示菌液的培养时间。
② 菌株COD变化动力学分析
将菌株按2.0%(V/V)接种量接种到100 mL异养硝化液体培养基中,30 ℃、200 r/min培养条件下,每隔6 h取一次样,采用快速消解分光光度法[17]测定样品COD值,绘制样品COD变化曲线,采用公式(5)拟合COD变化曲线并进行动力学分析。
| $ \begin{gathered} \operatorname{COD}(\mathrm{mg} / \mathrm{L})=-232722.865+ 233594.502 \mathrm{e}^{(-t / 73603.936)}+460.607 \mathrm{e}^{(-t / 32.183)} \end{gathered} $ | (5) |
菌株YQ1菌落表面光滑、呈乳白色、不透明,直径约2 mm。根据图 1的系统发育树分析鉴定结果,菌株YQ1为琼氏不动杆菌(Acinetobacter junii)。
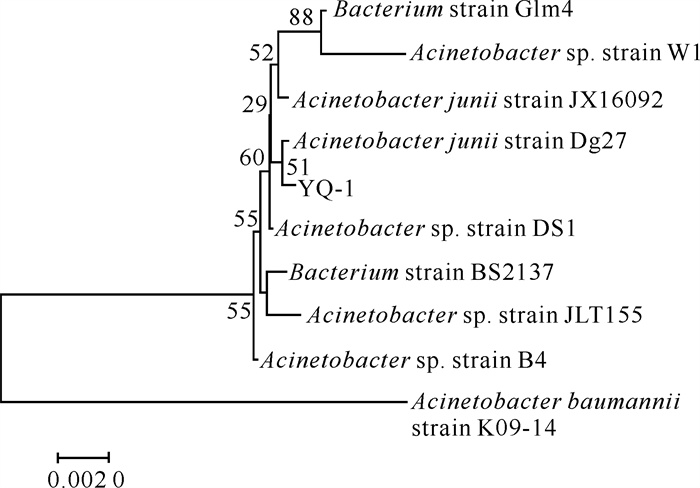
|
| 图 1 菌株YQ-1的系统发育树 Fig. 1 Phylogenetic tree of strain YQ-1 |
2.2 不同因素下菌株生长及氨氮降解效率 2.2.1 温度对菌株生长及氨氮降解效率的影响
如图 2所示,菌株YQ-1在10 ℃几乎不生长,OD595为0.365,氨氮降解效率仅7.98%。随着温度升高, 菌株YQ-1生长和氨氮降解效率均呈现先上升后下降趋势,在温度为30和37 ℃条件下生长旺盛,有较好的降解效率。最适生长温度为37 ℃,OD595为0.712,降解效率为68.86%,且在温度为30和37 ℃条件下,菌株生长OD595数值相差不大。依据现实温度情况,取其最适生长温度为30 ℃。但随着温度升高到40 ℃,菌株YQ-1的生长和氨氮降解效率下降,说明过高温度对菌株生长和氨氮降解有抑制作用。
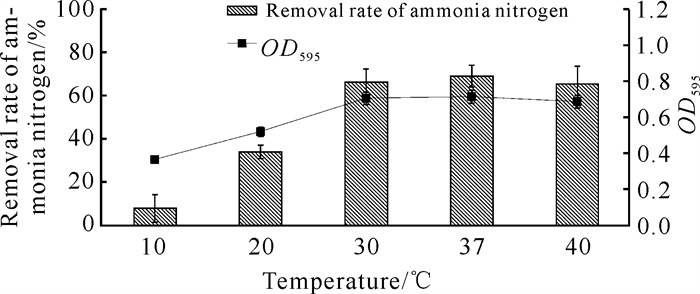
|
| 图 2 温度对菌株YQ-1生长和氨氮降解效率的影响 Fig. 2 Effects of temperature on the growth and ammonia nitrogen removal efficiency of strain YQ-1 |
2.2.2 接种量对菌株生长及氨氮降解效率的影响
如图 3所示,菌株YQ-1在接种量从0.5%上升到2.0%过程中,氨氮降解效率逐渐增大,当接种量为2.0%(V/V)时,菌株生长最好,OD595达到0.936,氨氮降解效率最高,达到82.64%。当接种量达到2.5%时,菌株OD595为0.891,氨氮降解效率为74.72%,均出现下降趋势。
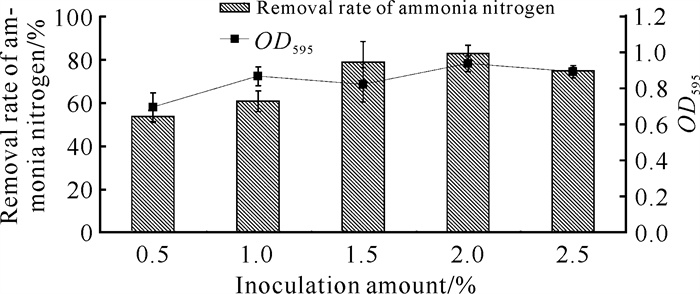
|
| 图 3 接种量对菌株YQ-1生长和氨氮降解效率的影响 Fig. 3 Effects of inoculum amount on the growth and ammonia nitrogen removal efficiency of strain YQ-1 |
2.2.3 转速对菌株生长及氨氮降解效率的影响
由图 4可知,菌株YQ-1在摇床转速为80 r/min时的OD595值最小,仅为0.292,氨氮降解速率为44.00%,原因可能是溶氧不足导致菌株生长受限。随着转速的提高,OD595总体呈增大趋势,并在200 r/min达到最大, 为1.125,此时氨氮降解效率为89.43%,这与不动杆菌Acinetobacter sp.YN3[11]生长最适转速相同。然而,随着转速的继续增加,菌株YQ-1的生长情况和降解效率均降低,但变化不大,可能是在200 r/min左右时已达到临界饱和氧浓度。
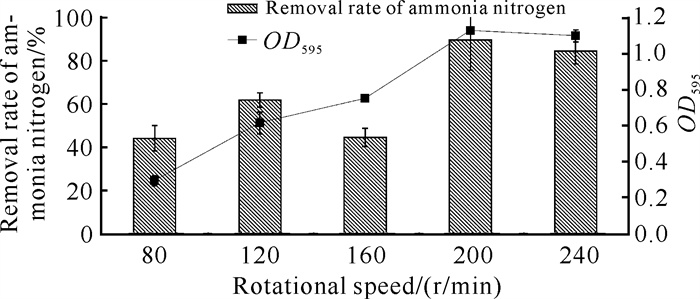
|
| 图 4 转速对菌株YQ-1生长和氨氮降解效率的影响 Fig. 4 Effects of rotation speed on the growth and ammonia nitrogen removal efficiency of strain YQ-1 |
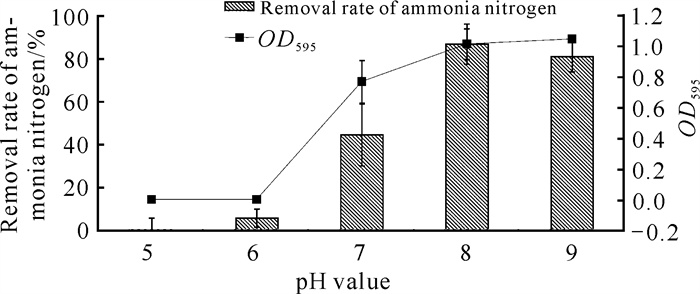
2.2.4 pH值对菌株生长及氨氮降解效率的影响
由图 5可知,菌株YQ-1对酸性环境的耐受性较差,在pH值为5-6条件下几乎不生长,当pH值逐渐变为中性时,菌株YQ-1的生长和氨氮降解效率才逐渐提高。菌株YQ-1对碱性环境有着较强的耐受性,在pH值为9时OD595最大,为1.042;在pH值为8时氨氮降解率最高,为89.43%。
|
| 图 5 pH值对菌株YQ-1生长和氨氮降解效率的影响 Fig. 5 Effects of pH value on the growth and ammonia nitrogen removal efficiency of strain YQ-1 |
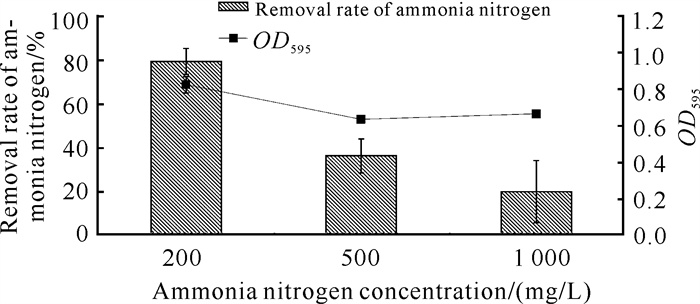
2.2.5 氨氮浓度对菌株生长及氨氮降解效率的影响
由图 6可知,在低浓度的氨氮条件下菌株YQ-1的氨氮降解能力较强。随着氨氮浓度的增加,菌株YQ-1的生长情况和氨氮降解效率均呈下降趋势。当氨氮浓度为200 mg/L时,菌株YQ-1的OD595为0.821,氨氮降解效率为79.07%;当氨氮浓度为1 000 mg/L时,菌株YQ-1的OD595降至0.662,氨氮降解效率为19.90%,但其氨氮降解的绝对浓度并无明显变化,表明菌株YQ-1可耐受高氨氮浓度,可用于高氨氮浓度废水脱氮。
|
| 图 6 氨氮浓度对菌株YQ-1生长和氨氮降解效率的影响 Fig. 6 Effects of ammonia nitrogen concentration on the growth and ammonia nitrogen removal efficiency of strain YQ-1 |
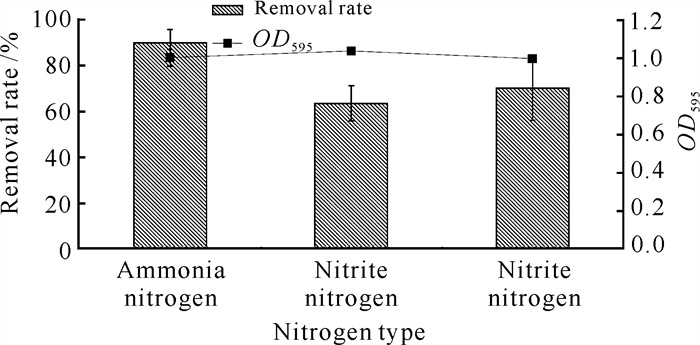
2.3 最适降解条件下菌株硝化反硝化能力的测定
根据单因素优化的结果,将菌株YQ-1按2.0%(V/V)接种量分别接种于异养硝化液体培养基、以亚硝酸钠和硝酸钾为唯一氮源的异养反硝化液体培养基中,置于温度为30 ℃、摇床转速为200 r/min、初始pH值设置为8,初始氨氮、硝态氮和亚硝态氮浓度均设置为200 mg/L条件下培养48 h。结果显示,菌株YQ-1在异养硝化液体培养基中OD595为0.999,氨氮降解效率达89.73%;菌株YQ-1亚硝态氮和硝态氮降解效率分别达到63.51%和70.19%,降解速率分别为2.75和2.79 mg/(L·h),有较好的反硝化能力(图 7)。
|
| 图 7 菌株YQ-1硝化反硝化能力的测定 Fig. 7 Nitrification-denitrification capability of strain YQ-1 |
2.4 菌株生长及COD变化动力学分析结果
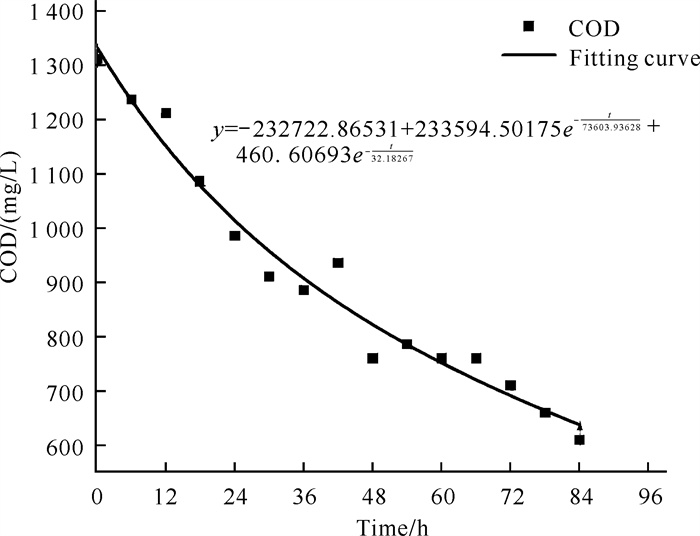
如图 8和图 9所示,菌株YQ-1经6 h延滞期后迅速生长,与之相应培养基中COD迅速下降,48 h后随着菌株YQ-1生长速率减慢,培养基中COD下降速率也逐渐减慢,约72 h后菌株YQ-1生长到达稳定期,最大OD850为1.988,此时培养基中的COD变化也趋于稳定,约为711.25 mg/L。分别采用软件Origin中的BidoseResp模型和ExpDec2模型模拟菌株YQ-1的生长及培养基中COD变化动力学分析情况,拟合结果R2分别大于0.999和0.970。说明这两种模型适用于模拟菌株YQ-1的生长情况和培养基中COD变化情况。
|
| 图 8 菌株YQ-1生长曲线 Fig. 8 Growth curve of strain YQ-1 |
|
| 图 9 菌株YQ-1培养液COD变化曲线 Fig. 9 Trend of COD in the culture medium of strain YQ-1 |
3 讨论 3.1 温度
温度是影响生物脱氮的一个重要因素,Rodriguez-caballero等[18]的研究表明低温能减缓或抑制硝化细菌的生长和功能,这可能导致硝化过程受到抑制,从而使得氨氮降解效率下降。于雪等[19]的研究表明当温度过高时,微生物体内对温度敏感的细胞组分会发生变性,并使其生长停止,甚至最终死亡,同时也会使其氨氮降解效率降低。菌株YQ-1在温度低于30 ℃和高于37 ℃时,氨氮降解效率均呈下降趋势,与上述研究结果相同。菌株YQ-1的最适降解温度为30-37 ℃,与不动杆菌(Acinetobacter sp. XJ-1)[20]、枯草芽孢杆菌(B.subtilis ZF23)[21]和皱褶念珠菌(Diutina rugosa DW-1)[22]最适生长温度相似。
3.2 接种量接种量过大或过小,都会影响菌株的氨氮降解效果。接种量过大会造成溶氧不足,影响产物的合成,随之产生更多代谢中间产物,不利于菌株生长;过小会延长培养时间,影响氨氮降解速率[20]。菌株YQ-1的最适接种量为2.0%(V/V),与不动杆菌(Acinetobacter sp.L-1)[23]最适接种量相同,此时菌株YQ-1的氨氮降解效率达到82.64%。在一定的范围内,增加接种量可以缩短菌株生长的延滞期,使菌株快速进入对数生长期,但由于培养基中的营养物质有限,继续增加接种量反而会影响微生物的生长速度。
3.3 溶解氧溶解氧是氨氧化过程中的重要因素,是好氧微生物进行硝化反应的重要电子受体,对微生物生长和氨氧化效率具有重要影响。不同的脱氮菌株具有不同的最佳溶解氧浓度,一旦偏离最佳溶解氧浓度,菌株的生长繁殖和脱氮性能将会受到抑制。在未达饱和情况下,溶氧量越大,微生物对氨氮的利用率越高[24]。Baumann[25]的研究表明强烈的曝气更有利于不动杆菌的生长,与之相符的,随着转速的提高,菌株YQ-1的生长和氨氮降解效率均增加,当转速为200 r/min时达到最大值。但是随着转速继续增加,菌株YQ-1的生长和氨氮降解效率呈现下降趋势,说明溶解氧浓度可能已经超过菌株YQ-1的最佳溶解氧浓度。
3.4 pH值pH值会影响细胞膜的渗透性、有机物的电离程度和微生物酶的活性[26]。菌株YQ-1对酸性环境的耐受性较差,pH值在6以下几乎不生长,但在中性和弱碱性条件下生长较好,最适pH值为8,与Duan等[27]发现的菌株Vibrio diabolicus SF16的最佳pH值为7.5-9.5和白洁等[28]发现的Zobellella sp.B307最适pH值为9的研究结果类似,可能原因是在中性和弱碱性条件下,游离的NH4+有利于微生物的硝化作用[29]。
3.5 氨氮氮是所有生物体的重要组成部分,大多数生物体依靠生物利用度更高的氮形式(如铵和硝酸盐)来生长[30]。胡锦刚等[31]和夏远舰等[32]的研究结果表明,高浓度氨氮会抑制菌株的生长速率和脱氮效率。与上述研究结果相符,随着初始氨氮浓度的提高,YQ-1的生长受到抑制,但其在初始氨氮浓度为1 000 mg/L时仍有较好的生长状况,OD595为0.662,且氨氮降解效率为19.90%,降解氨氮的绝对浓度未发生明显变化,说明其在高浓度氨氮条件下仍有较好的降解性能,在处理高浓度氨氮废水上具有一定的应用价值与潜力。
异养硝化-好氧反硝化菌的发现解决了传统脱氮过程中自养硝化过程和厌氧反硝化过程分离的问题,显著降低了废水脱氮处理成本,提升了脱氮效率,为污水生物脱氮提供了新思路[33]。菌株YQ-1在初始氨氮浓度为200 mg/L的条件下,在48 h内氨氮降解率达到89.73%,高于菌株Klebsiella quasipneumoniae subsp.quasipneumoniae HY3-2[34]、Talaromyces pinophilus Z-5[4]和Talaromyces pinophilus BZ-95[35]的降解效率,具有高效降解氨氮的能力。在亚硝态氮和硝态氮浓度均为200 mg/L的条件下,菌株YQ-1亚硝态氮和硝态氮降解率分别达到63.51%和70.19%,降解速率分别为2.75和2.79 mg/(L·h),远高于菌株Pseudomonas veronii DH3[36]的硝态氮降解速率[0.95 mg/(L·h)],以及菌株Burkholderia sp.ZH8[37]的亚硝态氮降解速率[0.78 mg/(L·h)],具有良好的异养硝化-好氧反硝化性能。
4 结论本研究从养猪场废水中分离出1株异养硝化好氧反硝化菌,命名为YQ-1,依据菌株16S rRNA基因序列比对结果构建系统发育树,鉴定该菌株为琼氏不动杆菌(Acinetobacter junii)。对菌株YQ-1氨氮降解条件进行单因素优化后,结果表明,当温度为30 ℃、摇床转速为200 r/min、初始pH值为8、接种量为2.0%(V/V),培养时间为48 h时,菌株YQ-1脱氮效果最好,当初始氨氮浓度、亚硝态氮和硝态氮浓度均为200 mg/L时,菌株YQ-1在48 h时对这3种形式的氮素降解率分别达到89.73%、63.51%和70.19%,且当氨氮浓度1 000 mg/L时,菌株YQ-1仍有较好的生长情况。对菌株YQ-1生长情况及COD变化情况进行动力学分析,结果表明,菌株YQ-1经6 h延滞期后迅速生长,约72 h后到达稳定期,且培养基中COD的减少速率与菌株YQ-1的生长速率呈正相关关系。
| [1] |
韩晓宇, 黄伟, 陈默, 等. 污水中的氨氮去除研究进展[J]. 材料导报, 2023, 37(S1): 99-102. |
| [2] |
赵翠娟, 宋文军, 朱高雄, 等. 除氨氮菌在污水处理中的研究进展[J]. 生物技术通报, 2013(2): 31-34. |
| [3] |
蒋慧慧, 王强, 付维来, 等. 一株异养硝化-好氧反硝化细菌的筛选及氮转化特性研究[J]. 生物技术通报, 2023, 39(12): 250-260. |
| [4] |
张国伟, 靳静晨, 李晨晨, 等. 氨氮降解菌株的筛选及降解性能研究[J]. 生物技术进展, 2022, 12(5): 746-753. |
| [5] |
向书迪. 耐冷好氧反硝化菌Pseudomonas plecoglossicida Y-1的特性及对不同氮源和生活污水脱氮特性研究[D]. 重庆: 西南大学, 2020.
|
| [6] |
高雅娟, 靳静晨, 高洁, 等. 耐高浓度氨氮的异养硝化好氧反硝化菌株U1的鉴定及其脱氮特性[J]. 微生物学通报, 2022, 49(7): 2442-2456. |
| [7] |
WANG X P, DUO Y K, HE J J, et al. A newly isolated and rapid denitrifier Pseudomonas citronellolis WXP-4:difference in N2O emissions under aerobic and anaerobic conditions[J]. Bioprocess and Biosystems Engineering, 2020, 43(5): 811-820. |
| [8] |
YU C H, WANG Y, GUO T, et al. Isolation and identification of ammonia nitrogen degradation strains from industrial wastewater[J]. Engineering, 2012, 4(11): 790-793. |
| [9] |
刘智慧, 赵佳男, 王雪, 等. 高效氨氮降解克雷伯菌筛选鉴定和适宜条件研究[J]. 黑龙江畜牧兽医, 2023(15): 64-71, 136. |
| [10] |
孙筱君, 沈琦, 吴逸飞, 等. 氨氮降解微生物的筛选和初步应用[J]. 浙江农业学报, 2020, 32(9): 1683-1691. |
| [11] |
杨垒, 陈宁, 任勇翔, 等. 异养硝化细菌Acinetobacter junii NP1的同步脱氮除磷特性及动力学分析[J]. 环境科学, 2019, 40(8): 3713-3721. |
| [12] |
布坎南 R E, 吉本斯 N E. 伯杰细菌鉴定手册[M]. 第八版. 中国科学院微生物研究所《伯杰细菌鉴定手册》翻译组译.北京: 科学出版社, 1984.
|
| [13] |
东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001.
|
| [14] |
郭文淼, 辛宇, 张金尧, 等. 全波长扫描式多功能读数仪-靛酚蓝比色法测定水样铵态氮含量[J]. 中国土壤与肥料, 2018(4): 166-170. |
| [15] |
中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准食品中亚硝酸盐与硝酸盐的测定: GB 5009.33-2016 [S]. 北京: 中国标准出版社, 2016.
|
| [16] |
丁香通. 水中硝酸盐氮测定实验[EB/OL]. (2024-1-27)[2024-1-27]. https://pro.biomart.cn/labweb/exp/316nrkago405u/316nrl4go45s0.html.
|
| [17] |
国家环境保护总局. 水质化学需氧量的测定快速消解分光光度法: HJ/T 399-2007 [S]. 北京: 中国环境科学出版社, 2008.
|
| [18] |
RODRIGUEZ-CABALLERO A, HALLIN S, PÅHLSON C, et al. Ammonia oxidizing bacterial community composition and process performance in wastewater treatment plants under low temperature conditions[J]. Water Science and Technology, 2012, 65(2): 197204. |
| [19] |
于雪, 孙洪伟, 李维维, 等. 温度对硝化杆菌(Nitrobacter)活性动力学影响[J]. 环境科学, 2019, 40(3): 1426-1430. |
| [20] |
阮明君, 钟梓杰, 余发杰, 等. 一株异养硝化细菌的分离鉴定及其在垃圾渗滤液中的应用[J]. 广东农业科学, 2022, 49(3): 68-76. |
| [21] |
陈猛, 李安章, 张明霞, 等. 一株异养硝化-好氧反硝化菌的分离鉴定及其对养殖废水中氮的去除特性[J]. 农业资源与环境学报, 2020, 37(2): 270-279. |
| [22] |
杜全能, 朱文娟, 兰时乐. 一株异养硝化好氧反硝化皱褶念珠菌(Diutina rugosa)的分离及脱氮特性[J]. 生物技术通报, 2020, 36(1): 60-65. |
| [23] |
利勇, 代群威, 王维富, 等. 一株异养硝化菌的筛选鉴定及其在农村养殖废水处理中的应用[J]. 广东农业科学, 2022, 49(12): 90-98. |
| [24] |
WEI B H, LUO X, MA W K, et al. Biological nitrogen removal and metabolic characteristics of a novel coldresistant heterotrophicnitrification and aerobic denitrification Rhizobium sp.WS7[J]. Bioresource Technology, 2022, 362: 127756. |
| [25] |
BAUMANN P. Isolation of Acinetobacter from soil and water[J]. Journal of Bacteriology, 1968, 96(1): 39-42. |
| [26] |
HU J, YAN J B, WU L, et al. Isolated heterotrophic nitrifying and aerobic denitrifying bacterium for treating actual refinery wastewater with low C/N ratio[J]. Journal of Bioscience and Bioengineering, 2021, 132(1): 41-48. |
| [27] |
DUAN J M, FANG H D, SU B, et al. Characterization of a halophilic heterotrophic nitrification-aerobic denitrification bacterium and its application on treatment of saline wastewater[J]. Bioresource Technology, 2015, 179: 421-428. |
| [28] |
白洁, 陈琳, 黄潇, 等. 1株耐盐异养硝化-好氧反硝化菌Zobellella sp.B307的分离及脱氮特性[J]. 环境科学, 2018, 39(10): 4793-4801. |
| [29] |
MéVEL G, PRIEUR D. Heterotrophic nitrification by a thermophilic Bacillus species as influenced by different culture conditions[J]. Canadian Journal of Microbiology, 2000, 46(5): 465-473. |
| [30] |
KUYPERS M M M, MARCHANT K H, KARTAL B. The microbial nitrogen-cycling network[J]. Nature Reviews Microbiology, 2018, 16: 263-276. |
| [31] |
胡锦刚, 肖春桥, 邓祥意, 等. 稀土浸矿场地土壤异养硝化-好氧反硝化菌株K3的分离及脱氮研究[J]. 稀土, 2021, 42(5): 1-12. |
| [32] |
夏远舰, 杨小丽, 李海华, 等. 异养硝化-好氧反硝化菌Acinetobacter johnsonii sp.N26的脱氮性能及代谢途径[J]. 微生物学通报, 2023, 50(4): 1374-1395. |
| [33] |
马咏琪, 台喜生, 王佳丽, 等. 极端水质条件下异养硝化-好氧反硝化微生物的研究进展[J]. 微生物学通报, 2024, 51(3): 743-757. |
| [34] |
杨静丹, 祝铭韩, 刘琳, 等. 异养硝化-好氧反硝化菌HY3-2的分离及脱氮特性[J]. 中国环境科学, 2020, 40(1): 294-304. |
| [35] |
郑珂. 氨氮降解菌株的筛选及脱氮效果评价[D]. 泰安: 山东农业大学, 2023.
|
| [36] |
董怡华, 王凌潇, 任涵雪, 等. 一株耐低温异养硝化-好氧反硝化菌的分离鉴定及其脱氮特性[J]. 生物技术通报, 2023, 39(12): 237-249. |
| [37] |
李艳丽, 杨垒, 张志昊, 等. 好氧反硝化细菌Burkholderia sp. ZH8的脱氮特性与生物强化作用研究[J/OL]. 中国环境科学: 1-11[2024-04-02]. https://doi.org/10.19674/j.cnki.issn10006923.20240015.003.
|



