2. 广西壮族自治区药用植物园, 广西道地药材高品质形成与应用重点实验室, 广西南宁 530023
2. Guangxi Key Laboratory of High-Quality Formation and Utilization of Dao-di Herbs of Guangxi Zhuang Autonomous Region, Guangxi Botanical Garden of Medicinal Plants, Nanning, Guangxi, 530023, China
土茯苓是《中华人民共和国药典(一部)》(2020年版)[1]收载的中药材,为百合科(Liliaceae)菝葜属(Smilax)植物光叶菝葜(S.glabra)的干燥根茎,是我国传统常用中药,具有调中止泻、强筋骨、健脾胃等功效[2-4],其根状茎富含淀粉。近年来,土茯苓作为养生材料常被用于制作糕点、酿酒、煲汤等[5, 6]。目前,土茯苓药材大多来源于野生资源[4],随着社会对传统中医药的关注日渐上升,人们对健康养生的需求不断提高,土茯苓开始被大规模种植,育苗规模也在扩大,然而病害常有发生,其中叶部病害呈逐渐上升趋势。本课题组前期在广西钦州市久隆镇土茯苓育苗基地发现了一种叶部新病害,该病初期形成针尖大小病斑,随着病情的发展,病斑逐渐扩大,严重时会造成整个植株的叶片枯死,发病率可达15%-30%,导致土茯苓育苗产量降低,影响土茯苓育苗产业发展。目前,土茯苓的研究主要集中在种苗生长繁育[7-9]和药理药化研究上[10-12],而对其病害研究尚属空白,因此,对土茯苓苗期叶部病害的病原菌进行形态和分子生物学鉴定,并测定其生物学特性及筛选防治药剂,对病害的有效防控具有重要意义。为此,本研究通过常规组织分离法对土茯苓苗期炭疽病病原菌进行分离纯化和致病性测定,再结合形态和多基因序列分析确定病原菌的分类地位,测定其生物学特性,并研究4种杀菌剂对致病菌的室内抑制活性,可为土茯苓苗期的田间防治提供理论依据。
1 材料与方法 1.1 材料于2022年9月在广西钦州市钦南区久隆镇钦州市春晖农业有限公司育苗基地采集土茯苓病叶,气温约35 ℃,湿度约70%。供试培养基有马铃薯葡萄糖琼脂培养基(PDA):马铃薯200 g、葡萄糖15 g、琼脂15-20 g、蒸馏水1 L;马铃薯蔗糖培养基(PSA):马铃薯200 g、蔗糖20 g、琼脂17 g、蒸馏水1 L;燕麦粉琼脂培养基(OMA):燕麦粉30 g、琼脂17 g、蒸馏水1 L;玉米粉培养基(CMA):玉米粉30 g、琼脂17 g、蒸馏水1 L;沙氏培养基(SDA):蛋白胨10 g、琼脂20 g、葡萄糖40 g、蒸馏水1 L;察氏培养基:NaNO3 2 g、K2HPO4 1 g、KCl 0.5 g、MgSO4·7H2O 0.5 g、FeSO4 0.01 g、蔗糖30 g、琼脂17 g、蒸馏水1 L。采用4种杀菌剂进行室内抑菌试验,分别为98%噁霉灵可溶粉剂(SP)、250 g/L丙环唑乳油(EC)、450 g/L咪鲜胺水分散粒剂(WG)、80%代森锰锌可湿性粉剂(WP),具体信息详见表 1。
| 杀菌剂/剂型 Fungicide/Dosage form |
稀释倍数 Dilution factor |
生产厂家 Manufacturer |
| 98% Hymexazol/Soluble Power (SP) | 500×,1 000×,2 000×,4 000×,8 000× | Tianjin Lüheng Chemical Co., Ltd. |
| 250 g/L Propiconazole/Emulsifiable Concentrate (EC) | 1 000×,2 000×,4 000×,8 000×,16 000× | Syngenta Crop Protection Co., Ltd. |
| 450 g/L Prochloraz/Water Dispersible Granule (WG) | 500×,1 000×,2 000×,4 000×,8 000×,16 000×,32 000× | Suzhou Fumeishi Plant Protection Agent Co., Ltd. |
| 80% Mancozeb/Wettable Power (WP) | 250×,300×,450×,500× | Limin Chemical Co., Ltd. |
1.2 方法 1.2.1 病原菌分离、纯化及保存
参考《植病研究方法》[13]中的常规组织分离法进行分离,取样品的病健交界处,剪取5 mm×5 mm大小的组织块,用75%乙醇消毒30 s,2.5%次氯酸钠消毒3 min,灭菌水清洗3遍,置于灭菌滤纸上晾干,然后转接到PDA上,于28 ℃培养,再经单孢纯化后,在PDA上培养5 d备用。
1.2.2 致病性测定采用离体试验对叶片进行致病性测定。选取健康土茯苓幼苗的叶片,先用自来水冲洗干净,晾干,再用75%乙醇进行表面消毒,于叶片正面中部对称的两边用灭菌过的接种针刺成伤口,在培养基上取直径为8 mm的菌块,菌丝朝向接种叶片伤口处,以空白PDA为对照,接种后的温度为28 ℃、湿度为70%,12 h光照12 h黑暗条件,每个菌株接种10张叶片,重复5次,拍照并记录叶片每天的发病情况。叶片发病后再次分离,并鉴定与接种用的菌株形态是否一致,完成柯赫法则。
1.2.3 病原菌鉴定参考方中达[13]的方法记录菌落形态,参考魏景超遗[14]的方法和国际分类网站(http://www.indexfungorum.org/)进行菌落形态初步鉴定。参考Kumar等[15]的方法,利用MEGA 7.0的邻位连接法构建ITS rDNA系统发育进化树,进行分子生物学鉴定。采用宝日医生物技术(北京)有限公司的试剂盒MightyAmp DNA Polymerase Ver.3 (1.25 U/50 μL,Takara Bio Inc.,Japan,cat.no.R076A)进行检测,选用核糖体DNA内部转录间隔区ITS(ITS1/5′-TCCGTAGGTGAACCTGCGG-3′、ITS4/5′-TCCTCCGCTTATTGATATGC-3′)[16]、肌动蛋白ACT(ACT-512F/5′- ATGTGCAAGGCCGGTTT-CGC-3′、ACT-783R/5′-TACGAGTCCTTCTGGCCCAT-3′)[17]、几丁质合成酶CHS(CHS-79F/5′-TGGGGCAAGGATGCTTGGAAGAAG-3′、CHS-354R/5′-TGGAAGAACCATCTGTGAGAG TTG-3′)[18]、β-微管蛋白TUB(T1/5′-AACATGCGTGAGATTGTAAGT-3′、Bt-2b/5′-ACCCTCAGTGTAGTGACCCTTGGC-3′)[18]、3-磷酸甘油醛脱氢酶GADPH(GDF1/5′-GCCGTCAACGACCCCTTCATTGA-3′、GDR1/5′-GGGTGGAGTCGTACTTGAGCATGT-3′)[19]进行PCR扩增与测序,挑取培养好的致病菌菌丝作为PCR反应的模板。PCR扩增反应体系如下:总体积为50 μL,其中2×MightyAmp Buffer 25 μL,10×Additive for High Specificity 5 μL,引物ITS1和ITS2(15 pmol)各1.5 μL,加ddH2O定容至50 μL。PCR反应条件如下:98 ℃预变性2 min;98 ℃变性10 s,60 ℃退火15 s,68 ℃延伸60 s,40个循环;最后68 ℃延伸10 min。空白对照为ddH2O。制备1.0%的琼脂糖凝胶电泳,用成像法检测目的条带,然后将PCR产物送至生工生物工程(上海)股份有限公司测序,并将测序结果与美国国家生物信息中心(NCBI)的GenBank序列进行比对。表 2为从NCBI下载的病原菌序列信息。
| 种名 Species |
菌株编号 Strain number |
登录号Login number | ||||
| ITS | GAPDH | ACT | CHS | TUB | ||
| Colletotrichum aenigma | ICMP18686T | JX010243 | JX009913 | JX009519 | JX009789 | JX010390 |
| C.alatae | ICMP17919T | JX010190 | JX009990 | JX009471 | JX009837 | JX010383 |
| C.alatae | CBS304.67 | JX010191 | JX010011 | JX009470 | JX009846 | JX010449 |
| C.alienum | ICMP18691 | JX010217 | JX010018 | JX009580 | JX009754 | JX010385 |
| C.alienum | ICMP18621 | JX010246 | JX009959 | JX009552 | JX009755 | JX010386 |
| C.aotearoa | ICMP18532 | JX010220 | JX009906 | JX009544 | JX009764 | JX010421 |
| C.ti | ICMP5285 | JX010267 | JX009910 | JX009553 | JX009897 | JX010441 |
| C.ti | ICMP4832T | JX010269 | JX009952 | JX009520 | JX009898 | JX010442 |
| C.tropicale | ICMP18672 | JX010275 | JX010020 | JX009480 | JX009826 | JX010396 |
| C.tropicale | CBS124949T | JX010264 | JX010007 | JX009489 | JX009870 | JX010407 |
| C.xanthorrhoeae | BRIP45094T | JX010261 | JX009927 | JX009478 | JX009823 | JX010448 |
| C.kahawae | ICMP17816T | JX010231 | JX010012 | JX009452 | JX009813 | JX010444 |
| C.kahawae | CBS982.69 | JX010234 | JX010040 | JX009474 | JX009829 | JX010435 |
| C.asianum | ICMP18696 | JX010192 | JX009915 | JX009576 | JX009753 | JX010384 |
| C.asianum | BPDI4 | FJ972612 | JX010053 | JX009584 | JX009867 | JX010406 |
| C.clidemiae | ICMP18706 | JX010274 | JX009909 | JX009476 | JX009777 | JX010439 |
| C.clidemiae | ICMP18658T | JX010265 | JX009989 | JX009537 | JX009877 | JX010438 |
| C.cordylinicola | ICMP18579 | JX010226 | JX009975 | HM470235 | JX009864 | JX010440 |
| C.fructicola | ICMP18581 | JX010165 | JX010033 | FJ907426 | JX009866 | JX010405 |
| C.fructicola | CBS125397 | JX010173 | JX010032 | JX009581 | JX009874 | JX010409 |
| C.gloeosporioides | ICMP17821 | JX010152 | JX010056 | JX009531 | JX009818 | JX010445 |
| C.gloeosporioides | CBS273.51 | JX010148 | JX010054 | JX009558 | JX009903 | KC566143 |
| C.horii | C1069.2 | GQ329687 | GQ329685 | JX009533 | JX009748 | JX010375 |
| C.horii | ICMP17968 | JX010212 | GQ329682 | JX009547 | JX009811 | JX010378 |
| C.musae | ICMP17817 | JX010142 | JX010015 | JX009432 | JX009815 | JX010395 |
| C.musae | CBS116870T | JX010146 | JX010050 | JX009433 | JX009896 | HQ596280 |
| C.nupharicola | CBS469.96 | JX010189 | JX009936 | JX009486 | JX009834 | JX010397 |
| C.nupharicola | CBS470.96 | JX010187 | JX009972 | JX009437 | JX009835 | JX010398 |
| C.psidii | CBS145.29 | JX010219 | JX009967 | JX009515 | JX009901 | JX010443 |
| C.queenslandicum | ICMP1778T | JX010276 | JX009934 | JX009447 | JX009899 | JX010414 |
| C.salsolae | ICMP19051T | JX010242 | JX009916 | JX009562 | JX009863 | JX010403 |
| C.salsolae | CBS119296 | JX010241 | JX009917 | JX009559 | JX009791 | JX010403 |
| C.siamense | ICMP12567 | JX010250 | JX009940 | JX009541 | JX009761 | JX010387 |
| C.siamense | CBS125378 | JX010278 | JX010019 | GQ856775 | GQ856730 | JX010410 |
| C.theobromicola | ICMP18566 | JX010282 | JX009953 | JX009496 | JX009801 | JX010376 |
| C.theobromicola | CBS124945T | NR111512 | JX010006 | JX009516 | JX009830 | JX010373 |
| Note: T denoted ex-type. | ||||||
1.2.4 病原菌的生物学特性
选用土茯苓炭疽病病原菌进行生物学特性试验,设置培养基、温度、光照、pH值、碳源和氮源等6个变量,培养10 d后,用6 mm打孔器取3个菌饼,加入1 mL无菌水充分振荡混匀后,用血球计数板法测定产孢量[13]。
(1) 培养基对病原菌菌丝生长的影响
选取PDA、PSA、OMA、CMA和SDA等5种不同的培养基,将病原菌分别接种于这5种培养基的中央,每皿放置1个菌饼,每个处理设置3次重复,28 ℃恒温培养箱培养5 d,用十字交叉法测量菌落直径,确定病原菌生长的最适培养基。10 d后用血球计数板法测定产孢量,以确定菌丝产孢的最适培养基。
(2) 温度对病原菌菌丝生长的影响
分别在5、10、15、20、25、28、30、35、40 ℃的恒温培养箱中进行黑暗培养,每个处理设置3次重复,每日观察,用十字交叉法测量菌落大小,得出菌丝生长的最适温度,10 d后用血球计数板法测定产孢量,以确定菌丝产孢的最适温度。
(3) 致死温度对病原菌菌丝生长的影响
首先将2 mL装有无菌水的离心管分别置于35、45、55 ℃恒温水浴锅中预热;然后选取培养5 d的病原菌,取直径6 mm的菌饼置入无菌离心管中水浴处理20 min,取出后立即用冷水冷却至室温;最后将处理后的菌饼置于PDA中,每个处理设置3次重复,28 ℃恒温下培养,观察菌丝的生长情况。
(4) pH值对病原菌菌丝生长的影响
用浓度为1 mol·L-1的HCl溶液和1 mol·L-1的NaOH溶液配制pH值分别为2、3、4、5、6、7、8、9、10的PDA,将直径为6 mm的菌饼置于各培养皿的中央,每个处理设置3次重复,28 ℃恒温暗培养5 d,10 d后用血球计数板法测定产孢量,以确定菌丝产孢的最适pH值。
(5) 光照对病原菌菌丝生长的影响
光照培养箱条件分别设置为24 h光照/d、24 h黑暗/d、(12 h光照和12 h黑暗)/d 3种,光照强度为2 000 lux,温度为恒温28 ℃。将病原菌菌饼的菌丝面朝下置于PDA平板中央,分别置于3种光照的恒温培养箱中培养,每个处理设置3次重复,5 d后用十字交叉法测量菌落直径并计算菌落的平均生长速率,10 d后用血球计数板法测定产孢量,以确定菌丝产孢的最适光照。
(6) 碳源对病原菌菌丝生长的影响
以PDA为基础培养基,将2%添加量的葡萄糖替换为相同质量的蔗糖、葡萄糖、α-乳糖、麦芽糖、可溶性淀粉、甘露醇、肌醇作为碳源,每个培养皿放置1个菌饼,每个处理设置3次重复,28 ℃恒温培养5 d,10 d后用血球计数板法测定产孢量,以确定菌丝产孢的最适碳源。
(7) 氮源对病原菌菌丝生长的影响
以察氏培养基为基础培养基,将0.3%添加量的硝酸钠替换为相同质量的硝酸钠、硫酸铵、半胱氨酸、蛋白胨、硝酸钾作为氮源,每个处理设置3次重复,28 ℃恒温培养5 d,10 d后用血球计数板法测定产孢量,以确定菌丝产孢的最适氮源。
1.2.5 室内药剂筛选采用菌丝生长速率法对土茯苓幼苗叶片炭疽病病原菌进行室内药剂筛选。将病原菌接种到PDA上培养5 d后,将直径为6 mm的菌饼按照供试药剂设定的浓度比例加入至50 ℃左右的PDA中,混匀后倒入无菌培养皿中,制成含不同浓度药剂的平板(以不加供试药剂的PDA为空白对照),在28 ℃恒温培养箱中培养6 d,每个处理设置3次重复,用十字交叉法测量菌落直径,并计算抑菌率。菌丝生长抑菌率=[(对照菌落直径-菌饼直径)-(处理菌落直径-菌饼直径)]/(对照菌落直径-菌饼直径)×100%。供试半数效应浓度(EC50)的稀释倍数参照表 1。采用Excel 2019对数据进行统计分析,建立毒力方程y=a+bx,先把抑菌率换算为概率值,以x自变量为浓度的对数值,y为概率值,再用此方程求出EC50值。
1.2.6 数据处理数据统计处理采用SPSS 19.0进行单因素方差分析(One-way ANOVA),选用最小显著性差异(LSD)法和Duncan′s新复极差法进行组间多重比较,不同小写字母表示差异显著(P<0.05)。采用Origin 2018制图。
2 结果与分析 2.1 土茯苓苗期炭疽病的发病症状及致病性测定土茯苓苗期炭疽病主要发生在叶片,发病初期叶片上出现针尖小点,且周围有明显黄晕圈,病斑逐渐扩大至圆形或不规则形状,可侵染叶尖、叶缘和叶中部,病斑后期呈现棕褐色,病斑凹陷,严重时病斑连成片直至整个叶片枯死(图 1)。

|
| 图 1 土茯苓炭疽病症状 Fig. 1 Anthracnose symptoms of S.glabra |
从采集的5份病叶样品中分离出5株菌株,选取代表性菌株QTMJ3-1进行致病性测定和形态特征观察,测定结果见图 2。将菌株QTMJ3-1接种于健康的土茯苓幼苗期叶片上,48 h开始发病,叶片呈现灰褐色圆斑,与田间发病症状相似[图 2(a)],对照未见发病症状[图 2(b)]。其他4株菌株均未发病[图 2:(c)-(f)]。将发病的叶片再次分离,分离的菌株与接种病菌一致,由此验证柯赫法则,确定菌株QTMJ3-1为土茯苓炭疽病致病菌。

|
| (a) Symptom after inoculation; (b) CK; (c)-(f) The other 4 strains did not develop disease after inoculation. 图 2 土茯苓炭疽病病原菌致病性测定 Fig. 2 Pathogenicity test of anthracnose pathogen strainsin S.glabra |
2.2 土茯苓炭疽病病原菌鉴定 2.2.1 病原菌形态学特征
菌株QTMJ3-1的形态特征如图 3所示。将菌株QTMJ3-1于PDA上培养5 d,菌落初培养时为白色,菌丝呈细绒状[图 3(a)];5 d后菌落呈现灰色,后期会着生橘红色分生孢子堆,背面会产生黑色素[图 3(b)]。分生孢子为长椭圆形,两端钝圆,单胞,大小为(15.2-20.5) μm×(4.3-5.6) μm,含油球1-2个[图 3: (c)、(d)];分生孢子萌发可形成不规则形状的附着胞,深褐色,链状生长,大小为(4.6-7.1) μm×(5.3-9.0) μm[图 3: (e)、(f)]。

|
| (a) Colony on PDA; (b) Colony back; (c)-(d) Conidia; (e)-(f) Conidial appressoria. 图 3 菌株QTMJ3-1的形态特征 Fig. 3 Morphological characteristics of strain QTMJ3-1 |
2.2.2 病原菌的分子生物学鉴定
将菌株QTMJ3-1序列在NCBI上进行BLAST比对发现,该菌株与炭疽菌属(Colletotrichum)相似。通过下载相似模式菌株序列(表 2),用5种不同的基因序列(ITS、TUB、ACT、GAPDH和CHS)联合构建系统发育树,结果如图 4所示。菌株QTMJ3-1与草莓炭疽菌(C.theobromicola ICMP18566和C.theobromicola CBS124945)聚集在一个进化分支,支持率达到100%,其NCBI登录号分别为OR999396、PP026246、PP048613、PP048614、PP048612。结合形态学特征分析和系统发育树的分析结果,确定菌株QTMJ3-1为可可炭疽病菌(C.theobromicola)。
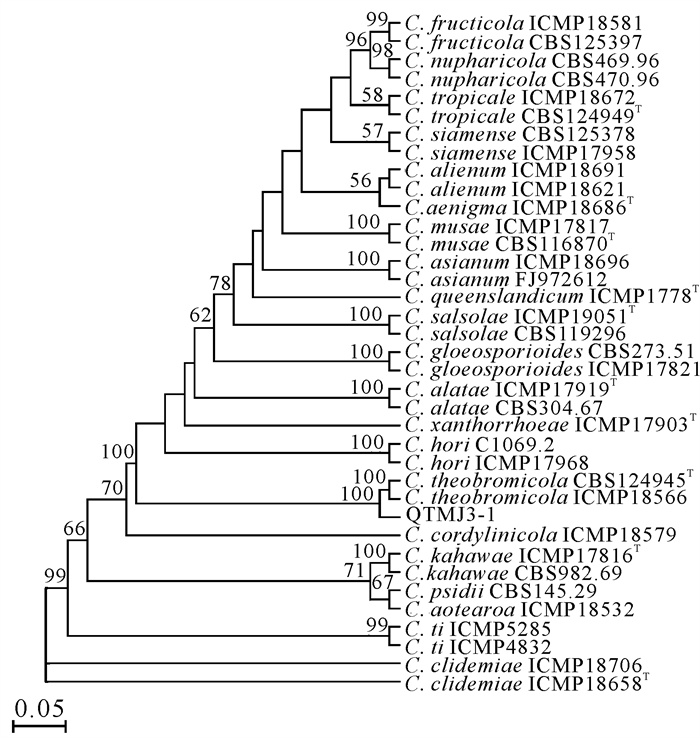
|
| The Number at each branch point represents percentage bootstrap support calculated from 1 000 replicates (less than 50% were not shown).T indicates ex-type specimen.Bar 0.05 expected changes per site. 图 4 基于ITS、TUB、ACT、GAPDH和CHS基因序列构建的菌株QTMJ3-1系统发育树 Fig. 4 Phylogenetic tree of strain QTMJ3-1 constructed based on ITS, TUB, ACT, GAPDH, and CHS gene sequences |
2.3 土茯苓炭疽病病原菌的生物学特性 2.3.1 培养基对病原菌菌丝生长及产孢的影响
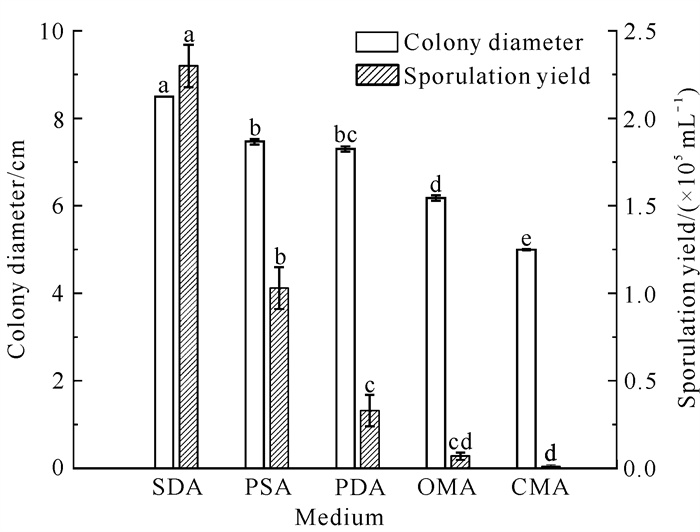
由图 5和图 6可知,菌株QTMJ3-1在5种培养基上均能生长,且差异显著(P<0.05),其中在沙氏培养基上生长最快,菌落直径达到8.50 cm;其次是马铃薯蔗糖培养基、马铃薯葡萄糖琼脂培养基,菌落直径分别为7.47、7.30 cm;最后依次是燕麦粉琼脂培养基和玉米粉培养基,菌落直径分别为6.18和5.00 cm,两者间具有显著性差异(P<0.05)。在5种培养基中,沙氏培养基最利于菌丝生长,也最利于产孢,产孢量达到2.3×105 mL-1,与其他培养基相比差异显著(P<0.05),产孢量大小依次为沙氏培养基、马铃薯蔗糖培养基、马铃薯葡萄糖琼脂培养基、燕麦粉琼脂培养基、玉米粉培养基。
|
| Different lowercase letters indicate significant differences (P < 0.05). 图 5 培养基对菌株QTMJ3-1菌丝生长和产孢的影响 Fig. 5 Effects of culture media on mycelial growth and sporulation of strain QTMJ3-1 |
|
| 图 6 培养基对菌株QTMJ3-1菌丝生长的影响 Fig. 6 Effect of culture media on the mycelial growth of strain QTMJ3-1 |
2.3.2 温度对病原菌菌丝生长及产孢的影响
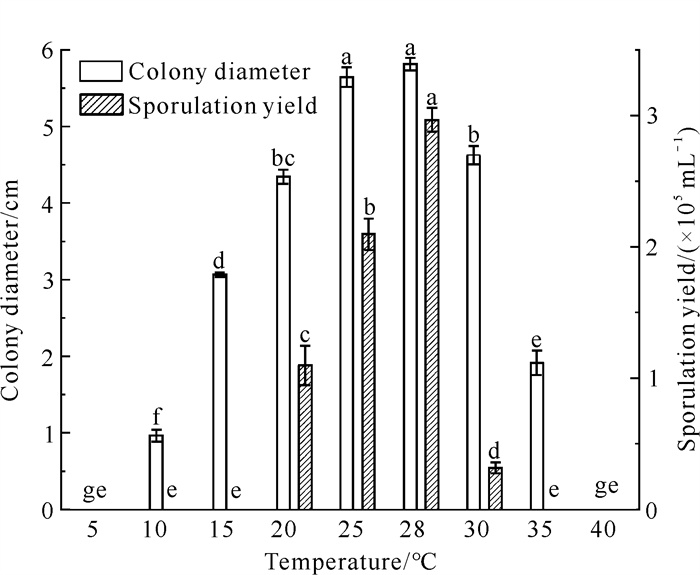
由图 7可知,菌株QTMJ3-1在10-35 ℃均可生长,菌丝随着温度的上升而逐渐生长,适宜温度为25-30 ℃。在较低(5 ℃)和较高(40 ℃)温度下菌丝均停止生长,在28 ℃下菌落直径最大,可达5.82 cm,与其他处理差异显著(P<0.05);当温度超过30 ℃时,菌株QTMJ3-1对温度较敏感。菌株QTMJ3-1在20-30 ℃时均可产孢,28 ℃时产孢量最大,为2.97×105 mL-1,与其他温度相比差异显著(P<0.05)。
|
| Different lowercase letters indicate significant differences (P < 0.05). 图 7 温度对菌株QTMJ3-1菌丝生长和产孢的影响 Fig. 7 Effects of temperatures on mycelial growth and sporulation of strain QTMJ3-1 |
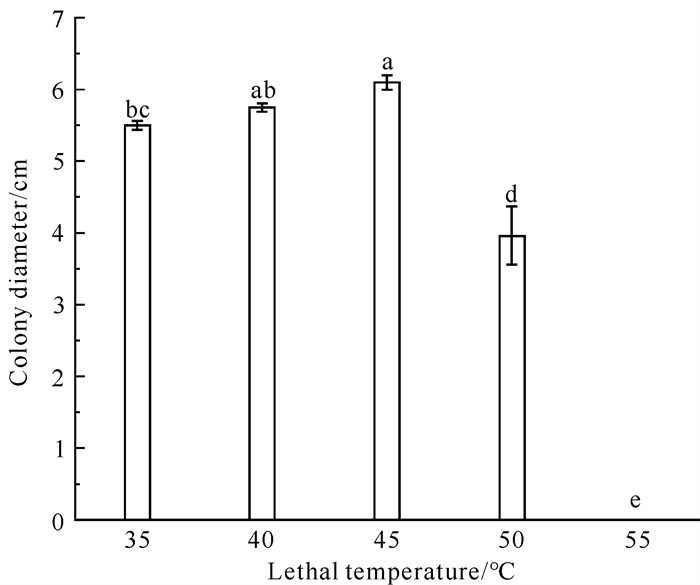
2.3.3 病原菌菌株的致死温度
菌株QTMJ3-1经不同温度处理20 min后菌丝可继续生长,当处理温度达到55 ℃后,菌丝停止生长,故菌株QTMJ3-1的致死温度为55 ℃(图 8)。
|
| Different lowercase letters indicate significant differences (P < 0.05). 图 8 菌株QTMJ3-1在不同温度处理下菌丝的生长情况 Fig. 8 Mycelial growth of strain QTMJ3-1 under different temperature treatments |
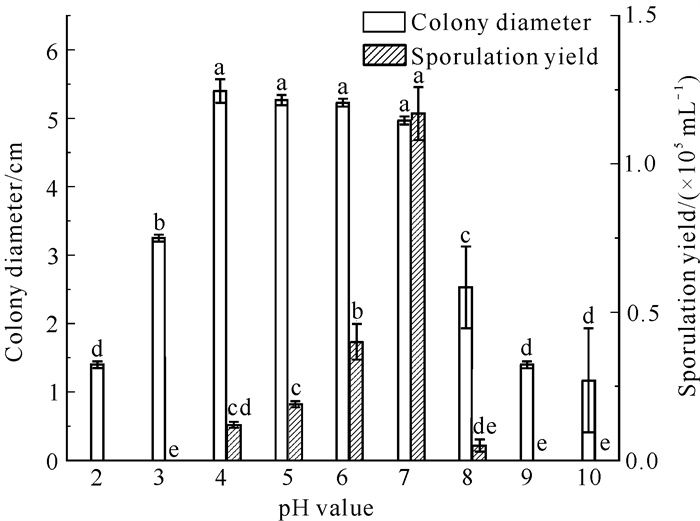
2.3.4 pH值对病原菌菌丝生长及产孢的影响
菌株QTMJ3-1对酸碱的适应范围较广,在pH值为2-10时均能生长(图 9)。当pH值为4-7时,菌丝均有较好的长势但各处理间差异不显著(P>0.05),最适pH值为4,菌落直径为5.4 cm;pH值为5-7时的菌落直径与其他处理间差异显著(P<0.05)。菌株QTMJ3-1在pH值为4-8时产孢,当pH值为7时产孢量最大,为1.17×105 mL-1。当pH值为2和10时产孢量小,菌株生长缓慢,说明菌株QTMJ3-1更适宜在偏酸性和中性的条件下生长。
|
| Different lowercase letters indicate significant differences (P < 0.05). 图 9 pH值对菌株QTMJ3-1菌丝生长和产孢的影响 Fig. 9 Effects of pH value on mycelial growth and sporulation of strain QTMJ3-1 |
2.3.5 光照对病原菌菌丝生长及产孢的影响
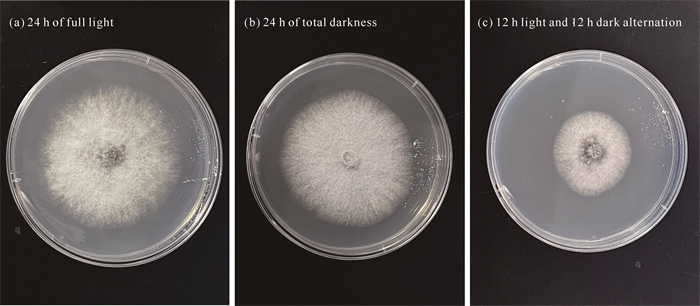
由表 3和图 10可知,菌株QTMJ3-1在24 h全光照条件下更利于菌丝生长,菌落直径为6.520 cm,但产孢量最少,为0.37×105 mL-1,与24 h全黑暗、12 h光照和12 h黑暗交替条件下的菌落直径和产孢量具有显著差异(P<0.05),且三者间的生长速率有显著性差异(P<0.05),说明全光照条件下有利于菌丝生长,但全黑暗条件下有利于该菌产孢。
| 光照条件 Light conditions |
菌落直径/cm Colony diameter/cm |
生长速率/(cm/d) Growth rate/(cm/d) |
产孢量/(×105 mL-1) Sporulation yield/(×105 mL-1) |
| 24 h of full light | 6.520±0.076a | 1.300±0.015a | 0.37±0.09c |
| 24 h of total darkness | 5.900±0.250b | 1.180±0.050b | 2.77±0.15a |
| 12 h light and 12 h dark alternation | 3.870±0.153c | 0.770±0.031c | 1.10±0.15b |
| Note: different lowercase letters in the same column indicate significant differences (P<0.05). | |||
|
| Different lowercase letters indicate significant differences (P < 0.05). 图 10 光照对菌株QTMJ3-1菌丝生长的影响 Fig. 10 Mycelial growth of strain QTMJ3-1 treated at different light conditions |
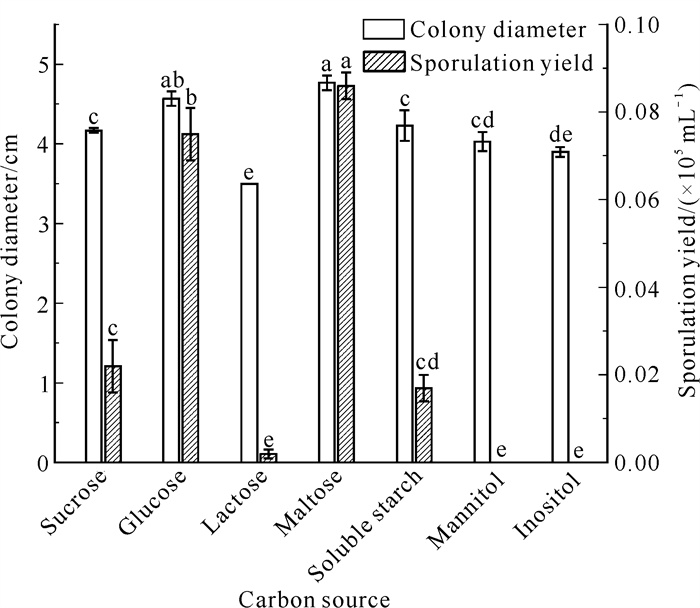
2.3.6 碳源对病原菌菌丝生长及产孢的影响
由图 11可知,菌株QTMJ3-1在7种碳源培养基上均能生长,其中菌株对麦芽糖和葡萄糖的利用最好,菌丝生长快,菌落直径分别为4.77和4.57 cm,两者间差异不显著(P>0.05);其次依次为可溶性淀粉(4.23 cm)、蔗糖(4.17 cm)、甘露醇(4.03 cm)、肌醇(3.90 cm),其中蔗糖和肌醇有显著性差异(P<0.05), 而可溶性淀粉和甘露醇无显著差异(P>0.05);菌落直径最小的是乳糖(3.50 cm),除肌醇外,与其他碳源相比具有显著性差异(P<0.05)。麦芽糖最利于病原菌产孢,产孢量为0.086×105 mL-1,与其他碳源相比具有显著性差异(P<0.05)。综上,麦芽糖最有利于病原菌菌丝生长和产孢。
|
| Different lowercase letters indicate significant differences (P < 0.05). 图 11 碳源对菌株QTMJ3-1菌丝生长和产孢的影响 Fig. 11 Effects of carbon sources on mycelial growth and sporulation of strain QTMJ3-1 |
2.3.7 氮源对病原菌菌丝生长及产孢的影响
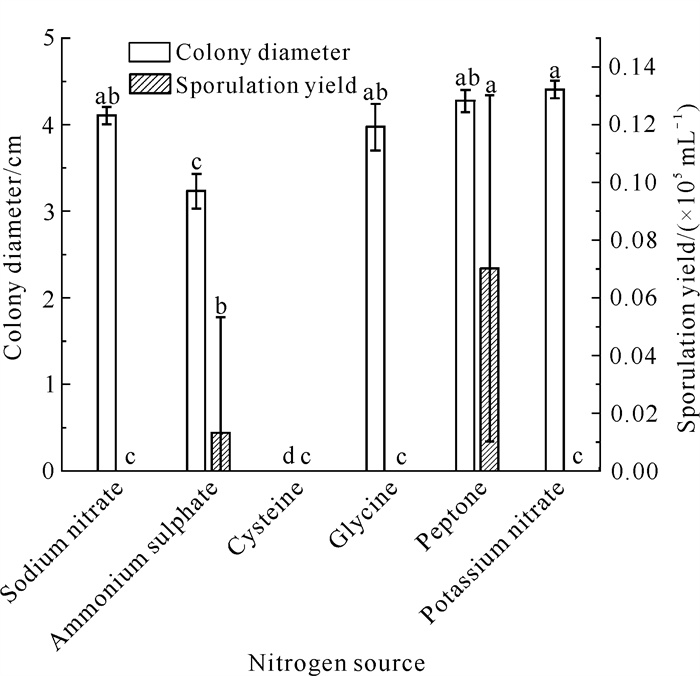
由图 12可知,除半胱氨酸外,菌株QTMJ3-1在含有硝酸钠、硫酸铵、甘氨酸、蛋白胨、硝酸钾等5种培养基中均能生长。其中,在硝酸钠、硝酸钾、蛋白胨、甘氨酸4种培养基上长势较快,菌落直径分别为4.10、4.40、4.27、3.97 cm,各处理间差异不显著(P>0.05);在含有硫酸铵的培养基上长势较慢,菌落直径为3.23 cm,显著低于其他4种氮源处理(P<0.05)。蛋白胨作为氮源时,病原菌的产孢量最大,为0.07×105 mL-1,与其他氮源相比具有显著性差异(P<0.05)。综上,硝酸钠、硝酸钾、蛋白胨、甘氨酸有利于病原菌菌丝生长,蛋白胨有利于病原菌产孢。
|
| Different lowercase letters indicate significant differences (P < 0.05). 图 12 氮源对菌株QTMJ3-1菌丝生长和产孢的影响 Fig. 12 Effects of nitrogen source on mycelial growth and sporulation of strain QTMJ3-1 |
2.4 杀菌剂对病原菌的抑制作用和室内毒力测定
4种杀菌剂对菌株QTMJ3-1的毒力测定结果见表 4。在这4种杀菌剂中450 g/L咪鲜胺WG的毒力最强,EC50值为0.030 8 mg/L;其次是80%代森锰锌WP,EC50值为0.048 3 mg/L;再次是98%噁霉灵SP,EC50值为0.362 7 mg/L;最后是250 g/L丙环唑EC,EC50值为0.561 7 mg/L。综上,这4种杀菌剂对土茯苓苗期炭疽病病原菌的生长均有抑制作用。
| 药剂名称/剂型 Fungicide name/Dosage form |
毒力回归方程 Toxicity regression equation |
相关系数(R2) Correlation coefficient (R2) |
EC50/(mg/L) |
| 98% Oxamiline/SP | y=1.0306x+4.5460 | 0.966 1 | 0.362 7 |
| 250 g/L Propiconazole/EC | y=1.4490x+5.3630 | 0.970 8 | 0.561 7 |
| 450 g/L Prochloraz /WG | y=0.5732x+5.8666 | 0.816 3 | 0.030 8 |
| 80% Mancozeb/WP | y=3.0823x+0.9420 | 0.994 4 | 0.048 3 |
3 讨论
炭疽病病原菌可引起多种中草药植物发病,如山牵牛(Thunbergia grandiflora)[20]、砂仁(Amomum villosum)[21]、山豆根(Sophora tonkinensis)[22]、芍药(Paeonia lactiflora)[23]、黄兰含笑(Michelia champaca)[24]、钩藤(Uncaria hirsuta)[25]、黄连(Coptis chinensis)[26]、草珊瑚(Sarcandra glabra)[27]、多花黄精(Ploygonatum cyrtinema)[28]、鱼腥草(Houttuynia cordata)[29]等中药材,对我国中草药生产造成严重的经济损失。目前,炭疽菌属真菌的分类系统主要是Sutton系统,包括尖孢炭疽菌(C.acutatum)、胶孢炭疽菌(C.gloeosporioides)、尾孢炭疽菌(C.caudatum)等39个种以及14个复合种[30]。目前对炭疽菌的鉴定主要采用形态学和分子生物学结合的方法,分子生物学方法以多基因序列为主,比单基因序列鉴定更加准确[31],且这种方法已逐步被应用于炭疽菌的分类研究中,尤其是在新物种的鉴定上效果突出[32]。本研究利用形态学和分子生物学方法确定引起土茯苓苗期炭疽病的病原菌为可可炭疽菌,该病原菌也会导致其他植物发病,如草莓[33]和富贵竹(Dracaena sanderiana)[34],与刘霄[34]报道的可可炭疽病菌的形态特征和分子生物学鉴定结果一致。
炭疽菌菌株不同,其生物学特性也不一致。但雨柔等[28]研究发现胶孢炭疽菌、果生炭疽菌(C.fructicola)和冬麦炭疽菌(C.liriopes)会引起多花黄精发病,其中冬麦炭疽菌的最佳生长温度为25-28 ℃,最适培养基为PDA,最适pH值为6.0-7.0,最佳碳源和氮源分别是葡萄糖和酵母,全光照有利于菌丝生长。周洁等[29]研究发现胶孢炭疽菌可危害鱼腥草的叶片,该菌的最佳碳源和氮源分别是麦芽糖和酵母提取物,最适pH值为6,致死温度为53 ℃(处理时间10 min)。黄蔚等[35]研究发现从西瓜上分离得到的致病菌胶孢炭疽菌在10-37 ℃时均能生长,最适温度为25 ℃,最适pH值为6,最适碳源为葡萄糖和蔗糖混合碳源。江小冰等[36]从杧果(Mangifera indica)中分离到的暹罗炭疽菌(C.siamense)和胶孢炭疽菌的最适温度为28-30 ℃,最适pH值为7.0-9.0,孢子致死温度为55 ℃(处理时间10 min)。娄喜艳等[37]研究发现从河南商丘月季(Rosa chinenisis)叶片分离得到的胶孢炭疽菌的最适温度为28 ℃,最适pH值为5,最适碳源为淀粉,以蛋白胨和硝酸钾为氮源的培养基中菌丝生长较快,24 h全黑暗条件下最利于菌丝生长。可见,炭疽病菌株之间的生物学特性既有相似性又存在不同,这与病原菌的种类、寄主种类、种植气候等有关。
“预防为主,综合防治”是炭疽病的防治原则。三唑类和咪唑类杀菌剂属脱甲基化酶抑制剂类,此类药剂在炭疽病防治中起着重要作用,其中咪鲜胺和苯醚甲环唑主要用于蔬菜、水果等经济作物[38]。徐从英等[39]发现咪鲜胺杀菌剂对云南橡胶树(Hevea brasiliensis)炭疽病菌的抑制效果最好。此外,苯并吡唑类(多菌灵)和甲氧基丙烯酸酯类(嘧菌酯)等类型药剂也被应用在作物炭疽病的防治中[40, 41]。本研究供试的4种药剂中,450 g/L咪鲜胺WG对菌株QTMJ3-1生长具有较强的抑制作用,EC50值为0.030 8 mg/L。咪鲜胺WG属于咪唑类杀菌剂,具有高效、低毒、广谱等优点。陈武瑛等[42]的研究表明咪唑类杀菌剂对炭疽病防治效果较好。但雨柔等[28]研究发现咪鲜胺和苯醚甲环唑对多花黄精的炭疽病防治效果很好。崔一平等[43]研究发现咪鲜胺和苯醚甲环唑对广东怀集青心菊花朵的胶孢炭疽病防治效果较好。上述防治药剂的效果均与本研究结果相似。由于本研究的毒力测定仅在室内完成,具体防治效果不清晰,后续仍需要进行大田试验来验证。虽然咪鲜胺WG见效快、防治效果好,但是鉴于土茯苓为中草药,还应进一步研究该杀菌剂对土茯苓药效和药材安全的影响。此外,还需对生物农药进行试验和田间应用,以尽可能减少病原菌抗耐药性的发生,从而提高田间防控效果。
4 结论本研究发现引起广西钦州市钦南区土茯苓幼苗期炭疽病的病原菌为可可炭疽菌,该菌生长的最适培养基为沙氏培养基,全光照、28 ℃、pH值为4的条件下利于菌丝生长,该菌对麦芽糖和葡萄糖的利用率较高,最佳氮源为硝酸钾和蛋白胨,致死温度为55 ℃(处理时间20 min)。4种杀菌剂对土茯苓炭疽病病原菌的菌丝生长均表现出较强的毒力,其中450 g/L咪鲜胺WG的毒力最强,其次依次是80%代森锰锌WP、98%噁霉灵SP、250 g/L丙环唑EC,这4种杀菌剂均可作为田间防治土茯苓炭疽病病原菌的候选药剂。
| [1] |
国家药典委员会. 中华人民共和国药典: 一部[M]. 2020年版.北京: 中国医药科技出版社, 2020.
|
| [2] |
季旭明. 土茯苓历代除湿解毒功效简述及探源[J]. 中国医药指南, 2012, 10(9): 217-218. |
| [3] |
梁崇, 廖莉莉. 土茯苓丛生芽诱导与增殖培养技术优化[J]. 热带农业科学, 2018, 38(8): 40-43. |
| [4] |
WU H, WANG Y, ZHANG B, et al. Smilax glabraRoxb.: a review of its traditional usages, phytochemical constituents, pharmacological properties, and clinical applications[J]. Drug Design, Development and Therapy, 2022, 16: 3621-3643. DOI:10.2147/DDDT.S374439 |
| [5] |
周意, 卢金清, 崔露, 等. 土茯苓及其混淆品挥发性成分分析[J]. 中国药师, 2018, 21(10): 1865-1867. |
| [6] |
李洁, 程双, 董丹阳, 等. 土茯苓解重金属铅毒性物质基础的初步研究[J]. 中草药, 2022, 53(1): 117-125. |
| [7] |
董青松, 闫志刚, 白隆华, 等. 土茯苓组织培养研究[J]. 中药材, 2014, 37(1): 5-9. |
| [8] |
周正, 李卿, 陈万生, 等. 药用植物天然产物生物合成途径及关键催化酶的研究策略[J]. 生物技术通报, 2021, 37(8): 25-34. |
| [9] |
范沾涛, 韦范, 乔柱, 等. 药用植物组织培养生产次生代谢产物的研究进展[J]. 生物资源, 2022, 44(2): 130-140. |
| [10] |
吴丽明, 张敏. 土茯苓中落新妇甙的利尿和镇痛作用[J]. 中药材, 1995, 18(12): 627-630. |
| [11] |
张白嘉, 刘亚欧, 刘榴, 等. 土茯苓及落新妇苷抗炎、镇痛、利尿作用研究[J]. 中药药理与临床, 2004, 20(1): 11-12. |
| [12] |
SHARMA A, GUPTA S, CHAUHAN S, et al. Astilbin: a promising unexplored compound with multidimensional medicinal and health benefits[J]. Pharmacological Research, 2020, 158: 104894. DOI:10.1016/j.phrs.2020.104894 |
| [13] |
方中达. 植病研究方法[M]. 3版. 北京: 中国农业出版社, 1998.
|
| [14] |
魏景超遗. 真菌鉴定手册[M]. 上海: 上海科学技术出版社, 1979.
|
| [15] |
KUMAR S, STECHER G, TAMURA K. MEGA7:molecular evolutionary genetics analysis version 7.0 for bigger datasets[J]. Molecular Biology and Evolution, 2016, 33(7): 1870-1874. DOI:10.1093/molbev/msw054 |
| [16] |
WHITE T J, BRUNS T, LEE S, et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[M]//PCR Protocols: A Guide to Methods and Applications. Amsterdam: Elsevier, 1990: 315-322.
|
| [17] |
CARBONE I, KOHN L M. A method for designing primer sets for speciation studies in filamentous ascomycetes[J]. Mycologia, 1999, 91(3): 553-556. DOI:10.1080/00275514.1999.12061051 |
| [18] |
O′DONNELL K, CIGELNIK E. Two divergent intragenomic rDNA ITS2 types within a monophyletic lineage of the fungus Fusarium are nonorthologous[J]. Molecular Phylogenetics and Evolution, 1997, 7(1): 103-116. DOI:10.1006/mpev.1996.0376 |
| [19] |
徐丹丹, 石力允, 林泽勉, 等. 美丽崖豆藤炭疽病病原鉴定及防治药剂的室内毒力测定[J]. 华南农业大学学报, 2021, 42(4): 63-69. |
| [20] |
宋利沙, 蒋妮. 山牵牛炭疽病病原分离与鉴定[J]. 中国现代中药, 2018, 20(8): 984-986. |
| [21] |
SONG L, LIN W, JIANG N, et al. Anthracnose disease of Amomum villosum caused by Colletotrichum fructicola in China[J]. Journal of General Plant Pathology, 2021, 87(4): 259-263. DOI:10.1007/s10327-021-00999-7 |
| [22] |
SONG L S, JIANG N, CHEN Q P, et al. First report of leaf spot caused by Colletotrichum siamense on Sophora tonkinensis[J]. Australasian Plant Disease Notes, 2021, 16(1): 11. DOI:10.1007/s13314-021-00420-4 |
| [23] |
PARK M J, LEE J H, BACK C G, et al. First report of Colletotrichum fioriniae causing anthracnose on Paeonia lactiflora in Korea[J]. Plant Disease, 2020, 104(12): 3259. DOI:10.1094/PDIS-03-20-0597-PDN |
| [24] |
ZHANG L, YANG X X, HUANG X Q, et al. First report of anthracnose on Michelia champaca caused by Colletotrichum fioriniae in China[J]. Plant Disease, 2018, 102(10): 2040. |
| [25] |
邓洁, 莫飞旭, 石金巧, 等. 钩藤炭疽病病原鉴定、生物学特性及防治药剂筛选[J]. 中药材, 2020, 43(6): 1303-1307. |
| [26] |
DING H X, CHENG H H, LI J Y, et al. First report of Colletotrichum boninense causing anthracnose on goldthread (Coptis chinensis) in China[J]. Plant Disease, 2020, 104(5): 1538. |
| [27] |
JIANG N, LIN B R, SONG L S, et al. First report of Corynespora cassicola causing black spot on Sarcandra glabra in China[J]. Plant Disease, 2021, 105(11): 3754. |
| [28] |
但雨柔, 汤子萱, 马万里, 等. 多花黄精炭疽病菌的鉴定、生物学特性及防治药剂筛选[J]. 植物病理学报, 2023, 53(5): 796-809. |
| [29] |
周洁, 吴金平, 王明安, 等. 鱼腥草炭疽病病原鉴定及室内药剂筛选[J]. 南方农业学报, 2022, 53(10): 2919-2927. |
| [30] |
刘丽萍, 高洁, 李玉. 植物炭疽菌属Colletotrichum真菌研究进展[J]. 菌物研究, 2020, 18(4): 266-281. |
| [31] |
李其利, 卜俊燕, 唐利华, 等. 芒果炭疽菌研究进展[J]. 微生物学杂志, 2020, 40(1): 117-124. |
| [32] |
LIU F, WANG M, DAMM U, et al. Species boundaries in plant pathogenic fungi: a Colletotrichum case study[J]. BMC Evolutionary Biology, 2016, 16: 81. |
| [33] |
陈哲, 黄静, 赵佳, 等. 草莓应答炭疽菌侵染的转录组分析[J]. 植物保护, 2020, 46(3): 138-146. |
| [34] |
刘霄. 珠江三角洲地区园林花卉炭疽菌种类鉴定[D]. 广州: 仲恺农业工程学院, 2016.
|
| [35] |
黄蔚, 崔丽红, 谢王超, 等. 西瓜新炭疽病病原菌分子鉴定及其生物学特性初探[J]. 中国农学通报, 2022, 38(1): 131-136. |
| [36] |
江小冰, 谭小丽, 陶能国. 杧果采后病原菌的分离、鉴定及致病力研究[J]. 湘潭大学学报(自然科学版), 2022, 44(2): 12-20. |
| [37] |
娄喜艳, 王欣阳, 裴冬丽. 河南商丘月季炭疽病的病原菌鉴定及生物学特性[J]. 江苏农业科学, 2021, 49(22): 116-121. |
| [38] |
孙伟, 陈淑宁, 闫晓静, 等. 我国防治炭疽病杀菌剂的应用现状[J]. 现代农药, 2022, 21(2): 1-6. |
| [39] |
徐从英, 王萌, 梁晓宇, 等. 云南西双版纳地区橡胶树炭疽病菌的系统进化分析和室内药剂筛选[J]. 西南农业学报, 2021, 34(12): 2653-2658. |
| [40] |
HAN Y C, ZENG X G, XIANG F Y, et al. Carbendazim sensitivity in populations of Colletotrichum gloeosporioides complex infecting strawberry and yams in Hubei Province of China[J]. Journal of Integrative Agriculture, 2018, 17(6): 1391-1400. |
| [41] |
韦继彦, 韦呈武, 黄泽熙, 等. 8种杀菌剂对指天椒炭疽病的田间防效[J]. 中国植保导刊, 2020, 40(2): 68-70. |
| [42] |
陈武瑛, 陈昂, 李凯龙, 等. 苯醚甲环唑在芹菜和土壤中的残留行为及风险评估[J]. 农药学学报, 2022, 24(6): 1500-1507. |
| [43] |
崔一平, 李一方, 彭埃天, 等. 广东怀集青心菊炭疽病病原菌的分子鉴定[J]. 广东农业科学, 2022, 49(1): 87-93. |



