2. 崇左市广西花山景区管理委员会,广西崇左 532200;
3. 广西壮族自治区桂林生态环境监测中心,广西桂林 541199;
4. 广西师范大学后勤保障处,广西桂林 541004
2. Chongzuo Guangxi Huashan Scenic Area Management Committee, Chongzuo, Guangxi, 532200, China;
3. Guilin Ecological Environmental Monitoring Center, Guilin, Guangxi, 541199, China;
4. Logistics Support Service, Guangxi Normal University, Guilin, Guangxi, 541004, China
世界卫生组织认为,空气中细菌浓度为700-1 800 CFU/m3时,有发生空气感染的危险[1]。空气中的微生物可通过尘埃、飞沫传播,增加人们呼吸道感染、哮喘、皮肤过敏症、慢性肺部疾病和心血管疾病等的发病率[2]。微生物的生存需要载体、养分及水分等,干洁大气并非微生物的栖息场所。大气细颗粒物(PM2.5)作为主要的空气污染物,具有粒径小、比表面积大等特点,微生物易富集在其表面,对环境质量产生严重影响[3]。据已有研究报道,降雨能促进微生物从土壤释放到空气中,具体来说,雨滴在撞击土壤表面时会形成气溶胶(悬浮水滴),而每滴雨滴都能将土壤表面0.01%的细菌转移至空气中[4-6]。
大气中的微生物通常是由动植物、土壤和天然水体等载体释放[7]。韩一超等[8]研究表明,猪舍内微生物气溶胶与猪粪便中的微生物组成存在较高的相似性。程晓亮等[7]研究指出,猪舍空气中的细菌丰富度和多样性呈现出季节性变化趋势,并在优势菌属中发现了大量潜在动物病原菌。Yang等[9]研究认为,城市污水处理厂空气中22.5%的病原体来源于污水。A2O工艺污水处理厂的板框脱水间细菌气溶胶对人体存在非致癌风险[危害熵值(HQ>1)],需引起重视[10]。谢雯文等[11]通过研究PM2.5、土壤及叶片等样本认为,在局部源叶片和土壤中,叶片表面微生物是空气中微生物的主要潜在源。由于微生物气溶胶受人类活动及工农业生产等社会因素影响,不同地点的微生物群落特征有所不同。然而,关于不同环境空间PM2.5中细菌群落结构差异性特征的报道相对较少。
本研究在桂林城区与市郊选择8类不同的环境空间,分别采集PM2.5及表层土壤样本,通过高通量测序分析样本的细菌群落结构,以研究其差异性特征,旨在为解析城市近地面微环境大气颗粒物的细菌来源提供基础数据和科学依据,同时也为区域疾病预防与空气质量改善等方面提供科学的理论基础。
1 材料与方法 1.1 研究区域根据桂林市的城区规划,本研究选取8类典型的人类活动环境空间,采样点位分布如图 1所示(其中污染水处理厂点位距离城区中心20 km,在图中使用箭头标注),基本覆盖了桂林市区及周边区域,并且点位尽可能不相邻。采样点位的环境特征、植被覆盖率与人口密度差异明显,其中鱼塘、山林、园林环境植被较多,受人类活动影响较小;垃圾中转站、医院、集市、家禽养殖场、污水处理厂受人类活动影响较大。采样点环境基本特征如下。
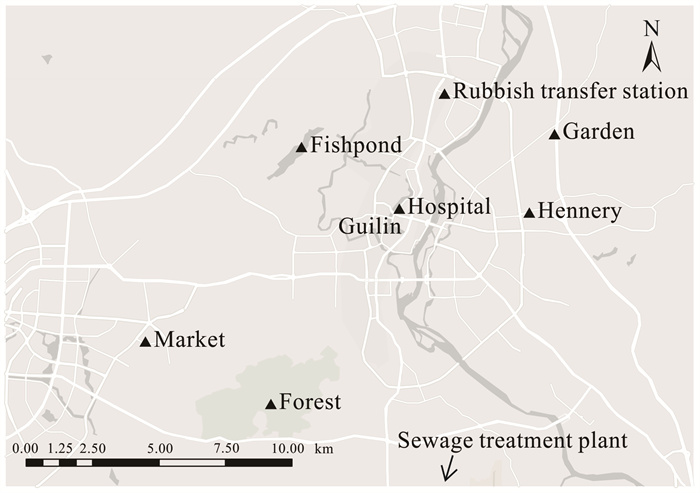
|
| 图 1 采样点位分布 Fig. 1 Distribution of sampling locations |
① 垃圾中转站:位于街道旁,有行人和车辆经过。
② 园林:以乔木和灌木为主,主要植被为枫树,野生植物有一年蓬和马齿苋等,采样点附近有育种中心,栽种着各种盆栽植物。
③ 鱼塘:自然形成的洼地,已被人工改造为水产养殖场,整个水域自然生长各种水草与小型水生动物。
④ 医院:选取住院楼旁的区域作为医院样本,此处人流和车流较多。
⑤ 家禽养殖场:半开放式,占地约1 000 m2,畜养鸡、鸭和鹅等家禽超过100只。
⑥ 集市:占地面积约900 m2,固定摊位总数约60个。
⑦ 山林:植被以马尾松纯林为主,天然植被有铁芒箕、东方蕨、桃金娘和白茅等。
⑧ 污水处理厂:污水日处理量约20 000 t,处理工艺为循环活性污泥系统(Cyclic Activated Sludge System,CASS)。
1.2 样本采集PM2.5样本采集:在上述8类典型人类活动环境空间中,分别使用2台大气综合采样器(KC-6120型,青岛崂山电子仪器总厂有限公司)以100 L/min的流速采集离地1.5 m处的PM2.5样本,采样时间为2021年12月26日至30日,每次采样时长为3 h。采样前将滤膜放入马弗炉中900 ℃烘烤2 h去除杂质,放入消毒过的滤膜盒中备用。所有采样器具采样前都用75%的酒精擦拭,采样完成后将样品滤膜放置于-20 ℃冰箱。
表层土壤样本采集:与PM2.5样本同时采集,以大气综合采样器为中心,在半径15 m范围内等间距选择5个点位,采集沉积在地面上的尘土。尽可能保证每个取样点的采样量一致。取样后用2 mm孔径筛网过筛,去除可见杂质,然后置于无菌采样瓶内送至实验室,在干冰袋中-78 ℃储存。
1.3 DNA提取进行实验前,将所使用到的实验器材放入高压灭菌锅内进行灭菌处理15 min(103.43 kPa,121 ℃)。将待测样本按照OMEGA Soil DNA Kit试剂盒说明书上的步骤进行DNA提取,将提取的样本置于-20 ℃条件下保存。使用琼脂糖凝胶电泳检测提取的DNA的纯度,并用NanoDrop超微量分光光度计(NC2000,美国赛默飞世尔科技公司)测量提取的DNA的数量和质量。
1.4 16S rRNA扩增和高通量测序采用带有Barcode的通用引物338F(5′-ACTC-CTACGGGAGGCAGCA-3′)和806R(5′-GGAC-TACHVGGGTWTCTAAT-3′)对细菌16S rRNA基因的V3-V4区域进行PCR扩增。PCR扩增程序为①预变性(98 ℃,5 min);②变性(98 ℃,5 min);③退火(53 ℃,30 s);④延伸(72 ℃,45 s);⑤保持(72 ℃,5 min)。其中,②③④步骤进行25个循环。
PCR产物用DNA纯化磁珠(VAHTS DNA Clean Beads)进行纯化,并使用Quant-iT试剂进行定量。将所得的符合标准的DNA文库经等浓度混合和变性后,通过上海派森诺生物科技股份有限公司的NovaSeq平台进行16S rRNA(V3-V4区域)测序。
1.5 测序数据处理通过测序平台对群落目标DNA片段进行双端测序,根据序列质量进行初步筛查,对问题样本进行重测、补测。之后根据原始序列Index和Barcode信息进行文库和样本划分,并去除Barcode序列。按照QIIME 2 dada2分析流程对数据进行质控、去噪、去嵌合体。
1.6 序列分析和数据处理方法使用OriginPro 8.5、QIIME 2 (2019.4)、R脚本、ggplot2包、ape包、pheatmap包等进行序列数据分析和可视化。利用QIIME 2中的扩增子序列变体(Amplicon Sequence Varian,ASV)表计算ASV水平的α多样性指数, 以Chao1指数表征细菌丰富度,以Shannon指数表征细菌多样性,以Pielou′s evenness指数表征细菌均匀度[12-14]。利用Bray-Curtis算法进行β多样性分析,并通过主坐标分析方法(Principal Coordinates Analysis,PCoA)比较样本间的群落差异[15, 16]。
2 结果与分析 2.1 不同环境空间下细菌群落结构特征分析对各类环境空间内的PM2.5和表层土壤中的细菌群落结构进行深入剖析,其门级分类的详细分布见图 2。图 2(a)详尽描绘了不同环境空间下PM2.5样本中细菌门的分布特征。结果显示,变形菌门(Proteobacteria,56.0%)、厚壁菌门(Firmicutes,9.8%)、拟杆菌门(Bacteroidetes,7.6%)、放线菌门(Actinobacteria,6.3%)及绿弯菌门(Chloroflexi,2.5%)这5大类菌群共占据细菌总数的82.2%。进一步分析发现,变形菌门在林地、园林、垃圾中转站及集市等自然与人为交织的环境中呈现出较高的相对丰度,具体范围为63.7%-65.8%,其在鱼塘(60.3%)、医院(53.5%)及污水处理厂(53.3%)等环境中也占据优势地位,但在家禽养殖场中的相对丰度明显较低,仅为21.7%,这表明变形菌门在自然环境中广泛存在且相对丰度较高。相比之下,厚壁菌门与放线菌门在家禽养殖场中的相对丰度较高,分别达到42.1%与19.3%,而在其他环境空间中的分布则较为均衡,维持在3.0%-6.2%。此外,绿弯菌门在垃圾中转站中的相对丰度最高(5.0%),而在家禽养殖场中则最低(0.5%)。至于未明确归类的其他菌群(Others),其在医院(27.4%)与污水处理厂(26.8%)中的相对丰度较高,这可能与这些特定环境中存在的特殊微生物群落有关。
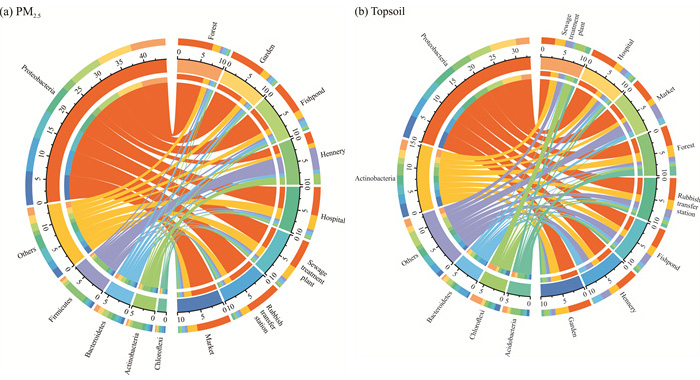
|
| 图 2 不同环境空间下细菌在门水平上的相对分布 Fig. 2 Relative distribution of bacteria at the phylum level in the different environmental spaces |
图 2(b)为不同环境空间下表层土壤中细菌门的分布状况,可以发现变形菌门也是土壤中最具优势的菌群,平均相对丰度为41.6%,最高为医院(52.2%),最低为污水处理厂(27.2%)。放线菌门的平均相对丰度为19.4%,位居第2,最高为园林(26.7%),最低为集市(11.9%)。拟杆菌门在家禽养殖场(19.7%)最为富集,在其他样本中的相对丰度为3.2%-10.3%。绿弯菌门在污水处理厂中的相对丰度(23.5%)最高,在家禽养殖场(1.3%)和集市(0.8%)中较低,在其他空间环境中为6.0%-10.7%。放线菌门最大相对丰度值出现在山林(18.6%),最小相对丰度值出现在家禽养殖场(0.2%)。其他类别中,在集市(29.8%)中的相对丰度较大,在山林(8.8%)和园林(8.5%)中较小。
图 3为不同环境空间下PM2.5和表层土壤中细菌属水平的相对丰度。从图 3(a)中可发现,PM2.5中相对丰度前10的物种约占总体的20%,并且PM2.5与表层土壤的菌群种类存在较大差异。异样根瘤菌属(Allorhizobium-Neorhizobium-Pararhizobium-Rhizobium)平均相对丰度为2.9%,是PM2.5样本中的优势菌属; 其次依次为假双头斧形菌属(Pseudolabrys,2.2%)、甲基杆菌属(Methylobacterium,2.0%)和不动杆菌属(Acinetobacter,1.9%)。家禽养殖场与其他PM2.5样本的相对差异较大,乳酸杆菌属(Lactobacillus,10.0%)是家禽养殖场的优势菌属。
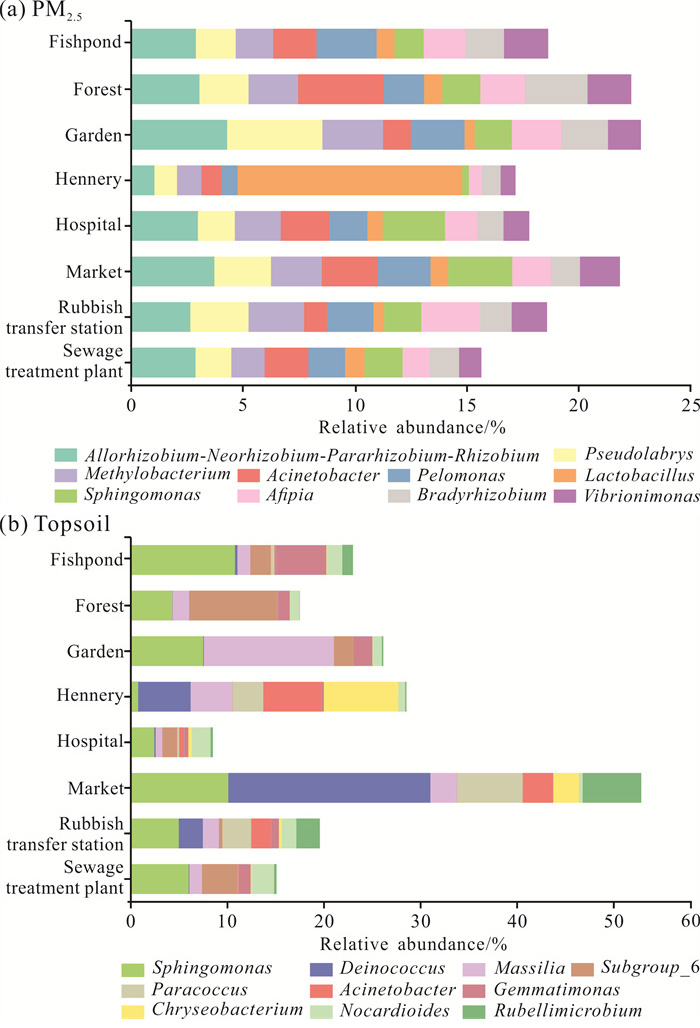
|
| 图 3 不同环境空间下优势菌属的相对丰度 Fig. 3 Relative abundance of dominant bacterial groups in the different environmental spaces |
从图 3(b)中可以发现,鞘氨醇单胞菌属(Sphingomonas)是表层土壤样本中的优势菌属,在表层土壤中的平均相对丰度为5.9%。此外,不同环境空间下的表层土壤均有特有的优势菌属,如山林和污水处理厂表层土壤中的优势菌属为酸杆菌门(Acidobacteria)下的Subgroup_6属,园林为马赛菌属(Massilia),集市为异常球菌属(Deinococcus)。总体而言,与PM2.5相比,不同环境空间下的表层土壤中的菌群成分更加复杂。
2.2 不同环境空间下细菌群落结构差异性分析表 1展示了不同环境空间下,PM2.5及表层土壤样本中细菌的Chao1指数、Pielou′s evenness指数以及Shannon指数。由表 1可以看出,PM2.5中细菌的丰富度和多样性(Chao1指数:540.2-957.4;Shannon指数:6.97-8.08)均低于表层土壤(Chao1指数:1 644.2-4 869.3;Shannon指数:9.15-10.67),说明表层土壤样本中的细菌更为复杂和丰富。从不同环境空间来看,PM2.5样本中细菌Shannon指数的大小排序为家禽养殖场>污水处理厂>医院>鱼塘>垃圾中转站>集市>山林>园林,表层土壤样本则为鱼塘>山林>污水处理厂>垃圾中转站>园林>家禽养殖场>集市>医院。其中山林样本中PM2.5与表层土壤细菌的α多样性指数差异较大,推测PM2.5被山林中的植物吸附导致样品中微生物种类减少,而表层土壤被落叶覆盖适合微生物生长。在集市、医院等环境中α多样性指数较小,表明频繁的人为活动会影响环境中细菌的丰富度和多样性。
| 采样点 Sampling site |
PM2.5 | 表层土壤 Topsoil |
|||||
| Chao1指数 Chao1 index |
Pielou′s evenness指数 Pielou′s evenness index |
Shannon指数 Shannon index |
Chao1指数 Chao1 index |
Pielou′s evenness指数 Pielou′s evenness index |
Shannon指数 Shannon index |
||
| Market | 580.5 | 567.0 | 7.35 | 3 098.4 | 1 895.8 | 9.20 | |
| Rubbish transfer station | 651.8 | 632.5 | 7.39 | 3 880.6 | 2 589.8 | 10.46 | |
| Sewage treatment plant | 715.4 | 691.3 | 7.90 | 3 810.3 | 2 641.4 | 10.55 | |
| Hospital | 669.8 | 654.6 | 7.82 | 1 644.2 | 1 464.1 | 9.15 | |
| Hennery | 957.4 | 863.3 | 8.08 | 3 556.9 | 2 146.3 | 9.78 | |
| Fishpond | 647.8 | 626.4 | 7.46 | 4 262.1 | 2 843.5 | 10.67 | |
| Garden | 540.2 | 513.3 | 6.97 | 4 063.0 | 2 564.4 | 9.87 | |
| Forest | 555.0 | 533.1 | 7.26 | 4 869.3 | 3 148.9 | 10.61 | |
不同样本之间的差异性如图 4所示,在PM2.5样本中,除了家禽养殖场和医院远离其他样本外,不同环境空间的组间差异性较小,可视为一类。而表层土壤样本在不同环境空间中的差异性明显,根据表层土壤样本在PCo1和PCo2投影的分布情况可分为3类:以家禽养殖场、集市和垃圾中转站为一类,这类环境受人为活动影响较大;而污水处理厂位于城郊,受人为活动干扰较小,与鱼塘、园林和山林等相近,视为一类;结合图 2、图 3来看,医院环境的微生物群落与其他类型的土壤环境差异较大,则独立归为一类。此外,图 4中两点之间的线段长度表示PM2.5与表层土壤中细菌群落的差异程度,其中,医院的差异程度最小,其次为家禽养殖场,而其他环境空间中的样本差异较大,与前述表层土壤中细菌群落成分比PM2.5中更复杂的结果相符。
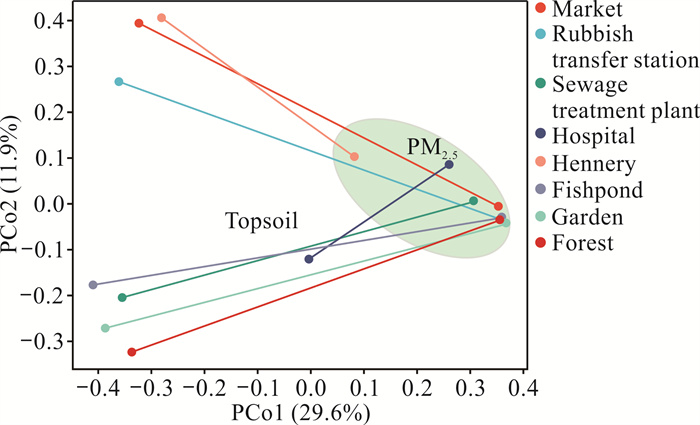
|
| 图 4 不同环境空间下样本主坐标分析 Fig. 4 Principal co-ordinates analysis of samples in different environmental spaces |
2.3 不同环境空间下细菌属水平差异性分析
图 5展示了各样本细菌属水平的差异情况,可以看出假单胞菌属(Pseudomonas)、慢生根瘤菌属(Bradyrhizobium)、异样根瘤菌属、甲基杆菌属、假双头斧形菌属、阿菲波菌属(Afipia)、污泥单胞菌属(Pelomonas)和Vibrionimonas属主要存在于PM2.5中,而表层土壤中较少。芽单胞菌属(Gemmatimonas)在PM2.5中少量存在,而在表层土壤中明显富集,并且为鱼塘的优势菌属。乳酸杆菌属和葡萄球菌属(Staphylococcus)是家禽养殖场PM2.5中的特征菌属,但在表层土壤中这2类菌属的相对丰度并不高。此外,金黄杆菌属(Chryseobacterium)、不动杆菌属、德沃斯氏菌属(Devosia)为家禽养殖场表层土壤的优势菌属。在集市的表层土壤中微红微球菌属(Rubellimicrobium)、异常球菌属和副球菌属(Para-coccus)占主导地位。相比之下,医院样本整体呈现较为浅淡的色调,结合图 3来看,医院样本中的优势菌属表现不显著。
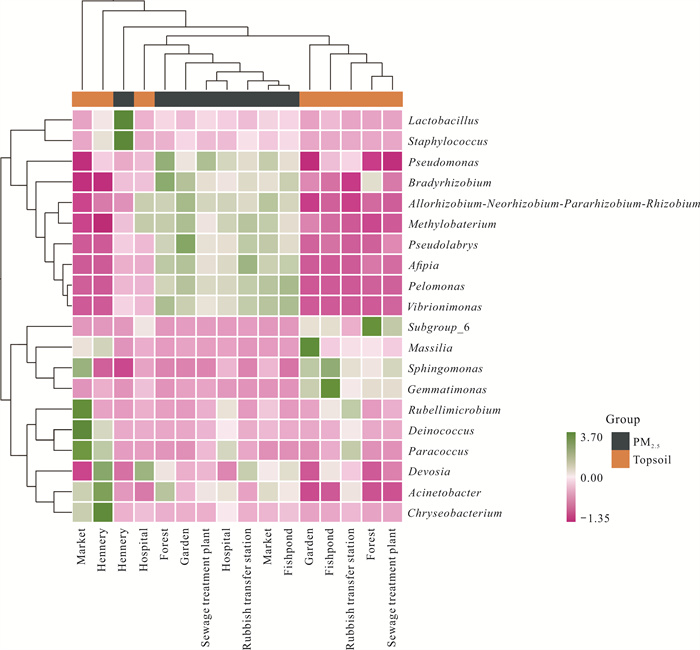
|
| 图 5 不同环境空间下PM2.5和表层土壤中优势菌属的群落组成 Fig. 5 Bacterial community composition of dominant genera in PM2.5 and topsoil in different environmental spaces |
3 讨论
本研究通过采集不同环境空间下的PM2.5和表层土壤,对细菌群落结构进行研究。从结果看,变形菌门是所有样本的优势菌群,其在自然界中具有重要的生态功能,例如参与土壤养分循环、分解有机物质等,此外,该门类中含沙门氏菌(Salmonella)、霍乱弧菌(Vibrio cholerae)和幽门螺杆菌(Helicobacter pylori)等多种致病菌[17, 18]。医院和污水处理厂的其他菌门占比较高。刘曼丽等[19]的研究表明,在污水处理过程中,微生物会通过机械运转、曝气等扰动作用逸散到空气中,生物处理工艺段及污泥脱水浓缩工艺段的微生物气溶胶浓度相对其他工艺段较高,是微生物气溶胶污染物的重要释放源。人体内的细菌数量是人体细胞数量的10倍,每平方厘米皮肤表面含有106个细菌[20, 21]。因此,推测环境遭受人类活动干扰后会引入其他种类的微生物。
从属水平整体而言,异样根瘤菌属为PM2.5样本中的优势菌属,其可与豆科植物形成共生关系,通过固氮酶将空气中的氮气转化为氨基氮,提供给植物作为养分,因此在环境中的分布较为广泛[22]。鞘氨醇单胞菌属是表层土壤样本中的优势菌属,其具有特殊的代谢调控机制,可利用多种复杂的有机物进行生长代谢以适应环境的改变,且能经过长距离传输在大气中扩散;鞘氨醇单胞菌的某些菌株还能降解高分子有机物,从它的丰度大小可以侧面反映出该土壤的有机物质含量[23-25]。金黄杆菌属、不动杆菌属、德沃斯氏菌属为家禽养殖场表层土壤的优势菌属,其中不动杆菌属是机会致病菌,能导致肺炎、尿路感染、伤口感染等,其他研究也表明这些菌属与动物相关[26-29]。马赛菌属是园林表层土壤的优势菌属,其将易降解有机物作为底物,当环境中存在充足的碳源时,马赛菌属的繁殖率提高,在沙漠表层沙、戈壁和土壤中都能检测到其存在[30]。值得注意的是,在医院样本中没有发现明显的优势菌属,这与Gao等[31]对5家医院的空气微生物进行测序后,发现医院细菌门类分布与室外环境相似的结论吻合。
4 结论研究结果表明,不同环境空间下的PM2.5和表层土壤中,主要存在变形菌门、厚壁菌门、拟杆菌门、放线菌门和绿弯菌门这5类菌门,它们的丰度总占比达到82.2%。变形菌门在林地、园林、垃圾中转站和集市中的相对丰度较高,厚壁菌门和放线菌门在家禽养殖场中的相对丰度较高,绿弯菌门在垃圾中转站中的相对丰度较高。通过对细菌的丰富度和多样性指数分析发现,表层土壤中的细菌丰富度和多样性高于PM2.5。此外,不同环境空间之间的细菌多样性也存在差异,受人为活动影响较大的环境,如家禽养殖场、医院和集市,其细菌多样性指数较小。在细菌属水平上,异样根瘤菌属、假双头斧形菌属、甲基杆菌属、不动杆菌属等主要存在于PM2.5中,鞘氨醇单胞菌属、异常球菌属、马赛菌属和酸杆菌门下的Subgroup_6属在表层土壤中明显富集。不同环境空间下的PM2.5和表层土壤中分别存在特定的优势菌属。例如,乳酸杆菌属和葡萄球菌属为家禽养殖场PM2.5中的优势菌属。金黄杆菌属为家禽养殖场和集市表层土壤中的优势菌属。
| [1] |
于 玺华. 现代空气微生物学[M]. 北京: 人民军医出版社, 2002.
|
| [2] |
ARMADANS-GIL L, RODRÍGUEZGARRIDO V, CAMPINSMARTÍ M, et al. Particle counting and microbiological air sampling: results of the simultaneous use of both procedures in different types of hospital rooms[J]. Enfermedades Infecciosas y Microbiología Clínica, 2013, 31(4): 217-221. DOI:10.1016/j.eimc.2012.01.005 |
| [3] |
CHENG J, HO H C, WEBSTER C, et al. Lower-than-standard particulate matter air pollution reduced life expectancy in Hong Kong: a time-series analysis of 8.5 million years of life lost[J]. Chemosphere, 2021, 272: 129926. DOI:10.1016/j.chemosphere.2021.129926 |
| [4] |
JOUNG Y S, GE Z, BUIE C R. Bioaerosol generation by raindrops on soil[J]. Nature Communications, 2017, 8: 14668. DOI:10.1038/ncomms14668 |
| [5] |
HEO K J, KIM H B, LEE B U. Concentration of environmental fungal and bacterial bioaerosols during the monsoon season[J]. Journal of Aerosol Science, 2014, 77: 31-37. DOI:10.1016/j.jaerosci.2014.07.001 |
| [6] |
NIU M T, HU W, CHENG B R, et al. Influence of rainfall on fungal aerobiota in the urban atmosphere over Tianjin, China: a case study[J]. Atmospheric Environment: X, 2021, 12: 100137. DOI:10.1016/j.aeaoa.2021.100137 |
| [7] |
程晓亮, 陈剑波, 王树华, 等. 不同季节猪舍内气溶胶中的细菌多样性分析[J]. 家畜生态学报, 2022, 43(6): 55-62. |
| [8] |
韩一超, 郭慧慧, 陈剑波, 等. 保育猪舍空气、粪便、鼻腔黏液及猪组织器官的微生物群落多样性分析[J]. 畜牧与兽医, 2018, 50(10): 32-37. |
| [9] |
YANG K X, LI L, WANG Y J, et al. Airborne bacteria in a wastewater treatment plant: emission characterization, source analysis and health risk assessment[J]. Water Research, 2019, 149: 596-606. DOI:10.1016/j.watres.2018.11.027 |
| [10] |
李沅津, 杨庆, 赵茹涵, 等. A2O工艺污水处理厂微生物气溶胶逸散特征及暴露风险评价[J]. 环境科学学报, 2021, 41(9): 3457-3463. |
| [11] |
谢雯文, 路瑞, 慕飞飞, 等. 西安市秋冬季市区与山区微生物气溶胶组成特征及来源[J]. 环境科学, 2020, 41(5): 2044-2049. |
| [12] |
CHAO A. Nonparametric estimation of the number of classes in a population[J]. Scandinavian Journal of Statistics, 1984, 11(4): 265-270. |
| [13] |
SHANNON C E. A mathematical theory of communication[J]. The Bell System Technical Journal, 1948, 27(3): 379-423. DOI:10.1002/j.1538-7305.1948.tb01338.x |
| [14] |
SHANNON C E. Communication theory of secrecy systems[J]. The Bell System Technical Journal, 1949, 28(4): 656-715. DOI:10.1002/j.1538-7305.1949.tb00928.x |
| [15] |
LOZUPONE C, KNIGHT R. UniFrac: a new phylogenetic method for comparing microbial communities[J]. Applied and Environmental Microbiology, 2005, 71(12): 8228-8235. DOI:10.1128/AEM.71.12.8228-8235.2005 |
| [16] |
RAMETTE A. Multivariate analyses in microbial ecology[J]. FEMS Microbiology Ecology, 2007, 62(2): 142-160. DOI:10.1111/j.1574-6941.2007.00375.x |
| [17] |
HOLMGREN J, CZERKINSKY C. Mucosal immunity and vaccines[J]. Nature Medicine, 2005, 11(Suppl 4): S45-S53. |
| [18] |
RAUSELL A, TELENTI A. Genomics of hostpathogen interactions[J]. Current Opinion in Immunology, 2014, 30: 32-38. DOI:10.1016/j.coi.2014.06.001 |
| [19] |
刘曼丽, 熊红松, 马民, 等. 市政污水处理厂中生物气溶胶污染物的排放和微生物定量风险评价[J]. 给水排水, 2020, 56(S1): 567-575. |
| [20] |
GRICE E A, KONG H H, RENAUD G, et al. A diversity profile of the human skin microbiota[J]. Genome Research, 2008, 18(7): 1043-1050. DOI:10.1101/gr.075549.107 |
| [21] |
SAVAGE D C. Microbial ecology of the gastrointestinal tract[J]. Annual Review of Microbiology, 1977, 31: 107-133. DOI:10.1146/annurev.mi.31.100177.000543 |
| [22] |
HE X, ZHANG S Y, JIANG Y H, et al. Influence mechanism of filling ratio on solidphase denitrification with polycaprolactone as biofilm carrier[J]. Bioresource Technology, 2021, 337: 125401. DOI:10.1016/j.biortech.2021.125401 |
| [23] |
GRIFFIN D W, GARRISON V H, HERMAN J R, et al. African desert dust in the Caribbean atmosphere: microbiology and public health[J]. Aerobiologia, 2001, 17(3): 203-213. DOI:10.1023/A:1011868218901 |
| [24] |
汪瑶, 祁建华, 张婷, 等. 青岛多种天气下生物气溶胶中细菌群落特征[J]. 中国海洋大学学报(自然科学版), 2021, 51(6): 88-98. |
| [25] |
胡杰, 何晓红, 李大平, 等. 鞘氨醇单胞菌研究进展[J]. 应用与环境生物学报, 2007, 13(3): 431-437. |
| [26] |
MORENS D M, FOLKERS G K, FAUCI A S. The challenge of emerging and reemerging infectious diseases[J]. Nature, 2004, 430(6996): 242-249. DOI:10.1038/nature02759 |
| [27] |
KACZOREK E, MAŁACZEWSKA J, WÓJCIK R, et al. Phenotypic and genotypic antimicrobial susceptibility pattern of Streptococcus spp.isolated from cases of clinical mastitis in dairy cattle in Poland[J]. Journal of Dairy Science, 2017, 100(8): 6442-6453. DOI:10.3168/jds.2017-12660 |
| [28] |
董玉芳. 城市农贸市场空气微生物群落特征及抗生素抗性基因污染[D]. 哈尔滨: 哈尔滨工业大学, 2014.
|
| [29] |
WU B, QIN L W, WANG M, et al. The composition of microbial aerosols, PM2.5, and PM10 in a duck house in Shandong province, China[J]. Poultry Science, 2019, 98(11): 5913-5924. DOI:10.3382/ps/pez365 |
| [30] |
苟欢歌, 谢纯斌, 童延斌, 等. 石河子市春季大气颗粒物TSP和PM10中微生物群落特征[J]. 环境工程学报, 2017, 11(4): 2343-2349. |
| [31] |
GAO X L, SHAO M F, WANG Q, et al. Airborne microbial communities in the atmospheric environment of urban hospitals in China[J]. Journal of Hazardous Materials, 2018, 349: 10-17. DOI:10.1016/j.jhazmat.2018.01.043 |



