2. 河南省南水北调中线渠首湿地生态系统野外科学观测研究站,河南南阳 473061;
3. 南阳市自然保护地和野生动植物保护中心,河南南阳 473000
2. Henan Field Observation and Research Station of Headwork Wetland Ecosystem of the Central Route of South-to-North Water Diversion Project, Nanyang, Henan, 473061, China;
3. Nanyang Nature Reserve and Wildlife Conservation Center, Nanyang, Henan, 473000, China
消落区是由于河湖、水库等水体的水位涨落引发的土地反复性淹没、裸露的区域[1, 2]。丹江口水库是南水北调中线工程的水源地[3],自2014年丹江口大坝加高且蓄水位提升至170 m以来,消落区面积大幅增加[4]。受人工调水干扰影响,大面积的缓坡消落区植被生长受抑制,生态环境极其脆弱[5-7],而消落区的植被-土壤-水体共同体作为入库水源的最后一道生态屏障,其生物地球化学循环过程和保持水土、拦截污染物的生态系统功能影响着饮用水水库的生态安全[8]。
芦苇(Phragmites australis)属我国本土的多年生大型挺水植物,具有固堤、涵养水源、调节气候、为鸟类提供栖息环境等作用[9]。丹江口水库每年8月至次年1月平均蓄水量最大[10],由于其高水位蓄水运行往往从生长季开始,至次年生长季水位下降,大量芦苇的枯落叶分解直接发生在水体内(未经历土壤分解),成为湿地生态系统棕色食物网能量和营养的重要来源[11-13],其分解过程也影响着水体的养分循环和水质安全[14-16]。消落区脆弱的生态环境导致部分芦苇种群在生长过程中抵御病害的能力下降,其中柄锈菌属(Puccinia)真菌引起的锈病在芦苇生长过程中发病率高、病害程度严重[17, 18]。感染锈病严重的芦苇常表现为叶片干枯卷曲、叶茎死亡[19]。锈病孢子可在芦苇生长季快速传播[20],大面积的锈病感染不仅直接影响芦苇群落的生物量和多样性,降低其生态服务功能,而且由于丹江口水库周期性蓄水,枯死的叶片将直接进入水体,枯落叶分解过程中的大量有机质淋溶到水体中,影响着丹江口水库的水质安全[21]。
初期淋溶作用后,微生物作为枯落叶生物降解过程的主要分解者[22],可通过释放胞外酶对枯落叶中的有机质进行矿化[23]。水体中的分解过程主要由水生丝状真菌等微生物分解者主导[24, 25],然而,这些微生物极易受到外界温度、水位变化、pH值以及新污染物等因素的影响[26, 27]。有研究表明,环境中的纳米颗粒会影响枯落物的分解和真菌孢子形成[28],如纳米氧化锌(ZnO)会影响水体枯落叶中的微生物群落结构,改变微生物的多样性和活性,抑制枯落叶的分解速率[29],也会通过改变水体的pH值来抑制水生丝状真菌繁殖,从而影响枯落叶的分解[30]。纳米ZnO由于生物相容性佳、易于合成,且具有杀菌、辅助光催化等功能,被广泛用于医疗、水体污染物的去除以及日常生活用品中[31, 32],但也影响着当下的生态环境,成为常见的水体新污染物。然而,在纳米ZnO污染的风险下,锈病将如何影响丹江口水库消落区芦苇枯落叶在水体中的分解,这一分解过程又将对水库水体造成怎样的影响,目前尚不清楚。
为此,本研究通过设置水体纳米ZnO浓度梯度,探究锈病严重的芦苇枯落叶和正常芦苇枯落叶在水体中的分解特征,剖析纳米ZnO污染和锈病对芦苇枯落叶养分释放和水质变化的影响,以期为新污染物的环境风险评估和生态安全管理提供依据,为丹江口水库消落区水生态系统安全的评价与保护提供参考。
1 材料与方法 1.1 材料 1.1.1 纳米ZnO采用50 nm规格的纳米ZnO(99.9% metals basis),购于上海瀚思化工有限公司。称取纳米ZnO粉末6 g,蒸馏水定容到500 mL,超声20 min后,磁力搅拌器搅拌10 min,以确保纳米ZnO粉末扩散开,制成浓度为12 g·L-1的纳米ZnO悬液备用。
1.1.2 芦苇枯落叶芦苇患严重锈病的枯落叶(锈病叶)和正常枯落叶均采于丹江口水库渠首地区的湿地消落区(32°41′N,111°41′E;海拔165 m)。其中,锈病叶碳、氮、磷(C、N、P)含量分别为428.01、7.864、2.86 mg·g-1,正常叶碳、氮、磷含量分别为447.75、8.490、2.83 mg·g-1,从主要有机元素的含量上看,锈病叶和正常叶的质量(化学计量比)并无明显差异。将枯落叶剪成2 cm左右的长条,宽度保持一致,称0.5 g样品分别装入盛有无菌水的小玻璃瓶中,浸泡至所有叶片充分浸湿。
1.2 方法 1.2.1 微宇宙实验设置锈病程度(锈病叶、正常叶)×纳米ZnO浓度(0、20、100、200 mg·L-1)×分解时间(4、14、30 d)的全因子实验。将浸湿后的芦苇枯落叶放入240 mL洗净的玻璃培养瓶中,加入120 mL无菌水,添加制备好的纳米ZnO悬浮液,设置浓度梯度分别为0、20、100、200 mg·L-1的微宇宙分解系统,每个处理3个重复,共72个微宇宙,无菌封口膜密封培养。微宇宙分解实验在26 ℃、60 r·min-1摇床中进行,每7 d更新1次培养液(无菌水及纳米ZnO悬浊液),分别在分解进行至第4、14和30天时对每个实验处理(锈病×纳米ZnO组合)取3个微宇宙重复,测量其枯落叶的质量损失、胞外降解酶酶活力,以及碳、氮、磷含量。同时,测定培养水体的pH值、可溶性有机碳(DOC)含量、总氮(TN)含量、总磷(TP)含量。
1.2.2 测定方法将每个微宇宙样品中的芦苇枯落叶用超纯水清洗除去残留的纳米ZnO,于45 ℃烘干至恒重,用电子天平(精确度为0.001 g)确定最终干重,凋落叶质量损失率计算公式如下:
| $ M(\%)=\left(M_{\mathrm{t}}-M_0\right) / M_0 \times 100 \%, $ |
其中,M代表质量损失率,M0和Mt分别代表分解前、后枯落叶的干重。
根据Bayer等[33]和袁亚玲[34]的酶标板法对参与枯落叶分解的8种胞外降解酶酶活力进行测定,酶特性及底物如表 1所示,酶活力统一换算为每小时每克干枯落叶水解/氧化底物的量(μmol·h-1·gDOM-1,gDOM为1 g干重的枯落叶)。枯落叶全碳测定采用重铬酸钾氧化-硫酸亚铁滴定法[35],全氮测定采用靛酚蓝比色法,全磷测定采用钼锑抗显色法[36]。降解水体微环境的酸碱度由pH计测定,可溶性有机碳测定采用Mn(Na2HP2O7)3氧化比色法[37],水体总氮测定采用过硫酸钾氧化-紫外分光光度法,水体总磷测定采用钼锑抗分光光度法[38]。
| 酶 Enzyme |
缩写 Abbreviation |
EC号 EC number |
底物 Substrate |
功能 Function |
| Cellobiohydrolase | CBH | EC 3.2.1.91 | pNP-cellobioside | Degradation of cellulose, characterizing carbon cycling |
| β-Glucosidase | BG | EC 3.2.1.21 | pNP-β-glucopyranoside | Degradation of cellulose, characterizing carbon cycling |
| Polyphenol oxidase | PPO | EC 1.10.3.2 | L-DOPA | Main enzymes for degrading lignin |
| Peroxidase | POD | EC 1.11.1.7 | L-DOPA | Main enzymes for degrading lignin |
| Leucine aminopeptidase | LAP | EC 3.4.11.1 | Leucine p-nitroani-lide | Soil microorganisms secrete enzymes that hydrolyze the N-terminus into leucine |
| β-N-acetylglucosamini-dase | NAG | EC 3.2.1.14 | pNP-β-N-acetylglucosaminide | Enzymes involved in the degradation of chitin and peptidoglycan, participating in the nitrogen cycle |
| Acid phosphatase | ACP | EC 3.1.3.2 | pNP-phosphate | Phosphorus cycle characterization |
| Alkaline phosphatase | AKP | EC 3.1.3.1 | pNP-phosphate | Phosphorus cycle characterization |
1.3 数据分析
采用三因素方差分析(Three-way ANOVA)和置换多元方差分析(PERMANOVA)检验纳米ZnO浓度、锈病、分解时间及其交互作用对芦苇枯落叶分解速率和胞外降解酶酶活力整体表现的影响,并利用Tukey多重比较分析不同实验处理间芦苇枯落叶分解速率、胞外降解酶酶活力及水体理化特性的差异。数据分析采用SPSS 26.0和R 4.3.2软件进行。
2 结果与分析 2.1 芦苇枯落叶的质量损失三因素方差分析显示,锈病叶分解速率显著高于正常叶(P < 0.01),纳米ZnO抑制了枯落叶在水体中的分解进程(P < 0.01),且二者对分解的影响有显著的交互作用(P=0.040),表现为高浓度的纳米ZnO降低了锈病叶和正常叶分解的差异,且高浓度的纳米ZnO对锈病叶分解的抑制作用更强(图 1)。此外,纳米ZnO浓度与分解时间也有显著的交互作用(P=0.027),表明不同纳米ZnO污染对不同分解进程的影响也不同,最高浓度的纳米ZnO减缓分解进程,使质量损失量随时间的变化变得更加平缓(图 1)。具体地,当仅分解4 d时,相比无污染环境,100 mg·L-1的纳米ZnO显著降低了正常叶的分解,其他浓度的纳米ZnO对枯落叶的分解均未表现出显著作用(P > 0.05);当分解进行至第14天和第30天时,纳米ZnO全面抑制了枯落叶的分解,且浓度达200 mg·L-1时对锈病叶的抑制作用更强,而20、100 mg·L-1时对正常叶的抑制作用更明显(图 1)。
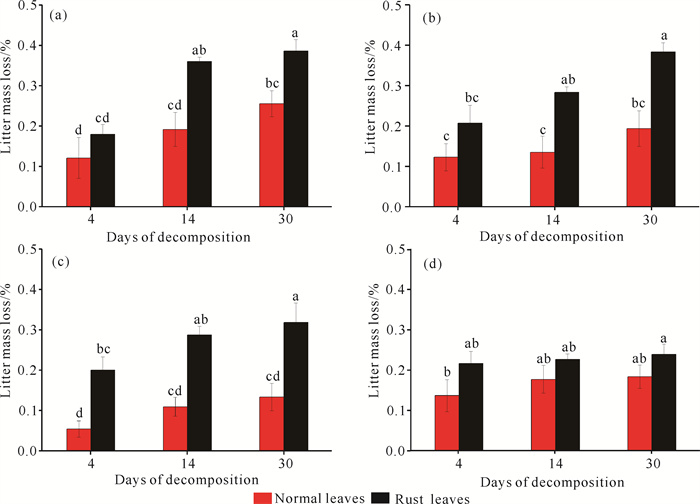
|
| (a), (b), (c), and (d) represent the litter mass loss (%, mean±SD) at concentrations of 0, 20, 100, and 200 mg·L-1 of nano-ZnO, respectively.Lowercase letters represent significant differences between different treatments (P < 0.05). 图 1 芦苇枯落叶分解质量损失变化 Fig. 1 Changes in mass loss during decomposition of reed litter |
2.2 芦苇枯落叶胞外降解酶酶活力
置换多元方差分析显示,从整体而言,锈病、分解时间、纳米ZnO浓度及其交互作用,均显著影响芦苇枯落叶上胞外降解酶的酶活力(P < 0.01),对每种酶的三因素方差分析也印证了这一结果(表 2)。具体地,在30 d的分解过程中,芦苇锈病叶8种酶的酶活力均显著高于正常叶;AKP、POD、PPO、LAP这4种酶的酶活力随分解进行呈现出先增加后减小的趋势,而BG、CBH则先减小后增大,NAG表现出持续变大的趋势;相比无污染环境,纳米ZnO浓度达200 mg·L-1时对ACP酶活力表现出极显著的抑制作用;在分解至30 d后,纳米ZnO提高了PPO、NAG、LAP的酶活力(图 2)。
| BG | CBH | NAG | LAP | PPO | POD | ACP | AKP | ||
| Time | F | 7.331 | 553.290 | 395.375 | 205.097 | 30.708 | 504.392 | 71.013 | 15.728 |
| P | 0.002 | < 0.001 | < 0.001 | < 0.001 | < 0.001 | < 0.001 | < 0.001 | < 0.001 | |
| Rust | F | 229.961 | 282.568 | 14.228 | 105.140 | 105.546 | 198.904 | 336.484 | 2.663 |
| P | < 0.001 | < 0.001 | < 0.001 | < 0.001 | < 0.001 | < 0.001 | < 0.001 | 0.109 | |
| Nano-ZnO | F | 7.459 | 17.260 | 23.136 | 46.721 | 22.452 | 74.272 | 24.036 | 19.664 |
| P | < 0.001 | < 0.001 | < 0.001 | < 0.001 | < 0.001 | < 0.001 | < 0.001 | < 0.001 | |
| Time*Rust | F | 42.148 | 65.667 | 103.363 | 26.433 | 11.092 | 81.856 | 95.776 | 4.173 |
| P | < 0.001 | < 0.001 | < 0.001 | < 0.001 | < 0.001 | < 0.001 | < 0.001 | 0.021 | |
| Time*Nano-ZnO | F | 2.999 | 44.888 | 63.302 | 44.591 | 45.935 | 49.073 | 11.960 | 5.157 |
| P | 0.014 | < 0.001 | < 0.001 | < 0.001 | < 0.001 | < 0.001 | < 0.001 | < 0.001 | |
| Rust*Nano-ZnO | F | 9.494 | 19.353 | 41.260 | 2.395 | 33.214 | 30.003 | 10.967 | 10.009 |
| P | < 0.001 | < 0.001 | < 0.001 | 0.080 | < 0.001 | < 0.001 | < 0.001 | < 0.001 | |
| Time*Rust*Nano-ZnO | F | 6.350 | 25.097 | 38.370 | 7.362 | 54.127 | 20.413 | 5.248 | 2.830 |
| P | < 0.001 | < 0.001 | < 0.001 | < 0.001 | < 0.001 | < 0.001 | < 0.001 | 0.019 | |
| Note: significant P value (< 0.05) are highlighted in bold, F is between-group variation. | |||||||||
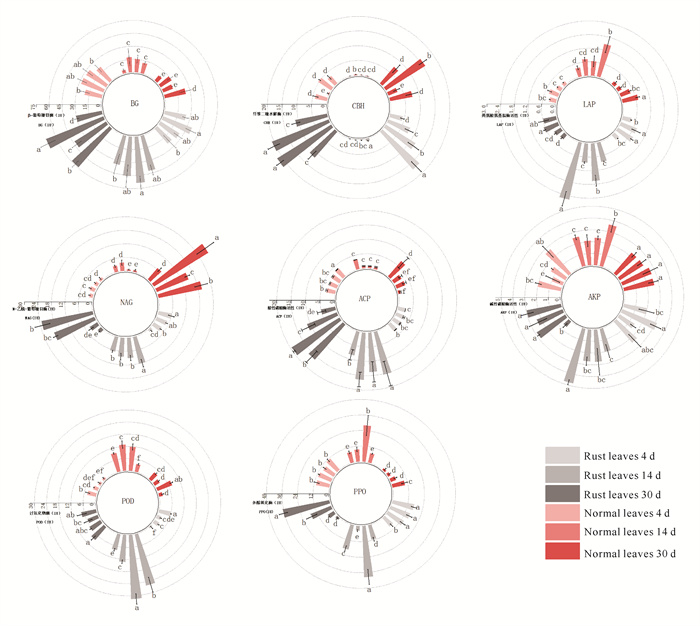
|
| The concentration gradient of nano-ZnO and the decomposition days are increased in the clockwise direction.Lowercase letters represent significant differences between different treatments (P < 0.05). 图 2 芦苇枯落叶胞外降解酶酶活力 Fig. 2 Extracellular enzyme activities of reed litter |
2.3 芦苇枯落叶碳、氮、磷含量
经过30 d的分解,芦苇锈病叶总氮含量均显著高于正常叶(P < 0.05);芦苇锈病叶C∶N显著低于正常叶(P < 0.05),而N∶P显著高于正常叶(P < 0.05),这种枯落叶化学质量的提升,可能是锈病加快叶片分解的重要原因。当纳米ZnO浓度为20 mg·L-1和100 mg·L-1时,锈病叶总磷含量显著高于正常叶(P < 0.05);而对枯落叶总碳以及C∶P而言,锈病叶和正常叶之间并未表现出显著差异。对锈病叶而言,随纳米ZnO浓度的增加,叶总氮含量以及N∶P呈显著下降趋势,而叶总磷含量在低浓度纳米ZnO污染时(20 mg·L-1)最高(图 3)。
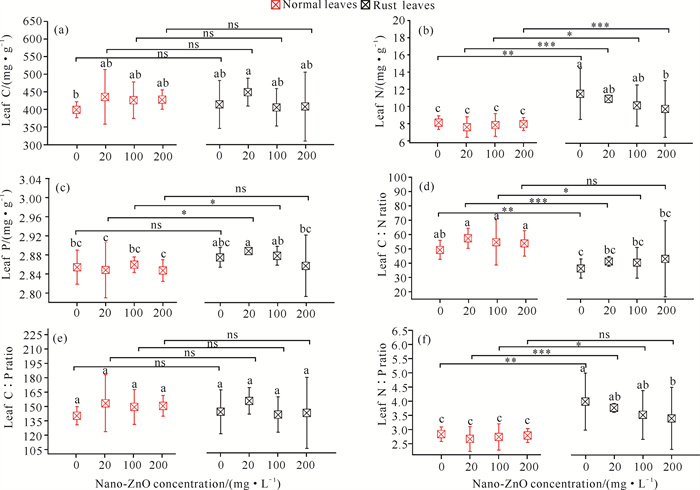
|
| Lowercase letters indicate significant differences between rust litter and normal litter at different concentrations; * * *, * *, * and ns represent the differences between rust litter and normal litter at the same concentration at the levels of P < 0.001, P < 0.01, P < 0.05, and P>0.05, respectively. 图 3 芦苇枯落叶分解30 d后营养成分的变化 Fig. 3 Changes in nutrient composition of reed litter decomposed for 30 d |
2.4 水体微环境的pH值
在30 d的枯落叶降解过程中,水体pH值为6.11-7.24,不论对于芦苇锈病叶还是正常叶,相比无纳米ZnO污染,加入纳米ZnO均显著降低了水体微环境的pH值(P < 0.05),表明其造成了水体的酸化;对于锈病叶分解而言,水体pH值随着纳米ZnO浓度的升高有所升高,但始终低于无污染对照处理。此外,在相同纳米ZnO浓度环境下,正常叶pH值高于锈病叶,且随着纳米ZnO浓度的升高,这种差异逐渐减弱(图 4)。
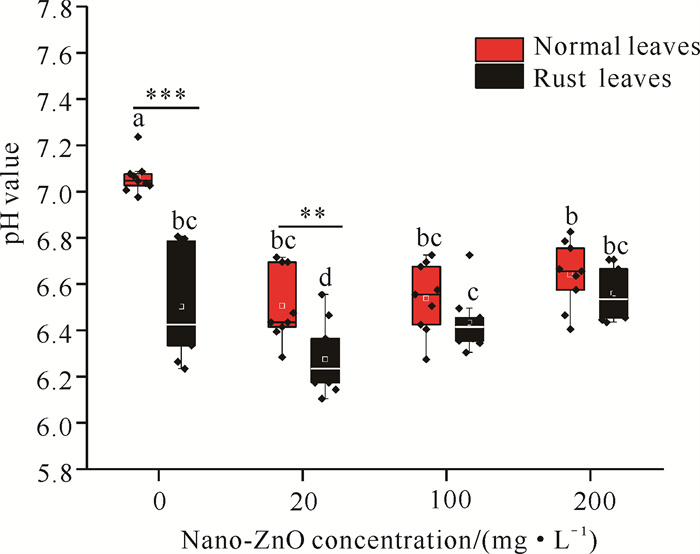
|
| Lowercase letters represent significant differences between different treatments, * * * and * * represent the difference in pH values between rust litter and normal litter at the same nano-ZnO concentration. 图 4 不同处理下水体微环境的pH值 Fig. 4 Variations in water pH value among experimental treatments |
2.5 水体中的可溶性总有机碳、总氮、总磷含量
鉴于分解实验过程中每周更新一次无菌水,水体中碳、氮、磷的含量均源自特定阶段枯落叶有机物分解所释放。在30 d的分解过程中,水体可溶性有机碳逐渐减少,可知由枯落叶分解而释放在水中的有机碳逐渐减少,且整个有机碳释放过程呈现出先快后慢的趋势。此外,在无纳米ZnO污染的环境下,分解初始阶段含锈病叶的水体中可溶性总有机碳含量显著高于正常叶,但是随分解的进行,有机碳释放到水环境中的速度下降更快。水体总氮含量随分解时间逐渐增加,且在前14 d氮素的释放速度逐渐增加,15-30 d内维持稳定。水体总磷含量相对稳定,但当分解至14 d后,相比无纳米ZnO污染的对照,高浓度的纳米ZnO抑制了枯落叶中的磷向水体中释放(图 5)。
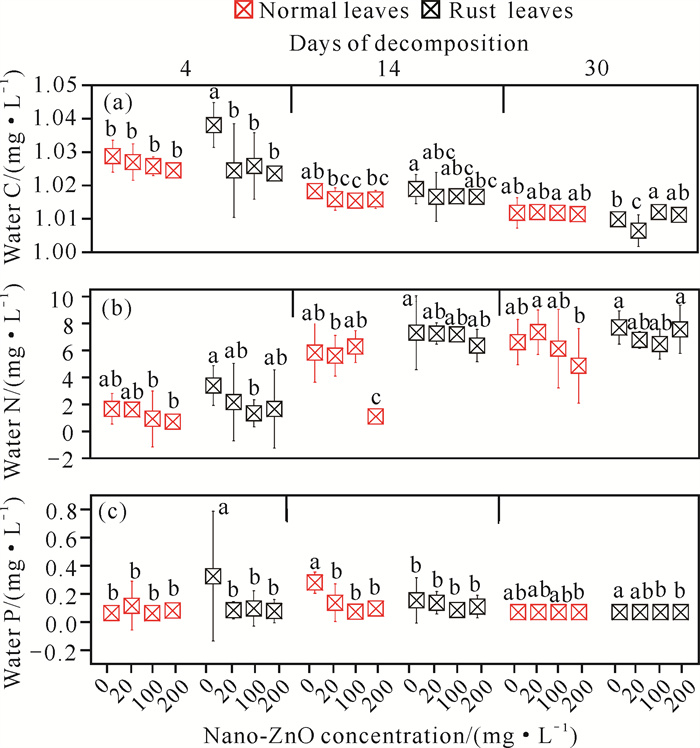
|
| Lowercase letters indicate differences at the same decomposition time. 图 5 枯落叶分解过程水环境中可溶性有机碳、总氮和总磷含量的变化 Fig. 5 Dynamics of organic C, total N and total P in water during litter decomposition |
3 讨论 3.1 纳米ZnO影响下锈病发生对芦苇枯落叶分解的影响
在相同外界环境条件下,枯落叶的分解速率受其自身因素(C∶N、木质素含量等)和分解者能力的影响[39, 40]。本研究发现正常和严重感染锈病的芦苇枯落叶的主要营养元素含量并无明显差异,推测锈病叶分解速率更快,可能是由于其改变了叶际分解者微生物群落结构导致,进而引发入水后分解者活性存在差异。枯落叶上微生物胞外酶酶活力会随着底物成分和非生物水环境的改变而发生不同程度的变化,并反过来影响芦苇枯落叶的分解,因此可用来衡量真菌的代谢活性和降解功能[41]。从分解过程中胞外酶酶活力的表现来看,锈病叶分解整体上有更高的酶活力(图 2),这也反映了其有更高的分解者活性。这种锈病对叶际微生物的改变可能是直接的,如微生物群落的互作关系致使叶际腐生菌成分变多[42];也可能是间接的,如患病后导致植物抵御病原菌的特定生理表现(组织结构、代谢产物等)变弱[43],进而影响定植其上的微生物群落,此间的具体机制有待进一步探究和证明。有研究表明,纳米氧化铜(CuO)污染下胞外酶酶活力会因为水体微生物的质膜损伤或DNA链断裂而受到抑制[44, 45],并推测纳米ZnO也具有类似的功能[46]。在本研究中高浓度的纳米ZnO污染降低了枯落叶在水体中的分解速率,且整体上污染水体的酶其酶活力也较低,说明高浓度的纳米ZnO对微生物分解者活性具有抑制作用。这证实了新污染物纳米ZnO会影响水生态分解系统。值得注意的是,这种抑制作用对正常叶的影响较弱,而对锈病叶的影响更大,致使纳米ZnO污染环境下锈病叶和正常叶分解速率的原有差别被弱化了,表明纳米ZnO对水生态分解系统的影响是复杂的,对枯落叶分解效果具有环境依赖性,未来评价其对生态环境的影响时需要纳入考虑。
此外,虽然正常叶和严重锈病叶的主要营养元素碳、氮、磷含量差别不大,但可能二者在其他微量元素,以及大分子机械性结构组成上存在差异,如锈病在叶片上形成锈色孢子堆,在萌发初期可通过气孔或者穿透方式直接侵入到叶片内部吸取营养[47],从而影响植物光合作用以及叶肉细胞的完整性[48],破坏叶片的组织结构,也使得叶片更容易被微生物入侵而有利于启动分解。本研究也发现锈病叶在质感上更柔软,可能是锈病的侵害会导致叶片组织的抵御性机械结构成分(革质、木质纤维素等)变得更纤弱,有利于微生物的分解[49],这种具体成分结构上的差异及其对后续分解的影响有待进一步探究。最后,残留枯落叶在分解过程中碳、氮、磷化学计量比和胞外降解酶酶活力的变化显示,纳米ZnO污染环境中锈病发生对枯落叶分解的影响,在不同的分解时间和进程也会有不同的表现。
3.2 枯落叶分解对水体微环境的影响纳米ZnO污染使得水体pH值降低,这与Du等[50]的研究结果一致,表明这种新污染物可能会导致水体酸化风险的增加,这可能是由于纳米ZnO在水体中聚集、沉淀以及溶解等一系列活动导致[51, 52]。在分解初期,枯落叶的非结构性碳水化合物极易被降解,因此大量小分子水溶性有机碳会溶于水体,使得分解前期枯落物碳呈现出快速淋溶的特点[53],这与分解4 d时的结果一致。本研究所观测到的水体中的可溶性有机质均来自芦苇枯落叶的分解和养分的释放,每周更新水体培养环境(更新蒸馏水及其制备的纳米ZnO溶液),可以对不同分解阶段枯落叶养分释放规律进行比较研究。随分解时间的增加,环境水体中水溶性有机碳逐渐减少,表明枯落叶的分解减缓,这主要是枯落叶中结构性有机碳大多都是较难分解的成分所造成[54]。而在无纳米ZnO污染的环境下,初始阶段含锈病叶的水体中可溶性总有机碳含量显著高于正常叶,这可能是锈病的发生导致芦苇生长受抑制,蛋白质和其他细胞成分被有效水解并从叶片中去除,从而造成芦苇枯落叶大量的质量损失,同时也增加了水体的可溶性物质[55]。
此外,锈病叶水体总氮含量随分解时间增加而逐渐增加,且在4-14 d的过程中大幅增加,表明除入水后的直接淋溶作用外,芦苇枯落叶有机氮的分解与释放在这一阶段逐渐开始,随后保持稳定;而磷元素主要构成DNA和细胞膜等结构,在叶片枯落前,细胞内的一些重要元素会被降解然后转移重新吸收,在该过程中DNA和细胞膜等处的有机磷会被降解成无机态的磷再转移吸收,未被转移的无机态磷也继续溶出[56],相对于碳、氮而言,磷元素的溶解性较大,因此,在分解的30 d中,磷元素的溶解过程相对稳定。在分解14 d后,高浓度的纳米ZnO抑制了枯落叶磷元素的释放,这可能是因为高浓度纳米ZnO中的Zn2+会吸附在细菌细胞膜上,破坏细菌细胞膜的通透性或是诱导活性氧(ROS)产生,破坏细胞膜的完整性[45],从而导致磷元素的释放速率下降。
综上,锈病的发生会加快枯落叶的分解进程,在丹江口水库消落区的芦苇锈病叶若不能得到有效控制,其分解释放的营养元素将在反复的裸露和淹没过程中随水体入库,从而导致淡水生态系统污染甚至富营养化,威胁饮用水源生态安全。而水源涵养区的纳米ZnO污染虽然会对锈病枯落叶分解产生一定的抑制作用,但其对分解系统的影响仍待进一步评估,尤其是纳米ZnO对分解者微生物活性的抑制作用所造成的影响尚不明确,且其增加了水体酸化的风险,因此其对淡水生态系统健康的影响和评价需做更深入的研究。
4 结论不同浓度的纳米ZnO对芦苇锈病叶和正常叶的分解产生不同程度的影响。首先,纳米ZnO抑制了枯落叶的分解,其中,浓度为200 mg·L-1的纳米ZnO对锈病叶的抑制作用更强,而20 mg·L-1和100 mg·L-1的纳米ZnO对正常叶的抑制作用更显著。其次,与枯落叶分解相关的胞外降解酶的酶活力也受到纳米ZnO和锈病发生的影响。最后,纳米ZnO的暴露以及锈病枯落叶的分解均改变了水体微环境的pH值,增加了水体的可溶性有机碳和总氮含量。本研究揭示了纳米ZnO的暴露以及丹江口水库消落区芦苇锈病的发生对水库淡水生态系统安全的潜在影响,也为其消落区的养分循环管控提供了有力证据:水源涵养区锈病泛滥会导致植物叶片提早变黄和枯萎,水淹后增加水体的枯落叶输入量,不论是否存在新污染物纳米ZnO的抑制作用,都会加快芦苇枯落叶的分解进程。因此,在消落区生态恢复过程中引入抗锈病的芦苇品种以及加强后期芦苇密度管理等,更有利于消落区的生态恢复和水源生态安全。
| [1] |
SHI W J, DU M, YE C, et al. Divergent effects of hydrological alteration and nutrient addition on greenhouse gas emissions in the water level fluctuation zone of the Three Gorges Reservoir, China[J]. Water Research, 2021, 201: 117308. DOI:10.1016/j.watres.2021.117308 |
| [2] |
YIN J, LIU H, CHEN X L. Dynamic change in the water-level fluctuation zone of the Danjiangkou Reservoir and its influence on water quality[J]. Sustainability, 2018, 10(4): 1025. DOI:10.3390/su10041025 |
| [3] |
肖玉娜, 程靖华, 莫晓聪, 等. 丹江口水库浮游植物群落时空变化及其与环境因子的关系[J]. 湖泊科学, 2023, 35(3): 821-832. |
| [4] |
董磊, 吴敏, 林莉, 等. 南水北调中线工程对丹江口水库浮游植物群落结构影响[J]. 环境科学与技术, 2021, 44(S1): 1-7. |
| [5] |
王超, 张洪, 雷俊山, 等. 南水北调中线水源地陡坡型库岸生态屏障构建[J]. 环境工程学报, 2020, 14(12): 3243-3250. DOI:10.12030/j.cjee.202002170 |
| [6] |
樊大勇, 熊高明, 张爱英, 等. 三峡库区水位调度对消落带生态修复中物种筛选实践的影响[J]. 植物生态学报, 2015, 39(4): 416-432. |
| [7] |
郭燕, 杨邵, 沈雅飞, 等. 三峡水库消落带现存植物自然分布特征与群落物种多样性研究[J]. 生态学报, 2019, 39(12): 4255-4265. |
| [8] |
RAN Y G, WANG P, YE F, et al. Patterns and drivers of organic carbon in hydromorphic soils across inland aquatic-terrestrial ecotones at the global scale[J]. Catena, 2024, 244: 108266. DOI:10.1016/j.catena.2024.108266 |
| [9] |
PACKER J G, MEYERSON L A, SKÁLOVÁ H, et al. Biological flora of the British Isles: Phragmites australis[J]. Journal of Ecology, 2017, 105(4): 1123-1162. DOI:10.1111/1365-2745.12797 |
| [10] |
LIU H, YIN J, FENG L. The dynamic changes in the storage of the Danjiangkou Reservoir and the influence of the south-north water transfer project[J]. Scientific Reports, 2018, 8(1): 8710. DOI:10.1038/s41598-018-26788-5 |
| [11] |
MARKS J C. Revisiting the fates of dead leaves that fall into streams[J]. Annual Review of Ecology, Evolution, and Systematics, 2019, 50: 547-568. DOI:10.1146/annurev-ecolsys-110218-024755 |
| [12] |
WALLACE J B, EGGERT S L, MEYER J L, et al. Multiple trophic levels of a forest stream linked to terrestrial litter inputs[J]. Science, 1997, 277(5322): 102-104. DOI:10.1126/science.277.5322.102 |
| [13] |
ZHANG M H, CHENG X L, GENG Q H, et al. Leaf litter traits predominantly control litter decomposition in streams worldwide[J]. Global Ecology and Biogeography, 2019, 28(10): 1469-1486. DOI:10.1111/geb.12966 |
| [14] |
BIASI C, GRAÇA M A S, SANTOS S, et al. Nutrient enrichment in water more than in leaves affects aquatic microbial litter processing[J]. Oecologia, 2017, 184(2): 555-568. DOI:10.1007/s00442-017-3869-5 |
| [15] |
李艳晖, 王瑜, 李砧, 等. 白蜡凋落叶在水体中的分解及对水质的影响[J]. 东北林业大学学报, 2020, 48(12): 38-40, 51. DOI:10.3969/j.issn.1000-5382.2020.12.007 |
| [16] |
豆鹏鹏, 林敦梅, 王芳, 等. 三峡库区城市富营养化河流凋落物的混合分解效应[J]. 中国环境科学, 2021, 41(8): 3775-3783. DOI:10.3969/j.issn.1000-6923.2021.08.035 |
| [17] |
杨文成. 芦苇锈病及其防治[J]. 湖北农业科学, 1995, 34(5): 49-50. |
| [18] |
BAKA Z A M. Occurrence of Puccinia isiacae on Phragmites australis in Saudi Arabia and its possibility as a biological control agent[J]. Microbiological Research, 2004, 159(3): 175-179. DOI:10.1016/j.micres.2004.01.015 |
| [19] |
薛龙海, 刘佳奇, 李春杰. 披碱草属真菌病害研究进展[J]. 草业学报, 2024, 33(2): 226-241. |
| [20] |
YOU Y, LIAO J H, HE Z M, et al. Effects of peanut rust disease (Puccinia arachidis Speg.) on agricultural production: current control strategies and progress in breeding for resistance[J]. Genes (Basel), 2024, 15(1): 102. DOI:10.3390/genes15010102 |
| [21] |
赵勇, 苗蕾, 孙聪楠, 等. 树木枯落叶在河流水体中的分解及氮、磷释放动态[J]. 水土保持学报, 2010, 24(1): 172-175. |
| [22] |
ZHAO B Y, XING P, WU Q L. Interactions between bacteria and fungi in macrophyte leaf litter decomposition[J]. Environmental Microbiology, 2021, 23(2): 1130-1144. DOI:10.1111/1462-2920.15261 |
| [23] |
高岩, 李志斐, 刘阳, 等. 草型湖泊水生植物残体的生物降解研究进展[J]. 中国农学通报, 2022, 38(15): 53-59. DOI:10.11924/j.issn.1000-6850.casb2021-0707 |
| [24] |
SEENA S, GUTIÉRREZ I B, BARROS J, et al. Impacts of low concentrations of nanoplastics on leaf litter decomposition and food quality for detritivores in streams[J]. Journal of Hazardous Materials, 2022, 429: 128320. DOI:10.1016/j.jhazmat.2022.128320 |
| [25] |
GESSNER M, GULIS V, KUEHN K, et al. Fungal decomposers of plant litter in aquatic ecosystems[M]//KUBICEK C, DRUZHININA I (eds). Environmental and Microbial Relationships. The Mycota, Vol 4. Berlin, Heidelberg: Springer, 2007: 301-324.
|
| [26] |
VORÍŠKOVÁ J, BALDRIAN P. Fungal community on decomposing leaf litter undergoes rapid successional changes[J]. The ISME Journal, 2013, 7(3): 477-486. DOI:10.1038/ismej.2012.116 |
| [27] |
FERREIRA V, RAPOSEIRO P M, PEREIRA A, et al. Leaf litter decomposition in remote oceanic island streams is driven by microbes and depends on litter quality and environmental conditions[J]. Freshwater Biology, 2016, 61(5): 783-799. DOI:10.1111/fwb.12749 |
| [28] |
JAIN A, KUMAR S, SEENA S. Can low concentra- tions of metal oxide and Ag loaded metal oxide nanoparticles pose a risk to stream plant litter microbial decomposers?[J]. Science of the Total Environment, 2019, 653: 930-937. DOI:10.1016/j.scitotenv.2018.10.376 |
| [29] |
DU J J, ZHANG Y Y, YIN Y T, et al. Do environmental concentrations of zinc oxide nanoparticle pose ecotoxicological risk to aquatic fungi associated with leaf litter decomposition?[J]. Water Research, 2020, 178: 115840. DOI:10.1016/j.watres.2020.115840 |
| [30] |
DU J J, ZHANG Y Y, LIU L N, et al. Can visible light impact litter decomposition under pollution of ZnO nanoparticles?[J]. Chemosphere, 2017, 187: 368-375. DOI:10.1016/j.chemosphere.2017.08.128 |
| [31] |
韩晨, 吕纯懿, 王腾, 等. 纳米氧化锌抗血液肿瘤的药理作用及机制研究进展[J]. 药物评价研究, 2024, 47(2): 438-443. |
| [32] |
AREMU O H, AKINTAYO C O, NAIDOO E B, et al. Synthesis and applications of nano-sized zinc oxide in wastewater treatment: a review[J]. International Journal of Environmental Science and Technology, 2021, 18(10): 3237-3256. DOI:10.1007/s13762-020-03069-1 |
| [33] |
BAYER E A, BEN-HUR H, WILCHEK M. Colorimetric enzyme assays for avidin and biotin[J]. Methods in Enzymology, 1990, 184: 217-223. |
| [34] |
袁亚玲. 马尾松与阔叶树种混合凋落叶分解的酶活性特征[D]. 雅安: 四川农业大学, 2018.
|
| [35] |
刘昌岭, 朱志刚, 贺行良, 等. 重铬酸钾氧化-硫酸亚铁滴定法快速测定海洋沉积物中有机碳[J]. 岩矿测试, 2007, 26(3): 205-208. DOI:10.3969/j.issn.0254-5357.2007.03.008 |
| [36] |
鲍士旦. 土壤农化分析[M]. 3版. 北京: 中国农业出版社, 2000.
|
| [37] |
占新华, 周立祥. 土壤溶液和水体中水溶性有机碳的比色测定[J]. 中国环境科学, 2002, 22(5): 433-437. DOI:10.3321/j.issn:1000-6923.2002.05.013 |
| [38] |
国家环境保护总局, 《水和废水监测分析方法》编委会编. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2002.
|
| [39] |
YANG K, ZHU J J, ZHANG W W, et al. Litter decomposition and nutrient release from monospecific and mixed litters: comparisons of litter quality, fauna and decomposition site effects[J]. Journal of Ecology, 2022, 110(7): 1673-1686. DOI:10.1111/1365-2745.13902 |
| [40] |
KELLER A B, PHILLIPS R P. Leaf litter decay rates differ between mycorrhizal groups in temperate, but not tropical, forests[J]. New Phytologist, 2019, 222(1): 556-564. DOI:10.1111/nph.15524 |
| [41] |
杜京京, 崔明会, 张玉燕, 等. 纳米氧化锌对凋落物降解微生物群落结构和代谢功能的影响[J]. 生态毒理学报, 2018, 13(2): 149-158. |
| [42] |
GONG T Y, XIN X F. Phyllosphere microbiota: community dynamics and its interaction with plant hosts[J]. Journal of Integrative Plant Biology, 2021, 63(2): 297-304. DOI:10.1111/jipb.13060 |
| [43] |
ZHANG Y X, CAO B, PAN Y M, et al. Metabolite-mediated responses of phyllosphere microbiota to rust infection in two Malus species[J]. Microbiology Spectrum, 2023, 11(2): e0383122. DOI:10.1128/spectrum.03831-22 |
| [44] |
杨裕然, 张灿, 李振轮. ZnO和CuO纳米颗粒对废水生物处理的影响及缓解毒性的研究进展[J]. 生物工程学报, 2023, 39(3): 1026-1039. |
| [45] |
PRADHAN A, SEENA S, SCHLOSSER D, et al. Fungi from metal-polluted streams may have high ability to cope with the oxidative stress induced by copper oxide nanoparticles[J]. Environmental Toxicology and Chemistry, 2015, 34(4): 923-930. DOI:10.1002/etc.2879 |
| [46] |
DU J J, ZHANG Y Y, CUI M H, et al. Evidence for negative effects of ZnO nanoparticles on leaf litter decomposition in freshwater ecosystems[J]. Environmental Science: Nano, 2017, 4(12): 2377-2387. DOI:10.1039/C7EN00784A |
| [47] |
沈阔程, 陈倩文, 齐梅, 等. 杨树叶片结构与抗锈菌侵染的相关性[J]. 林业科学, 2020, 56(12): 75-82. DOI:10.11707/j.1001-7488.20201209 |
| [48] |
GORTARI F, GUIAMET J J, GRACIANO C. Plant-pathogen interactions: leaf physiology alterations in poplars infected with rust (Melampsora medusae)[J]. Tree Physiology, 2018, 38(6): 925-935. DOI:10.1093/treephys/tpx174 |
| [49] |
李陈莹, 王冉, 梁岩. 维管束木质化调控植物抗青枯病的研究进展[J]. 浙江大学学报(农业与生命科学版), 2023, 49(5): 633-643. |
| [50] |
DU J J, ZHANG Y Y, GUO R L, et al. Harmful effect of nanoparticles on the functions of freshwater ecosystems: insight into nanoZnO-polluted stream[J]. Chemosphere, 2019, 214: 830-838. DOI:10.1016/j.chemosphere.2018.09.171 |
| [51] |
HAN Y, KIM D, HWANG G, et al. Aggregation and dissolution of ZnO nanoparticles synthesized by different methods: influence of ionic strength and humic acid[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2014, 451: 7-15. |
| [52] |
王宁, 刘丹, 谢敏伟, 等. 水环境中纳米氧化锌的环境行为及生物毒性研究进展[J]. 环境化学, 2016, 35(12): 2528-2534. DOI:10.7524/j.issn.0254-6108.2016.12.2016060601 |
| [53] |
陈家琛, 左晓东, 陈立, 等. 间伐对杉木人工林凋落物分解和养分释放速率的影响[J]. 西北林学院学报, 2023, 38(2): 119-125. DOI:10.3969/j.issn.1001-7461.2023.02.16 |
| [54] |
ZHU J J, WU Q X, WU F Z, et al. Decline in carbon decomposition from litter after snow removal is driven by a delayed release of carbohydrates[J]. Plant and Soil, 2022, 481(1): 83-95. |
| [55] |
STUART CHAPIN Ⅲ F, KEDROWSKI R A. Seasonal changes in nitrogen and phosphorus fractions and autumn retranslocation in evergreen and deciduous taiga trees[J]. Ecology, 1983, 64(2): 376-391. DOI:10.2307/1937083 |
| [56] |
豆鹏鹏, 王芳, 马瑜, 等. 叶凋落物碳、氮和磷元素对模拟淋溶的响应[J]. 科学通报, 2018, 63(30): 3114-3123. |



