2. 广西科学院生物研究所有限责任公司, 广西南宁 530007;
3. 南宁学院食品与质量工程学院, 广西南宁 530200;
4. 广西大学轻工与食品工程学院, 广西南宁 530004
2. Biology Institute, Guangxi Academy of Sciences Co., Ltd., Nanning, Guangxi, 530007, China;
3. College of Food and Quality Engineering, Nanning University, Nanning, Guangxi, 530200, China;
4. College of Light Industry and Food Engineering, Guangxi University, Nanning, Guangxi, 530004, China
农作物在生长过程中,会不断消耗土壤的养分。尽管通过作物轮作以及施用有机肥的方法可以在一定程度上确保产量,然而,土壤退化的问题依旧难以完全避免[1]。近年来,国内外广泛认为还田是农业残余物处理的首选方式,这主要是因为其能够避免焚烧农业残余物产生的烟雾粉尘对环境造成污染[2]。此外,农业残余物中富含有机质和营养元素,例如蛋白质、果胶、微量元素等,这些物质经过分解后可以为土壤补充所需养分,减少化肥的使用量[3]。农业残余物还田是一种可持续的农业生产方式,对实现农业的绿色发展具有重要意义。鉴于此,我国政府已制定政策对其进行大力推广[4]。
目前已有研究表明农业残余物还田可改良土壤成分,使农作物保收或增产[5]。石温慧等[6]将苕子和二月兰还田,提高了土壤的团聚体稳定性和抗蚀性,有效改善了土壤结构。杨丽荣等[7]将棉花秸秆还田后,土壤中的有效氮、磷和钾含量得到提升,使小麦的有效穗数增加,实现了增产。王晶等[8]将小麦秸秆还田后种植玉米、将玉米秸秆还田后轮作种植小麦,显著提高了土壤中氮、磷、钾及有机质的含量,同时也增强了土壤蔗糖酶活性和物种多样性,最终将小麦和玉米产量分别提高了2.04%-10.16%和2.20%-6.43%。赫兵等[9]将水稻秸秆连续两年水耙浆还田,使土壤中的有机质含量增加了6.1 g/kg,水稻产量提高了4.9%。然而,无论在何种土壤中以何种方式进行还田,农业残余物的腐熟进程都较缓慢,难以实现土壤质量的快速改善。李忠义等[10]将夏季豆科绿肥品种猫豆和赤小豆的藤叶在赤红壤耕地采用不同方式还田100 d后测定土壤成分变化,结果发现无论是翻压还田还是免耕覆盖还田的方式,土壤中碳、氮、磷和钾的养分累积释放率均处于60%-90%,未达完全腐熟。吕凯飞等[11]在典型的石灰岩红壤耕地采用不同方式将玉米秸秆还田后种植辣椒和玉米,虽然在还田不同时间后土壤成分、紧实度、剪切力和容积率等指标均有所改善,也实现了农作物增产,但是玉米秸秆完全腐熟的时间长达3年之久。
多位研究者致力于探索在农业残余物中添加外源微生物菌剂[12],利用其产生的酶促进腐熟进程。然而,目前研究者的关注点多集中于产纤维素酶和木聚糖酶的微生物菌剂[13,14],对产其他酶的微生物菌剂的关注不足。植物细胞壁的主要成分是纤维素、半纤维素、木质素和蛋白质等,这些成分相互之间形成复杂结构,对细胞壁的刚性起着重要贡献[15],而添加相应水解酶的菌剂可以促进植物组织的降解。果胶作为植物细胞壁的重要成分之一,其有效降解对还田腐熟进程十分关键。果胶是一类由半乳糖醛酸通过α-1,4糖苷键连接构成的链状生物大分子,在植物细胞结构中起黏附的作用。当分布在细胞壁中时,果胶可与纤维素、半纤维素等形成网络结构,参与构成植物细胞壁;而分布在中胶层中时,果胶则对植物细胞之间的粘连起主要作用[16]。果胶的降解能够使植物细胞松散,增加纤维素、木聚糖等生物大分子与相应水解酶的可及性[17]。因此,有必要筛选高效的产果胶酶微生物并鉴定其酶学特性。
植物落叶是一种重要的残余物,具有可持续产生、储量丰富和结构松散等优点,因而成为还田的理想材料之一[18]。此外,树叶的果胶含量颇高,不同种类树叶的果胶含量可达干重的20%-40%[19]。然而,当前对植物落叶酶解的研究较少,且已有研究涉及的植物落叶种类也十分有限。玉兰是株高叶茂的落叶乔木,在热带亚热带国家和地区被大量种植,其品种繁多、花型丰富、花香清新宜人,因此也被广泛用作行道树和观赏植物[20]。然而,目前玉兰落叶并未实现资源化利用,大多被当作垃圾进行处理。鉴于此,本研究拟从土壤中筛选产果胶酶的微生物,测定其所产果胶酶的酶学性质,并将其用于白玉兰(Magnolia denudata)落叶的水解,以期为植物叶片的还田水解提供参考。
1 材料与方法 1.1 材料 1.1.1 样品处理橘子皮富含果胶,其果胶含量可达干重的30%[21],因此本研究选用橘子皮粉作为培养基的主要碳源。将新鲜橘子皮切条后在50 ℃烘干2 d至恒重,用小型植物组织粉碎机粉碎并过60目筛网,所得粉末用于配制培养基。白玉兰落叶采自广西科学院内,在50 ℃烘干2 d至恒重后粉碎,过60目筛网,所得粉末用作水解实验的底物。
1.1.2 药品和试剂聚半乳糖醛酸、半乳糖醛酸购买自上海阿拉丁生化科技股份有限公司。所有化学药品均为分析纯级别。基因组DNA提取试剂盒购买自天根生化科技(北京)有限公司,扩增内转录间隔区(Internal Transcript Spacer,ITS)所用试剂2×Phanta Max Master Mix为南京诺唯赞生物科技股份有限公司所产。
1.1.3 主要仪器设备恒温摇床(上海智城分析仪器制造有限公司)、Infinite 2000酶标仪(Tecan公司,瑞士)、T-Gradient Thermoblock PCR仪(Biometra公司,德国)、Centrifuge 5415D小型常温离心机(Eppendorf公司,德国)、超净工作台(苏州净化设备有限公司)、HICLAVE高压灭菌锅(Saitama-ken公司,日本)、Nikon YS100显微镜(尼康株式会社,日本)、SPX-250B-Z生化培养箱(上海博迅实业有限公司医疗设备厂)、卧式低温冷柜(青岛海尔医用低温科技有限公司)。
1.1.4 培养基分离培养基:配方见文献[22],所不同的是以橘子皮粉替代可溶性淀粉,其他成分相同。具体为橘子皮粉10 g/L,胰蛋白胨5 g/L,K2HPO4 3 g/L,(NH4)2SO4 2.5 g/L,MgSO4·7H2O 0.2 g/L,CaCl2 0.1 g/L,FeSO4 0.025 5 g/L,琼脂粉30 g/L,pH值为5.0。
筛选培养基为不含琼脂粉的分离培养基。
察氏培养基:蔗糖30 g/L,NaNO3 3 g/L,K2HPO4·3H2O 1.3 g/L,MgSO4·7H2O 0.5 g/L,KCl 0.5 g/L,FeSO4·7H2O 0.01 g/L,ZnSO4·7H2O 0.01 g/L,pH值为7.0,琼脂粉15 g/L。
1.2 菌株的分离纯化将1 g土壤样品(采自南宁学院花圃)分散至10 mL灭菌水中,充分摇匀,取浊液以10倍为梯度稀释,每个梯度所得稀释液取50 μL涂布于分离培养基平板上。将平板放置于28 ℃培养箱中静置培养5 d后观察所获得的单菌落。
1.3 菌株的种属鉴定制作菌株的孢子悬浮液,将悬浮液以三点式点接种至察氏培养基平板,在28 ℃培养5 d并观察其菌落形态。使用Nikon YS100显微镜观察孢子头和孢子形态(目镜10倍,物镜40倍)。取使用筛选培养基在28 ℃培养3 d获得的菌丝体,用液氮研磨的方法将细胞破碎,参照试剂盒说明书提取基因组DNA。使用ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)引物扩增内转录间隔区[23],并将获得的扩增产物送至北京奥科鼎盛生物科技公司进行测序。将测得的序列在NCBI网站进行Nucleotide BLAST,并将测得的序列与相近物种进行发育建树(Mega软件,执行neighbor-joining功能)以分析亲缘关系,确定目标菌株的种属。
1.4 酶活力的测定挑取1.2节中的单菌落接种至筛选培养基(250 mL的三角瓶装液50 mL),在28 ℃、200 r/min摇床培养5 d。培养液经10 000 r/min离心1 min后,取上清液加入1.5 mL EP管中,采用3,5-二硝基水杨酸(DNS)法测定其果胶酶粗酶活力[24]。反应体系为350 μL含0.5%聚半乳糖醛酸(W/V)的0.1 mol/L柠檬酸-磷酸氢二钠缓冲液(pH值为4.5)和50 μL粗酶液,在50 ℃水浴反应10 min后加入0.8 mL DNS试剂,沸水浴5 min后取出EP管,冷却至室温,使用酶标仪在540 nm处测定吸光值。DNS试剂配方[22]:四水合酒石酸钾钠200 g/L,NaOH 25 g/L,DNS 10 g/L,结晶酚2 g/L,Na2SO3 0.5 g/L。1个单位酶活力定义为每分钟水解底物释放出1 μmol产物所需的酶量。果胶酶粗酶酶活力参照以半乳糖醛酸为标准物建立的标准曲线计算。
1.5 酶学性质 1.5.1 最适作用pH值使用0.1 mol/L柠檬酸-磷酸氢二钠缓冲液配制pH值为3.0-6.5的反应液,反应液中含0.5%聚半乳糖醛酸,测定果胶酶粗酶酶活力。最高酶活力时的pH值即为最适作用pH值,该酶活力为100%酶活力,其余酶活力比照为相对酶活力。
1.5.2 最适作用温度在最适作用pH值下测定果胶酶粗酶液在35-65 ℃下的活力,最高活力时的温度即为最适作用温度,该酶活力为100%酶活力,其余酶活力比照为相对酶活力。
1.5.3 pH稳定性将粗酶液置于0.1 mol/L pH值3.0-9.0的缓冲液中,在25 ℃保温24 h后测定残余酶活力。以没有进行处理的粗酶液的酶活力为100%酶活力,进行处理后粗酶液的酶活力比照为相对酶活力。配置不同的pH值反应液所用到的缓冲液分别为pH值3.0-7.0,柠檬酸-Na2HPO4;pH值7.0-9.0,Tris-HCl缓冲液;pH值9.0-12.0,甘氨酸-NaOH缓冲液。
1.5.4 热稳定性将粗酶液在不同温度下保温15、30、45和60 min后测定酶活力。以不经保温处理的粗酶液的酶活力为100%酶活力,保温处理后的粗酶液的活力比照为相对酶活力。
1.5.5 金属离子对酶活力的影响在反应体系中分别添加1、2和5 mmol/L的各种氯离子金属盐(Li+、Na+、Mg2+、K+、Ca2+、Mn2+、Fe2+、Fe3+、Co2+、Cu2+和Zn2+)和EDTA-Na2,测定粗酶液在金属盐存在时的酶活力。以不添加金属盐时的酶活力为100%酶活力,添加金属盐后测得的酶活力比照为相对酶活力。
1.6 白玉兰落叶的酶解温度对果胶酶水解落叶的影响:以双蒸水配制10 g/L的落叶粉末,参照1.5节中“最适作用温度”的方法进行实验。为了模拟自然界的水解环境,该酶解实验不采用缓冲液。
加酶量对果胶酶水解落叶的影响:取不同酶量的粗酶液(0、1、3、6、15、60 U/g)在30 ℃水解10 g/L的落叶粉末,酶解时间为6 h。
以DNS法测定酶水解前后体系中还原性物质的含量,酶水解后体系中还原性物质的含量减去体系中原有还原性物质的含量后计算每单位果胶酶水解所得还原性物质的含量。以酶水解前的原有量为100%,果胶酶对落叶的水解效率定义为水解后的增加量除以原有量得到水解后的倍数。
1.7 数据处理每个数据点均设定3个平行操作,所得结果使用Excel软件计算平均值和标准偏差并作图。每一项酶学性质均独立测定3次,所测数据的相对标准偏差(Relative Standard Deviation,RSD)小于5%时,表明测定结果可重复且可信。
2 结果与分析 2.1 菌株的筛选和种属鉴定目标菌株在察氏培养基平板上的初生菌丝为白色,大约培养2 d后开始分化出孢子,此时菌落的颜色开始变深,在培养5 d后菌落颜色为淡绿色[图 1(a)]。目标菌株的生长速度较快,培养5 d后菌落半径达3 cm。其菌落质地较为疏松,且不均一,菌丝疏密相间,形成圈状同心圆。菌落中心处有少量白色细绒毛产生。未见液滴和赘生物产生。此外,菌落中心密集区域的背面稍黄,但从平板正面和背面均可以看出没有明显色素分泌[图 1(b)]。气生菌丝顶端膨大,分生孢子为圆形或近圆形[图 1(c)]。基于以上特征,推测该菌株或为曲霉属(Genus Aspergillus)黄绿组(Section Flavi)的物种。
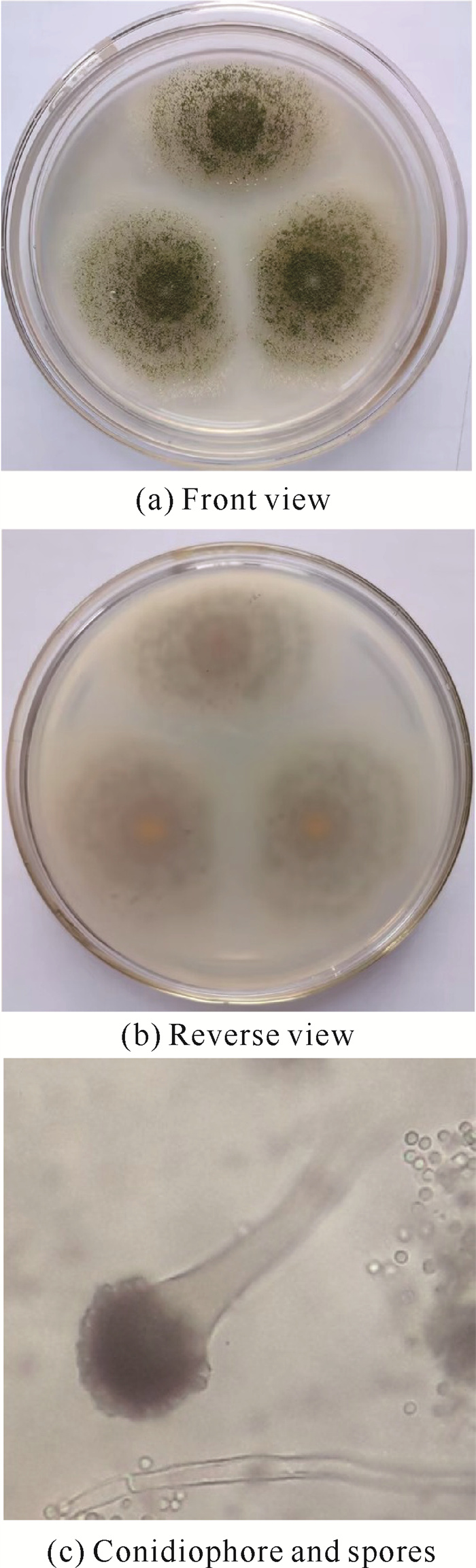
|
| 图 1 目标菌株的平板菌落形态和显微形态 Fig. 1 Colony and microscopic morphology of targeted strain |
用目标菌株和曲霉属黄绿组代表性模式菌株[25]的ITS序列构建系统发育树,发现目标菌株的ITS序列与黄曲霉(Aspergillus flavus)和米曲霉(A.oryzae)处于同一进化枝(图 2)。将目标菌株的ITS序列在NCBI进行Nucleotide BLAST后,发现在序列一致性最高的前100条记录中有86条为来自黄曲霉不同菌株的ITS序列,并且一致性均为100%。因此,确认目标菌株为黄曲霉,并命名为A.flavus TPF2-1。
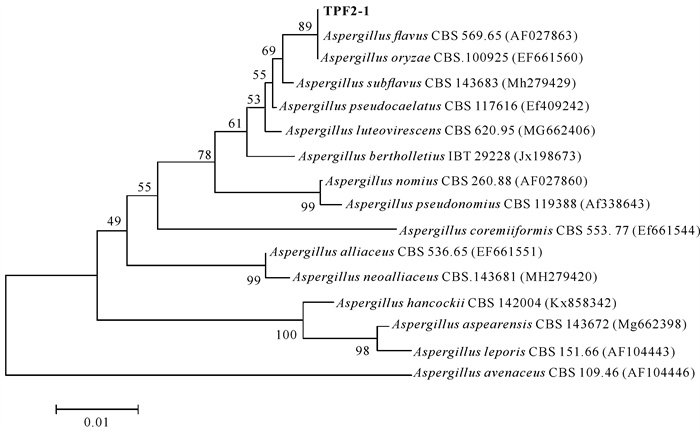
|
| 图 2 菌株TPF2-1和曲霉属黄绿组代表性菌株内转录间隔区序列的发育建树 Fig. 2 Phylogenetic tree based on the ITS sequences of strain TPF2-1 and representative type strains of Aspergillus section Flavi |
2.2 果胶酶粗酶的酶学性质
将菌株TPF2-1进行液态培养5 d后,在培养液中测到果胶酶酶活力为(0.63±0.02) IU/mL。TPF2-1果胶酶粗酶的最适作用pH值为4.5,pH值为4.0时的酶活力次之[图 3(a)]。当pH值为3.0和6.5时,TPF2-1果胶酶粗酶的相对酶活力约为20%,这表明该酶可在弱酸性环境中发挥作用。该粗酶在pH值4.0-7.0下比较稳定,保温24 h后残余相对酶活力高于90%[图 3(b)]。TPF2-1果胶酶粗酶的最适作用温度为50 ℃,55 ℃下的酶活力次之[图 3(c)];在35 ℃和65 ℃的相对酶活力分别为60%和45%,说明该酶能够在较宽的温度范围内发挥出较高的酶活力。TPF2-1果胶酶粗酶在35 ℃下稳定,随着温度升高稳定性逐渐降低,在60 ℃保温30 min后几近全部失活[图 3(d)]。
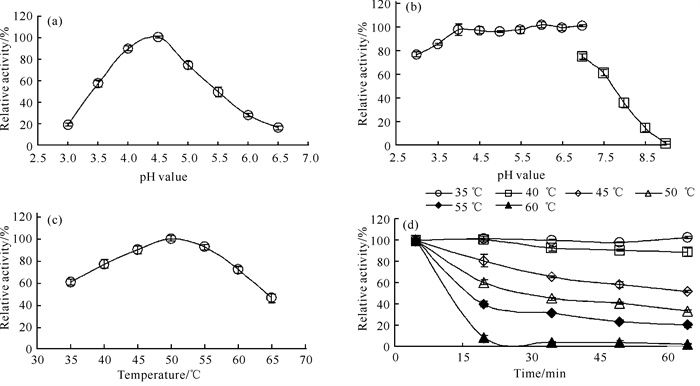
|
| (a) Effect of pH value on the activity of pectinase; (b) Effect of pH value on the stability of pectinase; (c) Effect of temperature on the activity of pectinase; (d) Effect of temperature on the stability of pectinase. 图 3 pH值和温度对菌株TPF2-1果胶酶粗酶酶活力和稳定性的影响 Fig. 3 Effects of pH value and temperature on the activity and stability of the crude pectinase of TPF2-1 |
Li+、Na+、Mg2+和K+对该果胶酶的酶活力都没有明显影响(表 1)。Co2+、Zn2+和Cu2+是重金属离子,但在本研究中未观察到该酶的酶活力受其抑制。5 mmol/L的Ca2+、Fe2+和Fe3+分别使TPF2-1果胶酶粗酶的酶活力降至(63.42±4.59)%、(87.69±3.24)%和(83.73±1.19)%。就Ca2+、Fe2+和Fe3+而言,同一个金属离子在不同的浓度下对TPF2-1果胶酶的酶活力有不同影响,例如1、2 mmol/L的Ca2+对酶活力的影响幅度不超过10%,但当浓度升高到5 mmol/L时却将酶活力抑制至(63.42±4.59)%;再如2 mmol/L的Fe2+促进该酶的酶活力,但5 mmol/L的Fe2+抑制TPF2-1果胶酶的酶活力。
| 金属离子 Metalions |
相对酶活力/% Relative activity/% |
||
| 1 mmol/L | 2 mmol/L | 5 mmol/L | |
| EDTA-Na2 | 100.77±0.53 | 97.85±1.78 | 99.57±1.60 |
| Li+ | 104.50±1.15 | 110.15±1.71 | 105.49±0.57 |
| Na+ | 98.97±0.45 | 105.82±0.78 | 98.91±3.24 |
| Mg2+ | 104.54±1.20 | 101.92±1.06 | 94.19±3.66 |
| K+ | 104.34±1.21 | 107.09±2.40 | 104.35±0.93 |
| Ca2+ | 95.74±3.00 | 94.73±2.03 | 63.42±4.59 |
| Mn2+ | 121.96±1.96 | 128.93±0.18 | 137.87±1.40 |
| Fe2+ | 95.13±1.16 | 128.87±2.37 | 87.69±3.24 |
| Fe3+ | 112.93±1.51 | 126.95±1.70 | 83.73±1.19 |
| Co2+ | 109.46±0.87 | 128.83±3.51 | 109.15±1.25 |
| Cu2+ | 108.66±4.48 | 107.92±2.25 | 92.23±1.22 |
| Zn2+ | 97.47±1.69 | 101.76±0.60 | 94.92±0.77 |
2.3 白玉兰落叶的酶解
如图 4所示,TPF2-1果胶酶水解白玉兰落叶的最适作用温度为50 ℃,这与其水解聚半乳糖醛酸的最适作用温度相近。当温度升高至55 ℃时,TPF2-1果胶酶能发挥出95.92%的酶活力。即使在35 ℃条件下,仍能维持59.40%的酶活力。以上结果表明TPF2-1果胶酶对白玉兰落叶具有良好的酶解特性。
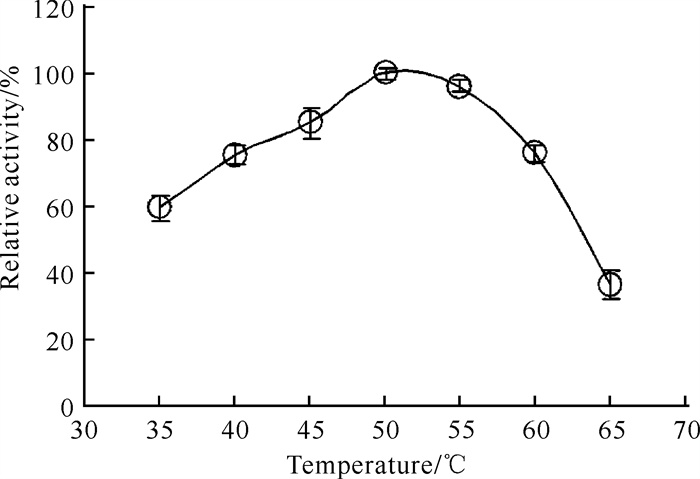
|
| 图 4 TPF2-1果胶酶对白玉兰落叶的最适作用温度 Fig. 4 The optimum temperature for the action of TPF2-1 pectinase on the fallen leaves of Magnolia denudata |
表 2展示了不同加酶量下的TPF2-1果胶酶对白玉兰落叶的水解效率。随着加酶量的增加,水解体系中的还原性物质的量也在增加,其中加酶量为60 U/g时,还原性物质浓度为(0.914±0.010) g/L,水解后提升幅度达到(231.86±3.55)%,约为水解前的3.3倍。随着加酶量的增加,每单位酶水解产生的还原性物质的量呈减少趋势。
| 酶的用量/(U/g) Enzyme dose/(U/g) |
还原性物质浓度/(g/L) Concentration of reducing sugar/(g/L) |
每单位酶活力水解所得还原性物质的量/(g/U) Yield of reducing sugar per unit enzyme/(g/U) |
提升幅度/% Increment /% |
| 0 | 0.275±0.012 | - | - |
| 1 | 0.329±0.018 | 0.054±0.011 | 19.42±6.40 |
| 3 | 0.348±0.005 | 0.024±0.001 | 26.24±1.88 |
| 6 | 0.417±0.012 | 0.024±0.005 | 51.35±4.39 |
| 15 | 0.528±0.008 | 0.017±0.001 | 91.76±2.85 |
| 60 | 0.914±0.010 | 0.011±0.002 | 231.86±3.55 |
3 讨论 3.1 pH值和温度对酶活性和稳定性的影响
中国的土壤普遍呈酸性[26],因此TPF2-1果胶酶可在大多数土壤环境下对还田物进行水解,这一点比某些碱性果胶酶(如最适作用pH值普遍为碱性的果胶裂合酶[27])有天然的优势。同时,TPF2-1果胶酶在pH值4.0-7.0下保温24 h后(25 ℃下)仍保持高达90%以上的残余酶活力,其在酸性pH值下的稳定性比一些已报道的果胶酶更佳[28,29]。田地间的水解需要果胶酶在弱酸性环境中长时间内保持活性,因此TPF2-1果胶酶比在酸性下不稳定的果胶酶(如费希新萨托菌产的果胶酶[30])更适用于还田物的水解。与某些高温果胶酶不同(如高温放线糖莱斯菌[31]、Talaromyces leycettanus JCM 12802[32]和Penicillium occitanis[33]等所产的果胶酶),TPF2-1果胶酶属于中温酶,该酶在40-60 ℃下能发挥出最高酶活力的60%以上,说明其可在多种温度条件下发挥水解作用。
3.2 金属离子对酶活性的影响Na+、Mg2+和K+广泛存在于植物组织中[34],这三者均不抑制TPF2-1果胶酶活力,这有利于该果胶酶对植物组织的水解。一般认为重金属离子会对蛋白质产生危害[35,36],然而在本研究中,Co2+和Cu2+未抑制TPF2-1果胶酶的酶活力,这表明该果胶酶具有能够在Co2+和Cu2+污染的环境中对植物落叶水解的应用潜力。与本研究结果相似,在已有报道中也发现Ca2+抑制果胶酶的酶活力,例如来自Penicillium occitanis[37]和黑曲霉(A.niger)[38]的果胶酶在1、2 mmol/L Ca2+存在的情况下分别只能发挥出64.9%和53.0%的酶活力。另外,本研究中出现同一个金属离子在不同浓度下对TPF2-1果胶酶酶活力有不同影响的情况,这在以往的研究中也有报道,例如有报道称,存在2、5 mmol/L的Cu2+时,Penicillium occitanis果胶酶能发挥出的酶活力分别为62.09%和19.75%[33]。这种现象是因为酶与金属离子之间有复杂的关系[39]:①一个酶分子可以结合多种金属离子;②对于某个金属离子,一个酶分子可能有多个结合位点,并且这些结合位点之间在结合顺序上可能存在差别;③部分金属离子的结合可能会直接参与催化反应或引起酶的结构变化,进而影响酶的催化活力;④金属离子的结合引起酶结构变化的程度因金属离子的种类和结合数量的不同而有所差异。例如,多数已报道果胶裂合酶的酶活力受Ca2+影响,具体表现为Ca2+在低浓度时不影响该酶活力,随着浓度提升而表现出促进作用,然而继续提高浓度时促进作用减弱甚至表现出抑制作用。经研究发现果胶裂合酶在催化位点附近有2个Ca2+结合位点,初级Ca2+结合后会稳定蛋白质的β-螺旋结构和长突出环,从而增强酶的热稳定性[40];次级Ca2+结合后则参与形成反应复合物,促进C5质子的提取,进而促进酶的活力[41];若有更多的Ca2+,则与其他位点结合,但引起的结构变化不能确定对酶的催化起促进还是抑制作用。Ca2+对果胶裂合酶的作用可以促进人们对“不同浓度的同一种金属离子对内切聚半乳糖醛酸酶酶活力有不同的作用”这一现象的理解。
3.3 关于黄曲霉果胶酶安全性的解决方案迄今已有许多关于来自不同种属的细菌、放线菌、酵母和丝状真菌菌株果胶酶酶学性质的报道,其中来自丝状真菌的果胶酶数量最多,而在丝状真菌中又以曲霉属物种的报道最多[35,38,42-48]。虽然目前已有报道表明黄曲霉具备产果胶酶的能力,但是关于其酶学性质的报道仍不多,究其原因是黄曲霉存在一定的安全隐患[49]。然而,黄曲霉在生物炼制等方面具有潜在的应用价值,该物种已被报道可产多种构成植物细胞壁的生物大分子的水解酶(如纤维素酶[50]、葡萄糖苷酶[51]、木聚糖酶[52]、β-1,3-1,4-葡聚糖酶[53]和蛋白酶[54]等)和自然界中仅次于纤维素的第二大生物质——淀粉[55]的水解酶(如α-淀粉酶[54]和葡萄糖淀粉酶[56]等)。为了解决来源于黄曲霉的酶制剂的安全性问题,未来的工作可以将黄曲霉的果胶酶基因克隆至易于大量表达异源基因的安全菌株中表达(如黑曲霉[57]和米曲霉[58])。
4 结论本研究从土壤中筛选出一株产果胶酶的黄曲霉菌株TPF2-1。该菌株所产果胶酶具有良好的酶解特性,其最适作用pH值为4.5,最适作用温度为50 ℃,粗酶酶活力为(0.63±0.02) IU/mL。同时,TPF2-1果胶酶具有较好的热稳定性,并可在弱酸性环境中发挥作用。此外,Li+、Na+、Mg2+、K+、Cu2+、Zn2+和Co2+对TPF2-1果胶酶的酶活力均无明显抑制作用,而Ca2+、Fe2+和Fe3+在浓度为5 mmol/L时表现出抑制作用。TPF2-1果胶酶能够使白玉兰落叶水解体系中还原性物质的量提升至水解前的3.3倍,在植物叶片还田方面具有潜在的应用价值。
| [1] |
杜国明, 梁常安, 张树文, 等. 黑土地保护的对象特性、面临形势与应对策略[J]. 资源科学, 2023, 45(5): 887-899. |
| [2] |
王红彦, 王飞, 孙仁华, 等. 国外农作物秸秆利用政策法规综述及其经验启示[J]. 农业工程学报, 2016, 32(16): 216-222. DOI:10.11975/j.issn.1002-6819.2016.16.030 |
| [3] |
王凤仁, 逄蕾, 沈健林, 等. 秸秆还田下双季稻田土壤团聚体碳氮磷含量及生态化学计量比特征[J]. 农业现代化研究, 2023, 44(3): 550-557. |
| [4] |
盖豪, 颜廷武, 周晓时. 政策宣传何以长效?:基于湖北省农户秸秆持续还田行为分析[J]. 中国农村观察, 2021(6): 65-84. |
| [5] |
饶越悦, 周顺利, 黄毅, 等. 秸秆富集深层还田对农田土壤质量影响的研究进展[J]. 中国生态农业学报(中英文), 2023, 31(10): 1579-1587. DOI:10.12357/cjea.20230145 |
| [6] |
石温慧, 温晓兰, 李生辉, 等. 绿肥还田对土壤团聚性、可蚀性及有机质的影响[J]. 江苏农业科学, 2023, 51(12): 195-201. |
| [7] |
杨丽荣, 吕娜, 张钊, 等. 棉花秸秆腐解特征及其对小麦产量的影响[J]. 华中农业大学学报, 2023, 42(4): 132-139. |
| [8] |
王晶, 孙松青, 李雪, 等. 秸秆不同还田方式对轮作小麦—玉米产量、土壤养分及蔗糖酶活性的影响[J]. 江苏农业科学, 2023, 51(4): 85-90. |
| [9] |
赫兵, 李超, 严永峰, 等. 水稻秸秆秋季水耙浆还田对土壤及水稻性状的影响[J]. 中国稻米, 2023, 29(4): 66-71. |
| [10] |
李忠义, 韦彩会, 何铁光, 等. 不同还田方式下2种夏季绿肥的腐解特性[J]. 西南农业学报, 2020, 33(7): 1554-1560. |
| [11] |
吕凯飞, 周锋, 安曈昕, 等. 耕作深度及秸秆还田对耕层土壤理化性状的影响[J]. 西南农业学报, 2021, 34(7): 1503-1509. |
| [12] |
裴亚楠, 吕卫光, 郭涛, 等. 秸秆还田配施促腐菌剂对土壤团聚体及其养分的影响[J]. 应用生态学报, 2023, 34(12): 3357-3363. |
| [13] |
李凌波, 许欢欢, 夏燕维, 等. 油菜秸秆高效降解菌的筛选及其双功能纤维素酶性质研究[J]. 南京农业大学学报, 2022, 45(4): 711-720. |
| [14] |
强震宇, 朱林, 朱媛媛, 等. 一株兼具秸秆腐解能力玉米促生菌的筛选、鉴定及发酵优化[J]. 微生物学通报, 2023, 50(2): 526-540. |
| [15] |
SCHELLER H V, ULVSKOV P. Hemicelluloses[J]. Annual Review of Plant Biology, 2010, 61: 263-289. DOI:10.1146/annurev-arplant-042809-112315 |
| [16] |
RIDLEY B L, O'NEILL M A, MOHNEN D. Pectins:structure,biosynthesis,and oligogalacturonide-related signaling[J]. Phytochemistry, 2001, 57(6): 929-967. DOI:10.1016/S0031-9422(01)00113-3 |
| [17] |
ZHANG J H, PAKARINEN A, VⅡKARI L. Synergy between cellulases and pectinases in the hydrolysis of hemp[J]. Bioresource Technology, 2013, 129: 302-307. DOI:10.1016/j.biortech.2012.11.064 |
| [18] |
范晓慧, 马勇, 冯家豪, 等. 北方城市10种常见树木凋落叶的分解及养分释放特征[J]. 西北林学院学报, 2020, 35(6): 25-31. |
| [19] |
CHEN J, LIANG R H, LIU W, et al. Extraction of pectin from Premna microphylla turcz leaves and its physicochemical properties[J]. Carbohydrate Polymers, 2014, 102: 376-384. DOI:10.1016/j.carbpol.2013.11.069 |
| [20] |
张增信, 王言鑫, 杨艳蓉, 等. 南京地区8种常见观赏树木花期可预报研究[J]. 生态科学, 2014, 33(4): 642-648. |
| [21] |
IÑIGUEZ-MORENO M, PIZAÑA-ARANDA J J P, RAMÍREZ-GAMBOA D, et al. Enhancing pectin extraction from orange peel through citric acid-assisted optimization based on a dual response[J]. International Journal of Biological Macromolecules, 2024, 263: 130230. DOI:10.1016/j.ijbiomac.2024.130230 |
| [22] |
XIAN L, WANG F, LUO X, et al. Purification and characterization of a highly efficient calcium-independent α-amylase from Talaromyces pinophilus 1-95[J]. PLoS One, 2015, 10(3): e0121531. DOI:10.1371/journal.pone.0121531 |
| [23] |
YILMAZ N, VISAGIE C M, HOUBRAKEN J, et al. Polyphasic taxonomy of the genus Talaromyces[J]. Studies in Mycology, 2014(78): 175-341. |
| [24] |
MILLER G L. Use of dinitrosalicylic acid reagent for determination of reducing sugar[J]. Analytical Chemistry, 1959, 31(3): 426-428. DOI:10.1021/ac60147a030 |
| [25] |
FRISVAD J C, HUBKA V, EZEKIEL C N, et al. Taxonomy of Aspergillussection Flavi and their production of aflatoxins,ochratoxins and other mycotoxins[J]. Studies in Mycology, 2019(93): 1-63. |
| [26] |
胡天睿, 蔡泽江, 王伯仁, 等. 有机肥替代化学氮肥提升红壤抗酸化能力[J]. 植物营养与肥料学报, 2022, 28(11): 2052-2059. DOI:10.11674/zwyf.2022130 |
| [27] |
LIU S J, QIN Y, WANG Q Y, et al. A novel pectate lyase with high specific activity from Bacillus sp.B58-2:gene cloning,heterologous expression and use in ramie degumming[J]. Enzyme and Microbial Technology, 2024, 175: 110395. DOI:10.1016/j.enzmictec.2024.110395 |
| [28] |
关怡, 杜茜, 尹娣, 等. 大曲中产果胶酶微生物的分离鉴定及其产酶活力评价[J]. 基因组学与应用生物学, 2018, 37(12): 5311-5316. |
| [29] |
李碧婵, 肖国利, 黄星星, 等. 一株产果胶酶芦苇内生真菌的分离、鉴定及酶学性质研究[J]. 中国酿造, 2021, 40(6): 92-96. |
| [30] |
LI K, MENG K, PAN X, et al. Two thermophilic fungal pectinases from Neosartorya fischeri P1:gene cloning,expression,and biochemical characterization[J]. Journal of Molecular Catalysis B:Enzymatic, 2015, 118: 70-78. DOI:10.1016/j.molcatb.2015.05.005 |
| [31] |
陈杰, 李豆南, 刘茂强, 等. 产耐高温果胶酶菌株筛选鉴定、产酶条件优化及酶学性质研究[J]. 中国酿造, 2023, 42(5): 176-183. |
| [32] |
LI Y Q, WANG Y, TU T, et al. Two acidic,thermophilic GH28 polygalacturonases from Talaromyces leycettanus JCM 12802 with application potentials for grape juice clarification[J]. Food Chemistry, 2017, 237: 997-1003. DOI:10.1016/j.foodchem.2017.06.037 |
| [33] |
TOUNSI H, SASSI A H, ROMDHANE Z B, et al. Catalytic properties of a highly thermoactive polygalacturonase from the mesophilic fungus Penicillium occitanis and use in juice clarification[J]. Journal of Molecular Catalysis B:Enzymatic, 2016, 127: 56-66. DOI:10.1016/j.molcatb.2016.02.012 |
| [34] |
GRASSIN C,COUTEL Y.Enzymes in fruit and vegetable processing and juice extraction[M]//WHITEHURST R J,VAN OORT M (eds).Enzymes in Food Technology.Second edition.[S.l:s.n.],2009:236-263.
|
| [35] |
TAN H D, YANG G J, CHEN W, et al. Identification and characterization of thermostable endopolygalacturonase Ⅱ B from Aspergillus luchuensis[J]. Journal of Food Biochemistry, 2020, 44(3): e13133. |
| [36] |
MARTINS E D S, LEITE R S R, SILVA R D, et al. Purification and properties of polygalacturonase produced by thermophilic fungus Thermoascus aurantiacus CBMAI-756 on solid-state fermentation[J]. Enzyme Research, 2013, 2013: 438645. |
| [37] |
SASSI A H, TOUNSI H, TRIGUI-LAHIANI H, et al. A low-temperature polygalacturonase from P.occitanis:characterization and application in juice clarification[J]. International Journal of Biological Macromolecules, 2016, 91: 158-164. DOI:10.1016/j.ijbiomac.2016.05.075 |
| [38] |
WANG J J, ZHANG Y H, QIN X, et al. Efficient expression of an acidic endo-polygalacturonase from Aspergillus niger and its application in juice production[J]. Journal of Agricultural and Food Chemistry, 2017, 65(13): 2730-2736. DOI:10.1021/acs.jafc.6b05109 |
| [39] |
LU C H, LIN Y F, LIN J J, et al. Prediction of metal ion-binding sites in proteins using the fragment transformation method[J]. PLoS One, 2012, 7(6): e39252. |
| [40] |
AKITA M, SUZUKI A, KOBAYASHI T, et al. The first structure of pectate lyase belonging to polysaccharide lyase family 3[J]. Acta Crystallographica Section D-Biological Crystallography, 2001, 57: 1786-1792. |
| [41] |
ZHENG Y Y, HUANG C H, LIU W T, et al. Crystal structure and substrate-binding mode of a novel pectate lyase from alkaliphilic Bacillus sp.N16-5[J]. Biochemical and Biophysical Research Communications, 2012, 420(2): 269-274. |
| [42] |
GUO C T, XUE W M, CHEN T B, et al. Purification and partial characterization of an endo-polygalacturonase from Aspergillus niger[J]. Journal of Food Biochemistry, 2002, 26(3): 253-265. |
| [43] |
NAGAI M, KATSURAGI T, TERASHITA T, et al. Purification and characterization of an endo-polygalacturonase from Aspergillus awamori[J]. Bioscience,Biotechnology,and Biochemistry, 2000, 64(8): 1729-1732. |
| [44] |
SINGH S A, APPU RAO A G. A simple fractionation protocol for,and a comprehensive study of the molecular properties of,two major endopolygalacturonases from Aspergillus niger[J]. Biotechnology and Applied Biochemistry, 2002, 35: 115-123. |
| [45] |
ZHOU H X, LI X, GUO M Y, et al. Secretory expression and characterization of an acidic endo-polygalacturonase gene from Aspergillus niger SC323 in Saccharomyces cerevisiae[J]. Journal of Microbiology and Biotechnology, 2015, 25(7): 999-1006. |
| [46] |
YOSHINO-YASUDA S, KATO M, KITAMOTO N. Sequence analysis and heterologous expression of polygalacturonase gene (AspecA) from a shoyu koji mold,Aspergillus sojae KBN1340[J]. Food Science and Technology Research, 2011, 17(6): 579-584. |
| [47] |
XU H, ZHANG P F, ZHANG Y C, et al. Overexpression and biochemical characterization of an endo-α-1,4-polygalacturonase from Aspergillus nidulans in Pichia pastoris[J]. International Journal of Molecular Sciences, 2020, 21(6): 2100. |
| [48] |
PAŘENICOV L, BENEN J A E, KESTER H C M, et al. pgaE encodes a fourth member of the endopolygalacturonase gene family from Aspergillus niger[J]. European Journal of Biochemistry, 1998, 251(1/2): 72-80. |
| [49] |
MELLON J E, COTTY P J, DOWD M K. Aspergillus flavus hydrolases:their roles in pathogenesis and substrate utilization[J]. Applied Microbiology and Biotechnology, 2007, 77(3): 497-504. |
| [50] |
李婕, 李敏, 汪玲玲, 等. 高产纤维素酶真菌的筛选鉴定与紫外诱变选育研究[J]. 饲料研究, 2023, 46(17): 76-81. |
| [51] |
康小龙, 吕晓静, 黄清媚, 等. 黄曲霉寡聚-1,6-葡萄糖苷酶基因的克隆及其在工业酿酒酵母CICC1346中的表达[J]. 食品与发酵工业, 2016, 42(8): 44-50. |
| [52] |
陈瑶瑶, 陈洲, 刘璐, 等. 黄曲霉产β-1,4-木聚糖酶发酵条件的优化及其酶学特性[J]. 食品工业科技, 2019, 40(7): 131-137. |
| [53] |
刘璐, 陈洲, 陈瑶瑶, 等. 黄曲霉产胞外β-1,3-1,4-葡聚糖酶的发酵条件优化[J]. 食品科学技术学报, 2019, 37(1): 28-35. |
| [54] |
邬吉野, 李莹, 王德馨, 等. 六神曲的发酵菌种分离及纯种发酵考察[J]. 中国实验方剂学杂志, 2013, 19(16): 12-14. |
| [55] |
TESTER R F, KARKALAS J, QI X. Starch:composition,fine structure and architecture[J]. Journal of Cereal Science, 2004, 39(2): 151-165. |
| [56] |
冯立才, 黄未, 郭润就. 曲霉糖化酶高产菌株平板分离培养基的筛选[J]. 酿酒科技, 2003(3): 37-38. |
| [57] |
LI C, ZHOU J W, DU G C, et al. Developing Aspergillus niger as a cell factory for food enzyme production[J]. Biotechnology Advances, 2020, 44: 107630. |
| [58] |
TOKUOKA M, TANAKA M, ONO K, et al. Codon optimization increases steady-state mRNA levels in Aspergillus oryzae heterologous gene expression[J]. Applied and Environmental Microbiology, 2008, 74(21): 6538-6546. |



