2. 广西漓江流域景观资源保育与可持续利用重点实验室(广西师范大学), 广西桂林 541006;
3. 广西师范大学可持续发展创新研究院, 广西桂林 541006
2. Guangxi Key Laboratory of Landscape Resources Conservation and Sustainable Utilization in Lijiang River Basin, Guangxi Normal University, Guilin, Guangxi, 541006, China;
3. Institute for Sustainable Development and Innovation, Guangxi Normal University, Guilin, Guangxi, 541006, China
毛竹(Phyllostachys edulis)作为笋材两用的经济竹种,占全国竹林面积的72.96%,广泛分布于我国南方地区[1]。近年来单一毛竹种植经济效益差,严重打击了竹农的积极性。在脱贫攻坚与乡村振兴的背景下,竹木、竹药、竹草等复合经营能有效增加竹农收入,是解决毛竹林低效经营的可行方式,因而被大范围推广[2]。对于有特色茶资源的地区,竹茶复合种植能极大提升毛竹种植经济效益,但这种复合经营模式的引入会对毛竹纯林土壤生物活动和养分循环产生影响。而目前有关竹茶复合种植对土壤环境正、负两方面的影响还不明确,制约着毛竹林复合经营的可持续发展。因此,在追求经济效益的同时,及时反馈与预测竹茶经营模式对土壤环境的影响,对于该模式的科学管理和生态效益的提升均具有重要意义。
土壤微生物是土壤生态系统中最活跃的部分,在推动土壤物质转换、能量流动和生物地化循环中起着重要作用[3-5],常被用作衡量土地利用变化下土壤质量变化的敏感指标[3, 6]。前期研究表明毛竹入侵会改变微生物群落结构,但对该入侵所造成影响的认知存在差异性[7-9]。施宇森等[7]基于Meta分析证明毛竹入侵周围林分会提高土壤pH值、土壤细菌和真菌多样性。Chang等[8]研究表明土壤中革兰氏阳性细菌和革兰氏阴性细菌总磷脂脂肪酸(PLFAs)比例随着毛竹对相邻日本柳杉(Cryptomeria japonia)人工林的入侵而降低。马鑫茹等[9]关于常绿阔叶林、竹-阔混交林和毛竹林土壤微生物群落的研究表明,相较于其他林分,毛竹林土壤除丛枝菌根真菌的生物量外,细菌、放线菌和其他真菌的生物量都随着毛竹的扩张呈下降趋势,且微生物多样性和丰富度显著降低。曹小青等[10]关于竹药混交的研究表明,毛竹-白及(Bletilla striata)复合林分的土壤微生物功能多样性会随着竹下种植白及的年限增加而逐渐提高。目前,较多的研究关注于复合经营对土壤理化性质的影响[11-13],土壤微生物群落多样性与稳定性对毛竹复合经营的响应研究还相对缺乏。土壤微生物群落多样性变化能很好地反映土壤状态,对于解析土地利用变化驱动土壤养分循环的内在机制,以及林地经营管理具有重要意义。因此,开展复合经营毛竹林的土壤微生物研究很有必要。
竹茶复合经营方式已被证实能有效增加竹农收入[14],同时能有效缓解毛竹纯林经营造成的土壤碳流失[15],但目前有限的认知还不能支撑毛竹林复合经营的可持续发展。微生物驱动着土壤养分循环,是土壤质量的重要评价指标,以其作为研究对象能很好地反映毛竹林复合经营对土壤环境的影响。因此,本研究以常绿阔叶林、毛竹纯林和竹茶混交林为研究对象,通过分析不同林分类型下土壤表层微生物群落多样性与稳定性差异,探究不同环境因素对土壤微生物群落结构的影响,以期进一步揭示土壤微生物群落对经济价值导向驱动下毛竹林土地利用变化的响应特征,为当地生态恢复与毛竹林经营提供理论依据。
1 材料与方法 1.1 研究区概况研究区位于广西壮族自治区桂林市兴安县华江瑶族乡(25°48′N, 110°27′E),海拔500-600 m,地处亚热带季风气候区,年平均气温16 ℃左右,年平均降水量在2 100 mm以上。成土母质主要为花岗岩风化母质,土层不厚,土壤以红壤和黄壤为主。华江瑶族乡的林地面积约54万亩(1亩≈666.67 m2),森林覆盖率达94%以上,其中毛竹面积约23万亩,是全国十大毛竹生产基地之一[16],且毛竹林面积有逐年扩张的趋势。在乡村振兴的背景下,当地依托经济价值较高的茶树开展毛竹-茶树复合经营,以提高毛竹纯林的经济效益。
1.2 实验设计本研究选取立地条件相似的3种林分类型,分别为常绿阔叶林(EBF)、毛竹纯林(PBF)和竹茶混交林(BTF)。常绿阔叶林乔木层树种主要为润楠(Machilus nanmu)、黑壳楠(Lindera megaphylla)、肉桂(Cinnamomum cassia)。毛竹纯林乔木层仅为毛竹,灌木层为白背叶(Mallotus apelta)、杜茎山(Maesa japonica)、玉叶金花(Mussaenda pubescens)。竹茶混交林乔木层为毛竹,灌木层为茶(Camellia sinensis),竹∶茶种植密度为1∶2。
每种林分类型设置6个重复样方(20 m×20 m),在每个样地随机设置5个采样点,采集0-10 cm土层的土样,将5个土样混合成1个,采用四分法在混合样中取1 kg的土样来代表该样地。每种林分类型共6个混合土壤样品,共取回18个土样。在采样点附近用环刀采集土壤,测定土壤容重,在样方内随机设置5个50 cm×50 cm的小样方收集地上凋落物,设置5个20 cm×20 cm的小样方收集0-10 cm土壤根系。将土壤充分混匀后剔除石块、根和动植物残体,过2 mm筛后分为3部分,一部分保存在4 ℃冰箱内用于无机氮分析,一部分经自然风干后用于土壤理化性质分析,还有一部分用于土壤微生物指标的测定。
1.3 土壤理化性质的测定土壤含水率采用烘干法测定。pH值采用电位法测定(水土比为2.5∶1.0)。土壤全氮(Total Nitrogen, TN)含量采用碳氮元素分析仪(Elementar Vario EL Ⅲ,德国元素分析系统公司)测定。全磷(Total Phosphorous, TP)含量采用钼锑钪比色法测定。土壤铵态氮(NH4+-N)与硝态氮(NO3--N)用2 mol/L氯化钾溶液浸提,使用SKALAR San++连续流动分析仪(SEAL AA3,德国SEAL公司)测定。土壤有机碳(Soil Organic Carbon, SOC)含量采用浓硫酸-重铬酸钾氧化高温外加热法测定。地上凋落物与根系生物量采用烘干法测定。可溶性有机碳(Dissolved Organic Carbon, DOC)用20 mL 0.5 mol/L硫酸钾溶液浸提,使用TOC自动分析仪(multi N/C 3100,德国耶拿分析仪器股份公司)测定。土壤理化性质具体测试结果见表 1。本研究中化学计量比公式如下:
| $ \begin{array}{l} 碳氮比 (\mathrm{C}: \mathrm{N})=\mathrm{SOC}: \mathrm{TN}, \\ 碳磷比 (\mathrm{C}: \mathrm{P})=\mathrm{SOC}: \mathrm{TP}, \\ 氮磷比 (\mathrm{~N}: \mathrm{P})=\mathrm{TN}: \mathrm{TP}_{\circ} \end{array} $ |
| 林分类型 Stand types |
pH值 pH value |
含水率/% Water content/% |
土壤有机碳/% SOC/% |
可溶性有机碳/
(mg·kg-1) DOC/ (mg·kg-1) |
全氮/% TN/% |
全磷/
(g·kg-1) TP/ (g·kg-1) |
硝态氮/
(mg·kg-1) NO3--N/ (mg·kg-1) |
| EBF | 4.28±0.05c | 44.40±5.52a | 3.97±0.58a | 66.61±13.33a | 0.34±0.02a | 0.33±0.05a | 18.14±4.69b |
| PBF | 4.56±0.08b | 31.94±3.01c | 2.51±0.52b | 49.35±5.59b | 0.23±0.02b | 0.15±0.01c | 7.48±1.15c |
| BTF | 4.68±0.05a | 38.00±2.18b | 2.69±0.5b | 52.97±3.95b | 0.23±0.01b | 0.21±0.04b | 27.88±10.79a |
| 林分类型 Stand types |
铵态氮/
(mg·kg-1) NH4+-N/ (mg·kg-1) |
地上凋落物/
(kg·m-2) Aboveground litter/(kg·m-2) |
根系生物量/
(kg·m-2) Root biomass/ (kg·m-2) |
碳氮比 C∶N |
碳磷比 C∶P |
氮磷比 N∶P |
|
| EBF | 5.78±2.13a | 1.42±0.33b | 0.37±0.08b | 11.64±1.16a | 122.03±23.41b | 10.43±1.35b | |
| PBF | 1.77±0.77b | 1.73±0.17ab | 0.75±0.24a | 10.21±0.69b | 166.77±38.03a | 14.87±1.22a | |
| BTF | 1.40±0.14b | 2.15±0.74a | 0.76±0.14a | 9.42±0.34c | 130.97±17.71b | 11.65±2.21b | |
| Note: different lowercase letters indicate significant differences among different stand types (P<0.05). | |||||||
1.4 土壤微生物指标的测定
用DNeasy PowerSoil Pro Kit试剂盒(德国凯杰公司)提取土壤样品DNA,完成提取后,检测DNA质量。对于细菌,使用通用引物338F (5′-ACTCCTACGGGAGGCAGCAGCAG-3′)和806R (5′-GGACTACHVGGGTWTCTAAT-3′)对其16S rRNA基因的V3-V4区域进行PCR扩增;对于真菌,使用引物ITS1F (5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS2R (5′-GCTGCGTTCTTCATCGATGC-3′)对其ITS区域进行PCR扩增。PCR产物用DNeasy PowerWater Kit纯化后,按照等摩尔混合均匀用于测序。测序工作由广州美格基因科技有限公司完成。测序平台选择Illumina MiSeq PE250 platform,通过对原始序列过滤、序列拼接和去除嵌合体,得到高质量序列。先将相似水平超过97%的序列归为1个可操作分类单元(Operational Taxonomic Unit, OTU),再与数据库进行比对。
1.5 数据处理采用Excel 2019软件对数据进行整理。采用SPSS 19.0软件进行统计分析。采用单因素方差分析(One-way ANOVA)并使用最小显著性差异(Least Significant Difference, LSD)法进行多重比较,对各林分类型的差异进行显著性检验,以确定不同林分类型之间的差异(P<0.05)。土壤微生物物种组成分析首先利用R语言软件vegan包对微生物相对丰度排名前10的门和属排序,并用PMCMRplus包对不同林分类型相对丰度排名前10的门和属进行非参数检验(Wilcoxon/Kruskal-Wallis H),然后利用ggplot2包进行可视化。利用R语言软件vegan包对土壤微生物的相对丰度进行Alpha多样性分析,包括Observed species指数(物种丰富度指数)和香农指数(物种多样性指数),并配合使用LSD法确定不同林分类型之间的差异(P<0.05)。Beta多样性分析以OTU表格为基础,使用R语言软件vegan包对Bray-Curtis距离矩阵进行运算,使用ggplot2包对其进行可视化,并对不同林分类型进行置换多元方差分析(Permutational Multivariate Analysis of Variance,PERMANOVA)。土壤微生物数据采用R语言软件igraph包分析,根据相关性筛选出P<0.05,|r|≥0.6的细菌和真菌OTUs。用Gephi 0.9.7软件对细菌和真菌的网络结构进行可视化处理。将土壤细菌和真菌群落中门相对丰度高于1%的物种与土壤理化性质进行相关性分析,基于pheatmap包绘制生成热图(Heatmap);对土壤理化性质与细菌、真菌群落基于R语言软件vegan包和ggplot2包进行冗余分析(Redundancy Analysis,RDA)并作图,探究土壤理化性质对土壤细菌和真菌群落组成的影响。过滤掉相对丰度<0.1%的物种,采用方差膨胀因子的方法,不选取与其他环境因子有较强共线性的TN、TP、C∶P,选取SOC、DOC、NH4+-N、NO3--N、pH值、土壤含水率、根系生物量、凋落物量、C∶N、N∶P, 与微生物群落进行冗余分析,保证方差膨胀系数(Variance Inflation Factor,VIF)均<15。
2 结果与分析 2.1 不同林分类型下土壤微生物群落组成和多样性 2.1.1 土壤微生物群落组成如图 1和图 2所示,在细菌门水平上,3种林分类型土壤中浮霉菌门(Planctomycetes)的平均相对丰度最高,为23.71%,其在竹茶混交林和毛竹纯林土壤中的相对丰度显著高于常绿阔叶林(P<0.05);常绿阔叶林土壤中酸杆菌门(Acidobacteria)的相对丰度显著高于毛竹纯林(P<0.05);竹茶混交林和毛竹纯林土壤中放线菌门(Actinobacteria)的相对丰度显著高于常绿阔叶林(P<0.05)。在属水平上,毛竹纯林土壤中浮霉菌门的f_Gemmataceae_g_uncultured和f_Isosphaeraceae_g_uncultured、变形菌门(Proteobacteria)的f_Xanthobacteraceae_g_uncultured的相对丰度均显著高于常绿阔叶林(P<0.05)。常绿阔叶林土壤中酸杆菌门的g_Subgroup_2和o_Acidobacteriales_g_uncultured的相对丰度显著高于毛竹纯林(P<0.05)。
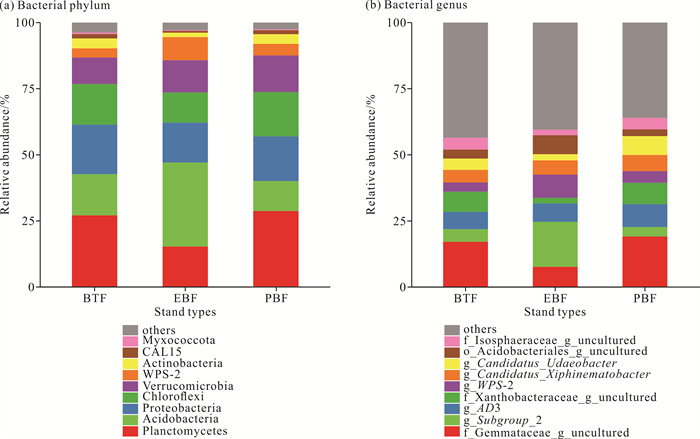
|
| 图 1 3种林分类型土壤细菌群落门、属水平的相对丰度 Fig. 1 Relative abundance of soil bacterial communities of three stand types at phylum and genus levels |
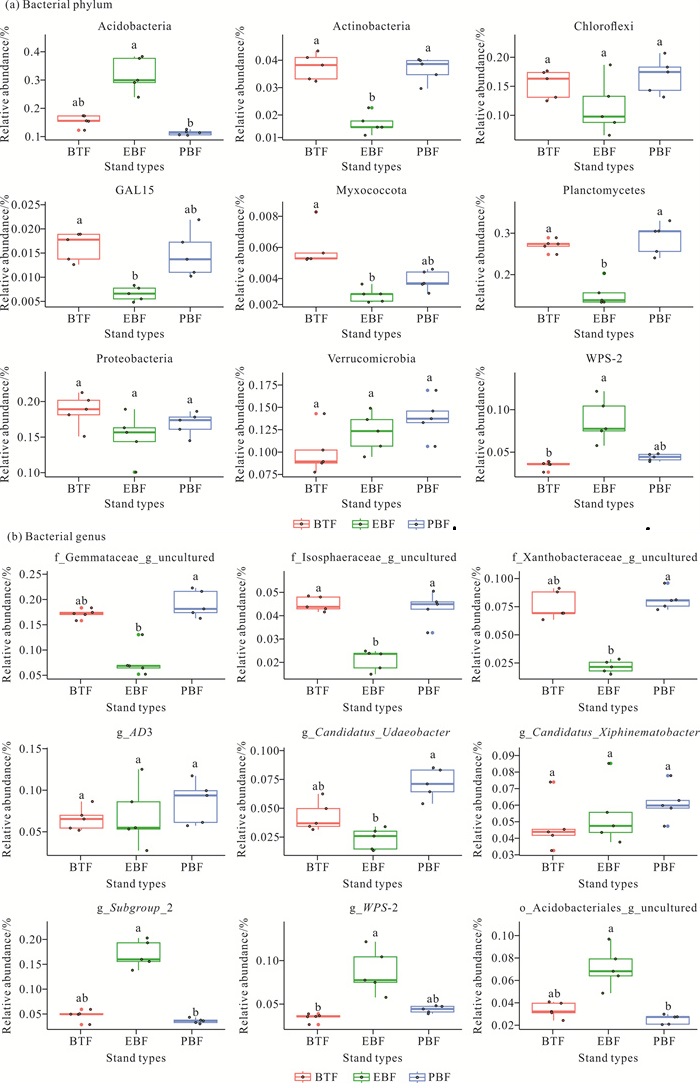
|
| Different lowercase letters in the figure indicated significant differences in the relative abundance of bacterial phylum and genus of different forest types (P < 0.05). 图 2 3种林分类型土壤中门、属水平相对丰度排名前9的细菌组间差异比较 Fig. 2 Comparison of the inter-group differences in the top nine relative abundance of bacterial phylum and genus in soil of three stand types |
如图 3和图 4所示,在真菌门水平上,竹茶混交林和毛竹纯林土壤中梳霉门(Kickxellomycota)的相对丰度显著高于常绿阔叶林(P<0.05);常绿阔叶林土壤中担子菌门(Basidiomycota)的相对丰度显著高于竹茶混交林(P<0.05);竹茶混交林土壤中壶菌门(Chytridiomycota)的相对丰度显著高于常绿阔叶林和毛竹纯林(P<0.05)。在属水平上,竹茶混交林和毛竹纯林土壤中Ramicandelaber_longisporus属的相对丰度显著高于常绿阔叶林(P<0.05);竹茶混交林土壤中Piptocephalis_corymbifera属和Chytridiomycetes_X_sp.属的相对丰度显著高于常绿阔叶林(P<0.05);常绿阔叶林土壤中o_Agaricomycetes_g_uncultured属的相对丰度显著高于竹茶混交林(P<0.05)。
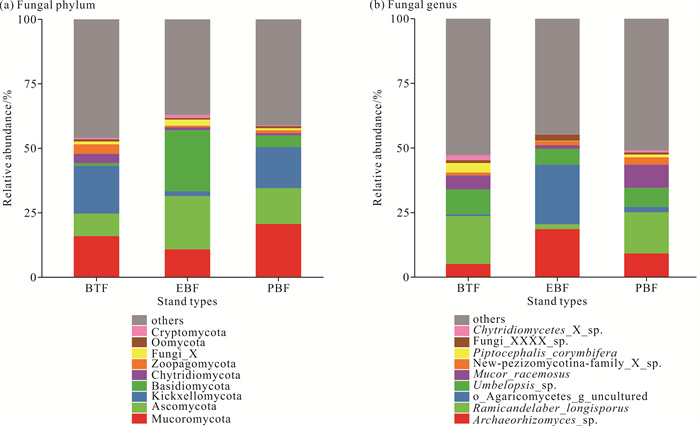
|
| 图 3 3种林分类型土壤真菌群落门、属水平的相对丰度 Fig. 3 Relative abundance of fungal communities in three stand types at phylum and genus levels |
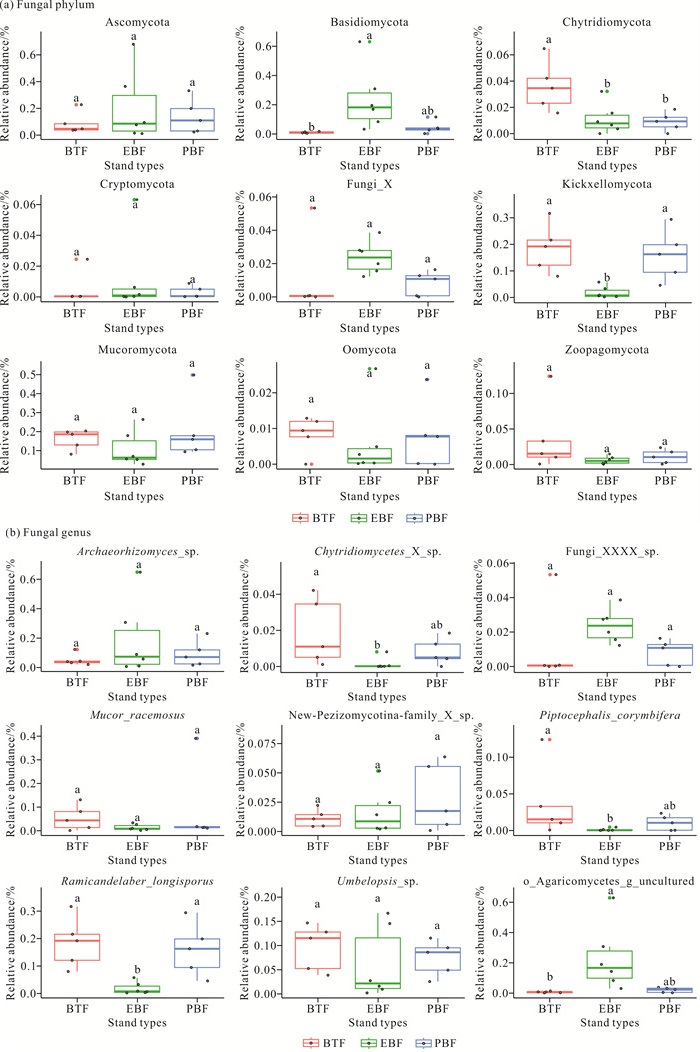
|
| Different lowercase letters in the figure indicated significant differences in the relative abundance of fungal phylum and genera of different stand types (P < 0.05). 图 4 3种林分类型土壤中门、属水平相对丰度排名前9的真菌组间差异比较 Fig. 4 Comparison of the inter-group differences in the top nine relative abundance of fungal phylum and genus in soil of three stand types |
2.1.2 不同林分类型土壤细菌和真菌群落的Alpha和Beta多样性
如表 2所示,毛竹纯林和竹茶混交林土壤细菌群落的Observed species指数显著高于常绿阔叶林,分别提高9.08%和14.02% (P<0.05)。竹茶混交林土壤细菌群落的香农指数显著高于常绿阔叶林(P<0.05)。常绿阔叶林土壤真菌群落的Observed species指数显著高于竹茶混交林(P<0.05)。3种林分类型土壤真菌群落的香农指数均无显著差异。
| 林分类型 Stand types |
Observed species指数 Observed species index |
香农指数 Shannon index |
|||
| 细菌 Bacteria |
真菌 Fungi |
细菌 Bacteria |
真菌 Fungi |
||
| EBF | 931.400±18.663b | 88.670±15.782a | 5.700±0.041b | 2.860±0.551a | |
| PBF | 1 016.000±65.708a | 75.200±9.680ab | 5.770±0.128ab | 3.070±0.229a | |
| BTF | 1 062.000±61.307a | 73.000±5.612b | 5.880±0.089a | 2.940±0.225a | |
| Note: different lowercase letters indicate significant differences among different stand types (P<0.05). | |||||
如图 5所示,常绿阔叶林与毛竹纯林、竹茶混交林土壤细菌和真菌群落样本在PCoA1轴上明显分开且距离较远,无交集。毛竹纯林和竹茶混交林土壤细菌和真菌群落在PCoA1轴上并没有明显分开,样本距离较近且有交集。毛竹纯林和竹茶混交林土壤细菌群落大多数样本在PCoA2轴上有一定的距离。基于Bray-Curtis距离的置换多元方差分析结果显示(图 5),OTUs水平上3种林分类型土壤细菌群落组成总体上差异极为显著(R2=0.68,P=0.001),土壤真菌群落组成总体上差异极为显著(R2=0.30,P=0.001)。如表 3所示,3种林分类型之间土壤细菌群落组成差异显著(P<0.05),竹茶混交林与毛竹纯林、常绿阔叶林之间的土壤真菌群落组成均差异显著(P<0.05)。
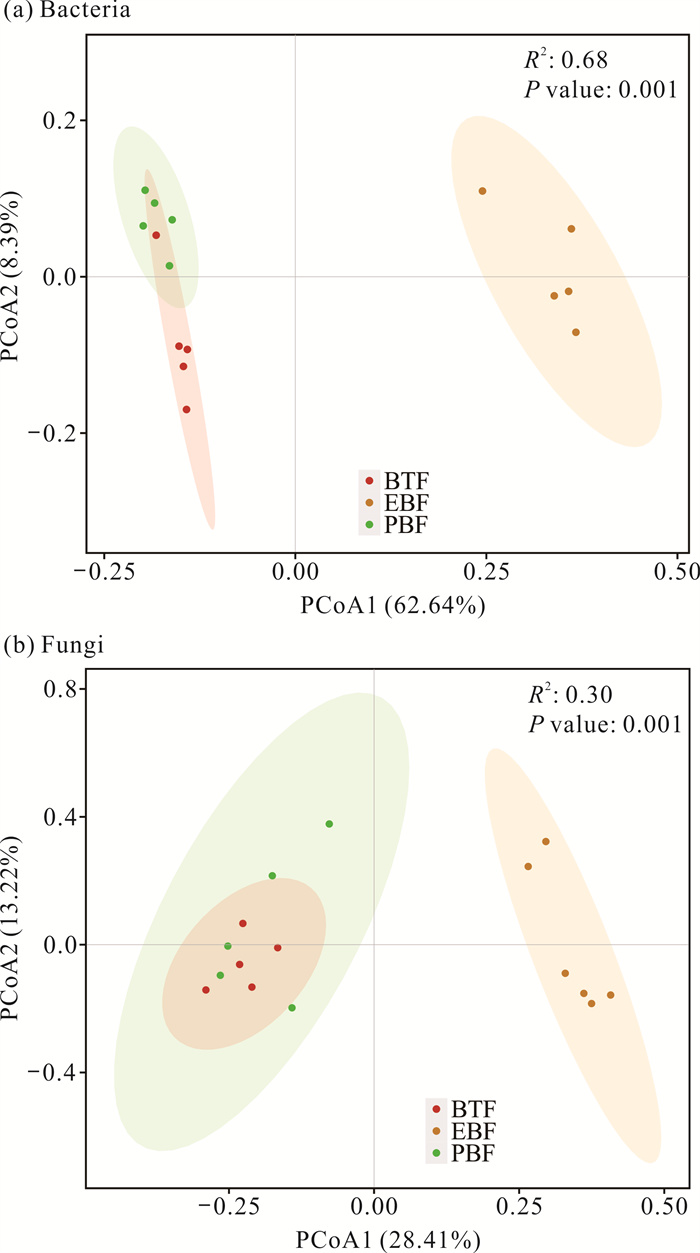
|
| 图 5 土壤细菌和真菌群落基于Bray-Curtis距离的主坐标分析 Fig. 5 Principal coordinate analysis of soil bacterial and fungal communities based on Bray-Curtis distance |
| 林分类型 Stand types |
细菌 Bacteria |
真菌 Fungi |
|||
| R2 | P值 P value |
R2 | P值 P value |
||
| PBF vs EBF | 0.228 | 0.029 0 | 0.118 | 0.201 | |
| PBF vs BTF | 0.673 | 0.019 5 | 0.364 | 0.021 | |
| EBF vs BTF | 0.698 | 0.018 0 | 0.255 | 0.009 | |
| Note: P<0.05 showed that there was significant difference in soil microbial community among stand types. | |||||
2.2 不同林分类型土壤细菌和真菌的网络结构
图 6中的节点代表土壤细菌群落中的门,本研究选取节点占比高于10%的物种进行分析。节点之间的连线代表物种之间的相互作用关系(粉色为正相关,绿色为负相关)。如图 6和表 4所示,在细菌门水平上,常绿阔叶林土壤细菌群落构建的网络由1 533个节点和27 428条相关连线组成,相关关系中99.30%为正相关,0.70%为负相关。毛竹纯林土壤细菌群落构建的网络由1 050个节点和3 202条相关连线组成,相关关系中84.42%为正相关,15.58%为负相关。竹茶混交林土壤细菌群落构建的网络由1 126个节点和8 856条相关连线组成,相关关系中98.43%为正相关,1.57%为负相关。节点主要是浮霉菌门、绿弯菌门(Chloroflexi)、酸杆菌门和变形菌门。
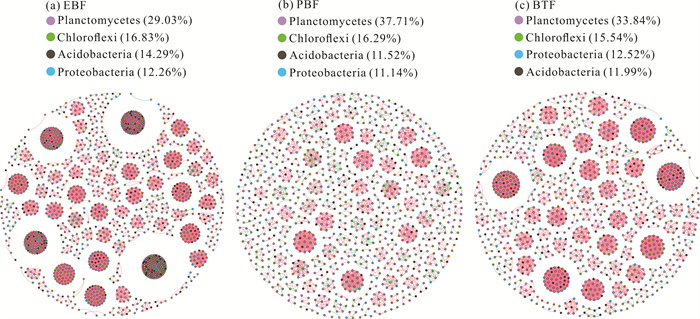
|
| Pink and green line represent positive and negative correlations, respectively. 图 6 3种林分类型土壤细菌网络 Fig. 6 Soil bacteria network of three stand types |
| 微生物群落 Microbial communities |
林分类型 Stand types |
节点数 Nodes |
连接数 Links |
正连接数 Positive links |
平均连通度 Average degree |
网络直径 Network diameter |
模块性 Modularity |
聚集系数 Clustering coefficient |
平均路径长度 Average path distance |
| Bacteria | EBF | 1 533 | 27 428 | 27 236 | 35.783 | 1 | 0.841 | 1 | 1 |
| PBF | 1 050 | 3 202 | 2 703 | 6.099 | 1 | 0.978 | 1 | 1 | |
| BTF | 1 126 | 8 856 | 8 717 | 15.73 | 1 | 0.917 | 1 | 1 | |
| Fungi | EBF | 115 | 191 | 191 | 3.149 | 12 | 0.835 | 0.569 | 4.803 |
| PBF | 58 | 73 | 72 | 2.517 | 5 | 0.843 | 0.745 | 1.785 | |
| BTF | 35 | 26 | 22 | 1.465 | 2 | 0.899 | 0.822 | 1.103 |
图 7中的节点代表土壤真菌群落中的门,本研究选取节点占比高于10%的物种进行分析。节点之间的连线所表示的含义同图 6。如图 7和表 4所示,真菌群落构建的网络节点中有许多未知的物种。常绿阔叶林土壤真菌群落构建的网络由115个节点和191条相关连线组成;节点主要是子囊菌门(Ascomycota);节点间相关关系全部为正相关。毛竹纯林土壤真菌群落构建的网络由58个节点和73条相关连线组成;节点主要是子囊菌门和毛霉门(Mucoromycota);相关关系中98.63%为正相关,1.37%为负相关。竹茶混交林土壤真菌群落构建的网络由35个节点和26条相关连线组成;节点主要是子囊菌门、担子菌门和毛霉门;相关关系中84.62%为正相关,15.38%为负相关。
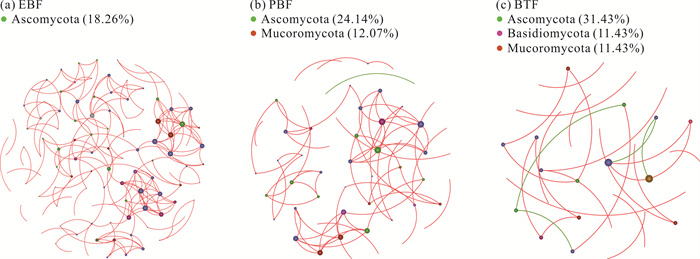
|
| Pink and green line represent positive and negative correlations, respectively. 图 7 3种林分类型土壤真菌网络 Fig. 7 Soil fungi network of three stand types |
2.3 土壤细菌和真菌与土壤理化性质分析
如图 8(a)所示,细菌门水平上浮霉菌门的相对丰度与pH值、根系生物量和N∶P呈极显著正相关;与有机碳、全氮、全磷、土壤含水率和铵态氮呈极显著负相关。酸杆菌门的相对丰度与有机碳、土壤含水率、铵态氮、全氮和全磷呈极显著正相关,与pH值和根系生物量呈极显著负相关。变形菌门的相对丰度与有机碳、C∶N呈极显著负相关。放线菌门的相对丰度与pH值、根系生物量呈极显著正相关;与土壤含水量、有机碳、可溶性有机碳、全氮、全磷、铵态氮和C∶N呈极显著负相关。如图 8(b)所示,真菌门水平上子囊菌门的相对丰度与可溶性有机碳呈极显著正相关;梳霉门的相对丰度与根系生长量呈极显著正相关,与全氮和铵态氮呈极显著负相关。担子菌门的相对丰度与有机碳、C∶N呈极显著正相关。

|
| *P < 0.05, indicates that there is significant difference in soil microbial community among stand types; **P < 0.01, indicates that the difference of soil microbial community among stand types is very significant. 图 8 细菌、真菌优势菌门与理化因子的关系热图 Fig. 8 Heatmap of the relationship between dominant bacterial and fungal phylum and physicochemical factors |
RDA结果(图 9)显示:土壤理化性质解释了土壤细菌群落变异的80.03%,前两个排序轴累计解释了土壤细菌群落变异的51.52%,有机碳、pH值和硝态氮显著影响土壤细菌群落变异(P<0.05)。土壤理化性质解释了土壤真菌群落变异的69.65%,前两个排序轴累计解释了土壤真菌群落变异的32.08%,有机碳和pH值显著影响土壤真菌群落变异(P<0.05)。
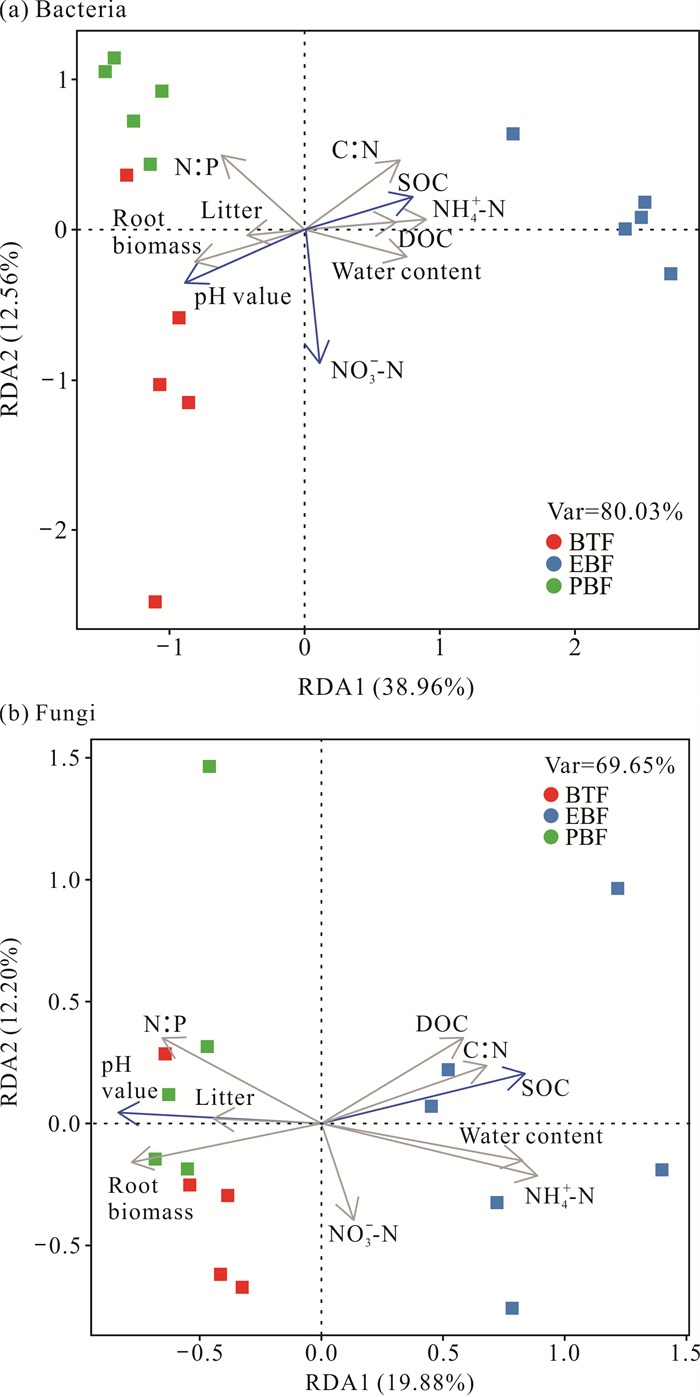
|
| 图 9 土壤细菌、真菌与土壤理化因子冗余分析 Fig. 9 Redundancy analysis of soil bacteria, fungi and soil physicochemical factors |
3 讨论
本研究表明,土地利用变化会影响毛竹林土壤细菌和真菌群落,且常绿阔叶林转为毛竹纯林对土壤微生物的影响高于将毛竹纯林改造为竹茶混交林。这种现象同样出现于其他地区的毛竹林土地利用变化过程[17]。这可能是由于微生物自身特性对环境的改变产生响应,同时环境改变导致土壤有机质数量和质量都发生变化,有机质作为底物进而改变了微生物群落结构[18, 19]。例如,酸杆菌门作为常绿阔叶林的优势菌群,对环境变化较为敏感[20],主要参与有机质分解[21],它们大多属于生长较慢的寡营养细菌,在环境改变的情况下容易被其他生长较快的微生物取代[7, 22];在本研究中常绿阔叶林转为毛竹纯林后酸杆菌门的相对丰度下降了64.31% (P<0.05)。土壤pH值是影响微生物生长的关键因素,微生物都有其适宜的pH值范围,有研究表明pH值升高有利于放线菌门细菌繁殖[23]。在本研究中浮霉菌门、放线菌门的相对丰度与pH值呈极显著正相关(P<0.05),常绿阔叶林转为毛竹纯林后,浮霉菌门和放线菌门的相对丰度分别提高了87.87%和117.65% (P<0.05)。这可能是常绿阔叶林转为毛竹纯林后,土壤pH值显著升高(P<0.05),土壤酸性降低,有利于不耐酸性土壤的微生物生长。并且本研究中浮霉菌门、放线菌门的相对丰度与根系生物量呈极显著正相关(P<0.05),而毛竹由于根系发达,竹林细根的生长和周转速度均快于常绿阔叶林[24, 25],这可能也是浮霉菌门和放线菌门相对丰度增加的原因之一。在真菌方面,担子菌门的相对丰度往往与土壤养分密切联系,作为菌根真菌的重要成员,它能够拮抗植物根部病原菌,防止根部病原菌对植物生长产生不利影响,为植物的生长提供健康的土壤微生物生态环境[26, 27]。常绿阔叶林转为毛竹纯林的过程中,担子菌门的相对丰度有降低的趋势;毛竹纯林改造为竹茶混交林后,担子菌门的相对丰度继续降低,最终竹茶混交林土壤中担子菌门的相对丰度显著低于常绿阔叶林土壤(P<0.05),可能是频繁的人为扰动不利于土壤中植物纤维素的累积且不利于土壤和植被环境的稳定,而较为稳定的林地环境以及植物残体的累积才有利于担子菌门的生长[27]。
常绿阔叶林转为毛竹纯林提高了林地土壤细菌多样性,但会使真菌多样性下降,说明细菌群落与真菌群落之间对这种干扰的适应性存在差异,这可能与细菌和真菌具有不同的营养偏好和抗干扰能力有关[26]。徐凡迪等[28]研究表明在针叶林、针阔混交林和常绿阔叶林中,受人为干扰较强的针叶林土壤具有更高的细菌丰富度和多样性。干扰越强,越能动摇优势菌群的地位,形成生态位的空缺,从而促进细菌多样性提高。本研究结果与上述研究结果一致,3种林分类型受干扰的强度排序为竹茶混交林>毛竹纯林>常绿阔叶林,人为干扰越强,细菌多样性越高。真菌喜欢偏酸性的土壤[29],而在本研究中将常绿阔叶林转为毛竹纯林会使土壤pH值升高(P<0.05),不利于真菌生长。有研究表明真菌在凋落物分解上起重要作用[30, 31],而毛竹凋落物的质量和周转率均低于常绿阔叶林凋落物[32],这可能是本研究中土壤真菌群落丰富度降低的原因之一。毛竹纯林改造为竹茶混交林对土壤细菌和真菌多样性影响较小,这主要是因为竹-茶混交并没有改变毛竹在乔木层的主导地位,而毛竹的凋落物和根系生物量深刻影响着土壤环境和微生物。
土地利用变化显著改变微生物共生网络的稳定性和复杂性[33]。常绿阔叶林转为毛竹纯林会造成细菌和真菌群落的稳定性下降、协同作用减弱,这可能是因为土壤养分下降以及优势菌群变化使得细菌与真菌之间的竞争加剧。这种稳定性下降的现象在毛竹入侵常绿阔叶林的过程中也有发现[34]。但是毛竹纯林改造为竹茶混交林会使土壤细菌群落的稳定性提高、协同作用增强,分析认为毛竹纯林经营模式中周期性地清除林下凋落物不利于土壤的稳定,而茶树作为竹农的重要经济来源,不会被砍伐,且混种模式提高了地下资源利用率[35],因而维持了毛竹林林下土壤细菌群落的稳定性。Ding等[36]研究发现杉木(Cunninghamia lanceolata)混交林土壤细菌群落的稳定性比杉木纯林更高、群落协同作用更强,同样表明了扰动对细菌群落具有积极作用。将毛竹纯林改造为竹茶混交林会使土壤真菌群落的稳定性下降且真菌之间的竞争继续加剧,说明真菌与细菌对干扰的反馈机制存在差异性。与细菌相比,真菌群落对树木凋落物的依赖性更强,并且很多真菌可以与树种根系共生形成菌根[37],而毛竹林的凋落物质量差可能是毛竹林土壤真菌群落稳定性降低和竞争加强的原因。也有研究表明土壤真菌群落响应滞后于细菌[38],对于土壤细菌和真菌群落的响应需要差异性对待研究。
土壤环境因素是影响微生物群落多样性和稳定性变化的关键。本研究中土壤理化性质较好地解释了土壤细菌群落的变异,解释度高达80.03%。其中,土壤有机碳和pH值是影响微生物群落多样性的环境因子。土壤有机碳是微生物生长的重要养分,其含量越高越有利于促进微生物生长。不同微生物对不同酸碱度土壤的适应能力也不相同,土地利用变化改变了土壤pH值,间接影响微生物的群落结构。
4 结论毛竹林土壤细菌和真菌群落多样性对土地利用变化具有明显的差异性响应。常绿阔叶林转为毛竹纯林会增加土壤细菌的多样性,同时造成土壤细菌和真菌群落的稳定性降低、拮抗作用增强。毛竹纯林改造为竹茶混交林后,土壤细菌群落的多样性和稳定性以及细菌群落内的协同作用均有一定的提升;但真菌群落存在相反响应。土壤有机碳和pH值是影响土壤微生物群落的主要因素。因此,毛竹林管理应注重优化土壤微生物群落组成,以提升土壤微生物群落的稳定性和土壤质量。而竹茶混交改造在一定程度上可以提升毛竹纯林土壤细菌的稳定性和土壤质量。
| [1] |
国家林业和草原局. 中国森林资源报告(2014-2018)[M]. 北京: 中国林业出版社, 2019.
|
| [2] |
蔡春菊, 范少辉, 刘广路, 等. 竹林复合经营研究和发展现状[J]. 世界竹藤通讯, 2018, 16(5): 47-52. |
| [3] |
张薇, 魏海雷, 高洪文, 等. 土壤微生物多样性及其环境影响因子研究进展[J]. 生态学杂志, 2005, 24(1): 48-52. |
| [4] |
周桔, 雷霆. 土壤微生物多样性影响因素及研究方法的现状与展望[J]. 生物多样性, 2007, 15(3): 306-311. DOI:10.3321/j.issn:1005-0094.2007.03.012 |
| [5] |
张雯雯, 徐军, 董丰收, 等. 苄嘧磺隆对水稻田土壤微生物群落功能多样性的影响[J]. 农业环境科学学报, 2014, 33(9): 1749-1754. |
| [6] |
王光华, 金剑, 徐美娜, 等. 植物、土壤及土壤管理对土壤微生物群落结构的影响[J]. 生态学杂志, 2006, 25(5): 550-556. DOI:10.3321/j.issn:1000-4890.2006.05.017 |
| [7] |
施宇森, 王杉杉, 方伟, 等. 基于Meta分析研究毛竹入侵致土壤pH提升及养分和微生物群落结构的变化[J]. 土壤学报, 2024, 61(3): 862-877. |
| [8] |
CHANG E H, CHIU C Y. Changes in soil microbial community structure and activity in a cedar plantation invaded by moso bamboo[J]. Applied Soil Ecology, 2015, 91: 1-7. DOI:10.1016/j.apsoil.2015.02.001 |
| [9] |
马鑫茹, 郑旭理, 郑春颖, 等. 毛竹扩张对常绿阔叶林土壤微生物群落的影响[J]. 应用生态学报, 2022, 33(4): 1091-1098. |
| [10] |
曹小青, 王亮, 孙孟瑶, 等. 不同年限毛竹-白及复合系统土壤微生物群落多样性特点[J]. 中国土壤与肥料, 2022(1): 147-154. |
| [11] |
刘鑫铭, 饶惠玲, 丁新新, 等. 不同混交类型对毛竹林土壤有机碳和土壤呼吸的影响[J]. 应用与环境生物学报, 2021, 27(1): 71-80. |
| [12] |
漆良华, 范少辉, 杜满义, 等. 湘中丘陵区毛竹纯林、毛竹-杉木混交林土壤有机碳垂直分布与季节动态[J]. 林业科学, 2013, 49(3): 17-24. |
| [13] |
刘广路, 范少辉, 官凤英, 等. 闽西北不同类型集约经营毛竹林土壤环境特征[J]. 南京林业大学学报(自然科学版), 2010, 34(5): 17-22. |
| [14] |
汪结超, 曾德亮, 陈怀平. 太湖县毛竹林下复合经营的研究[J]. 安徽林业科技, 2019, 45(3): 45-47. |
| [15] |
曹意, 丁苏雅, 覃云斌, 等. 竹茶混交模式对表层土壤有机碳储量及组分的影响[J]. 广西植物, 2023, 43(9): 1668-1677. |
| [16] |
蒋玉凤. 民族团结进步事业的成功实践: 桂林兴安县华江瑶族乡和谐发展模式探析[J]. 中共桂林市委党校学报, 2009, 9(3): 48-51. |
| [17] |
WANG X, SASAKI A, TODA M, et al. Changes in soil microbial community and activity in warm temperate forests invaded by moso bamboo (Phyllostachys pubescens)[J]. Journal of Forest Research, 2016, 21: 235-243. |
| [18] |
RASCHE F, KNAPP D, KAISER C, et al. Seasonality and resource availability control bacterial and archaeal communities in soils of a temperate beech forest[J]. The ISME Journal, 2011, 5: 389-402. |
| [19] |
LAUBER C L, RAMIREZ K S, AANDERUD Z, et al. Temporal variability in soil microbial communities across land-use types[J]. The ISME Journal, 2013, 7(8): 1641-1650. |
| [20] |
徐墨馨, 叶丽丽, 陈永山, 等. 典型砷污染场地及周边生境土壤微生物群落结构及分子网络特征[J]. 生态学杂志, 2024, 43(5): 1426-1433. |
| [21] |
邓娇娇, 周永斌, 殷有, 等. 辽东山区典型人工针叶林土壤细菌群落多样性特征[J]. 生态学报, 2019, 39(3): 997-1008. |
| [22] |
刘彩霞, 董玉红, 焦如珍. 森林土壤中酸杆菌门多样性研究进展[J]. 世界林业研究, 2016, 29(6): 17-22. |
| [23] |
赵晓蕊, 吴华勇, 张甘霖. 典型网纹红土结构土壤细菌群落及其生态网络特征[J]. 土壤, 2022, 54(5): 986-992. |
| [24] |
方韬, 李永春, 姚泽秀, 等. 种植阔叶树种和毛竹对土壤有机碳矿化与微生物群落结构的影响[J]. 应用生态学报, 2021, 32(1): 82-92. |
| [25] |
刘骏, 杨清培, 余定坤, 等. 细根对竹林-阔叶林界面两侧土壤养分异质性形成的贡献[J]. 植物生态学报, 2013, 37(8): 739-749. |
| [26] |
王玖程, 王兴明, 董思奇, 等. 吉林省中部地区退耕还林对黑土土壤细菌和真菌群落结构的影响[J]. 农业资源与环境学报, 2023, 40(4): 917-923. |
| [27] |
张蕾, 王强, 杨新月, 等. 黄土丘陵区退耕还林对土壤真菌群落的影响[J]. 环境科学, 2023, 44(3): 1758-1767. |
| [28] |
徐凡迪, 李帅锋, 苏建荣. 云南松林次生演替阶段土壤细菌群落的变化[J]. 应用生态学报, 2021, 32(3): 887-894. |
| [29] |
陈法霖, 郑华, 欧阳志云, 等. 土壤微生物群落结构对凋落物组成变化的响应[J]. 土壤学报, 2011, 48(3): 603-611. |
| [30] |
陈法霖, 张凯, 郑华, 等. PCR-DGGE技术解析针叶和阔叶凋落物混合分解对土壤微生物群落结构的影响[J]. 应用与环境生物学报, 2011, 17(2): 145-150. |
| [31] |
管鸿智, 黄荣珍, 朱丽琴, 等. 红壤区不同生态恢复林分的土壤微生物群落差异[J]. 森林与环境学报, 2023, 43(2): 177-184. |
| [32] |
SONG Q N, OUYANG M, YANG Q P, et al. Degradation of litter quality and decline of soil nitrogen mineralization after moso bamboo (Phyllostachys pubscens) expansion to neighboring broadleaved forest in subtropical China[J]. Plant and Soil, 2016, 404: 113-124. DOI:10.1007/s11104-016-2835-z |
| [33] |
YANG Y, CHAI Y B, XIE H J, et al. Responses of soil microbial diversity, network complexity and multifunctionality to three land-use changes[J]. Science of the Total Environment, 2023, 859: 160255. |
| [34] |
LI S Y, XIE D, GE X G, et al. Altered diversity and functioning of soil and root-associated microbiomes by an invasive native plant[J]. Plant and Soil, 2022, 473: 235-249. DOI:10.1007/s11104-022-05338-z?utm_content=meta |
| [35] |
EHRMANN J, RITZ K. Plant: soil interactions in temperate multi-cropping production systems[J]. Plant and Soil, 2014, 376: 1-29. DOI:10.1007/s11104-013-1921-8 |
| [36] |
DING K, ZHANG Y T, LIU H Y, et al. Soil bacterial community structure and functions but not assembly processes are affected by the conversion from monospecific Cunninghamia lanceolata plantations to mixed plantations[J]. Applied Soil Ecology, 2023, 185: 104775. |
| [37] |
宋战超, 王晖, 刘世荣, 等. 南亚热带混交人工林树种丰富度与土壤微生物多样性和群落组成的关系[J]. 生态学报, 2020, 40(22): 8265-8273. |
| [38] |
于晶晶, 丛微, 丁易, 等. 不同干扰方式下热带雨林土壤微生物群落自然恢复特征和构建机制[J]. 生态学杂志, 2023, 42(3): 534-543. |



