2. 广西壮族自治区中国科学院广西植物研究所, 广西植物功能物质与资源持续利用重点实验室, 广西桂林 541006
2. Guangxi Key Laboratory of Plant Functional Phytochemicals and Sustainable Utilization, Guangxi Institute of Botany, Guangxi Zhuang Autonomous Region and Chinese Academy of Sciences, Guilin, Guangxi, 541006, China
海南风吹楠(Horsfieldia hainanensis)属肉豆蔻科(Myristicaceae)风吹楠属(Horsfieldia)乔木,民间常将其称为假玉果、水枇杷等,其主要分布于中国的海南和广西,常生于山谷、丘陵湿润阴暗的茂密森林中,并具有较高的观赏、材用、科学研究和药用价值[1-7]。海南风吹楠的叶、皮常用于治疗小儿疳积[8]。此外,黎族民间将海南风吹楠的枝叶煮饭或泡酒,用于妇女产后恢复,是一种活血、补血的良药,当地人称之为“仙人血”“血树”[9, 10]。
风吹楠属植物含有丰富的黄酮类活性成分。彭伟[11]发现风吹楠属植物的主要化学成分是1, 3-二芳基丙烷和1, 3-二芳基丙烷二聚体,而二芳基丙烷是一类很少见的黄酮类化合物,具有抗菌、抗疟疾、抗氧化、抗病毒等作用。邝芳等[12]从琴叶风吹楠(H.pandurifolia)中分离纯化得到8个黄酮类化合物,其中3个黄酮类化合物为首次从该种植物中分离得到。童应成[13]从大叶风吹楠(H.kingii)中分离得到多个黄酮类化合物,其中一些化合物在其发挥的药理活性中具有重要作用。马琴等[14]则综述了风吹楠属植物的化学成分和药理活性研究进展,提及国外学者从不同种风吹楠属植物中分离鉴定了黄酮、色原酮、木脂素、生物碱、芳基酮等类型化合物,其中分离得到的黄酮类化合物数量最多,为11个,且部分化合物具有一定的药理活性。目前, 关于海南风吹楠的研究主要集中在其生态学特征[15]、遗传多样性[16]等方面,对其活性成分等方面的相关研究仍鲜有报道。本研究对海南风吹楠的总黄酮含量测定及提取工艺进行优化,采用超声辅助提取法和响应面法优化海南风吹楠的各个提取条件,确定最佳提取工艺,进一步提升海南风吹楠的总黄酮提取率,并测定海南风吹楠总黄酮的1,1-二苯基-2-三硝基苯肼自由基(DPPH·)清除率、羟自由基(·OH)清除率、超氧阴离子自由基(O2-·)清除率,以达到评价其抗氧化能力的目的,以期为海南风吹楠资源的合理开发及应用提供科学理论依据。
1 材料与方法 1.1 材料海南风吹楠成年树、幼树、幼苗的根、茎、叶(样品凭证存放于广西植物研究所广西植物功能物质与资源持续利用重点实验室)均采自广西崇左市龙州县,经广西植物研究所韦霄研究员鉴定均为海南风吹楠(Horsfieldia hainanensis Merr.)。
1.2 试剂和仪器试剂:芦丁对照品(B20771-100 mg,HPLC≥98%,上海源叶生物科技有限公司),L-抗坏血酸、氢氧化钠、亚硝酸钠、硝酸铝、无水乙醇等(均为分析纯),总抗氧化能力(DPPH法)、羟自由基清除能力、超氧阴离子自由基清除能力试剂盒(苏州科铭生物技术有限公司)。
仪器:TU-1901型双光束紫外可见分光光度计(北京普析通用仪器有限责任公司),DL-720E型智能超声波、AE200S型万分之一电子分析天平[梅特勒-托利多仪器(上海)有限公司],HH-S4型数显恒温水浴锅(常州金坛双捷实验仪器厂),Multifuge X1R型台式高速冷冻离心机[赛默飞世尔科技(中国)有限公司],QE-100型高速粉碎机(浙江屹立工贸有限公司),101A-3型电热恒温鼓风干燥箱(上海跃进医疗器械有限公司)。
1.3 方法 1.3.1 样品处理将采集到的海南风吹楠各组织部位(根、茎、叶)洗净,在60 ℃条件下烘干48 h,粉碎后过60目筛,制成样品粉末,备用。
1.3.2 标准曲线的制备精密称取13.2 mg芦丁,放置于25 mL容量瓶中,用无水乙醇定容,制成0.528 mg/mL芦丁标准品溶液。精确吸取芦丁标准品溶液0.0、0.4、0.8、1.2、1.6、2.0 mL,分别放入25 mL容量瓶内,无水乙醇溶液定容;分别吸取定容后的溶液2 mL,加入5%亚硝酸钠溶液2 mL,摇匀后放置6 min,加入5%硝酸铝溶液2 mL,摇匀后放置6 min,加入4%氢氧化钠溶液4 mL,摇匀后用无水乙醇稀释至刻度线,放置15 min后,在510 nm处测得吸光值。计算回归方程,回归方程为y=8.5384x-0.0078,R2=0.999 8。
1.3.3 供试品溶液的制备准确称取0.5 g样品粉末,按照1∶50 (g/mL)的料液比,加入无水乙醇25 mL,在60 ℃、300 W的条件下超声辅助提取30 min,过滤,复提3次,定容于100 mL容量瓶中,4 ℃避光保存备用。按照1.3.2节步骤加样,测定吸光值并根据公式(1)计算总黄酮含量。
| $ \text { 总黄酮含量 }(\%)=\frac{C_1 \times N_1 \times V_1}{V_2 \times W_1} \times 100 \% \text { ,} $ | (1) |
式中,C1为标准曲线计算得到的浓度,N1为稀释倍数,V1为样液总体积,V2为取样体积,W1为样品质量。
1.3.4 最大吸收波长的确定精确吸取1.3.2节标准品溶液和1.3.3节供试品溶液各2 mL,分别置于25 mL容量瓶中。按照1.3.2节的方法加样操作,用蒸馏水代替供试品溶液并以相同方法处理后的空白试剂作为参比溶液,于300-600 nm波长下扫描,发现在510 nm处吸光值最大,故选择510 nm作为最大吸收波长。
1.4 单因素试验 1.4.1 料液比对海南风吹楠总黄酮含量的影响选取海南风吹楠叶片作为单因素试验对象,准确称取样品粉末0.5 g,按照1∶40、1∶50、1∶60、1∶70、1∶80 (g/mL)的料液比,加入60%乙醇,在提取温度40 ℃、提取频率300 W的条件下分别超声辅助提取10 min,过滤,复提3次,定容于150 mL的容量瓶中。按照1.3.2节的方法加样操作,于510 nm处测定吸光值,计算总黄酮含量。每种处理做3组重复,选取最佳料液比,进行下一步单因素试验。
1.4.2 乙醇浓度对海南风吹楠总黄酮含量的影响准确称取样品粉末0.5 g,按照料液比为1∶70 (g/mL),分别加入20%、40%、60%、80%、100%乙醇,在提取温度40 ℃、提取频率300 W的条件下分别超声辅助提取10 min,过滤,复提3次,定容于150 mL的容量瓶中。按照1.3.2节的方法加样操作,于510 nm处测定吸光值,计算总黄酮含量。每种处理做3组重复,选取最佳乙醇浓度,进行下一步单因素试验。
1.4.3 提取温度对海南风吹楠总黄酮含量的影响准确称取样品粉末0.5 g,按照料液比为1∶70 (g/mL),加入100%乙醇,在提取温度为40、50、60、70、80 ℃,提取频率300 W的条件下分别超声辅助提取10 min,过滤,复提3次,定容于150 mL的容量瓶中。按照1.3.2节方法加样操作,于510 nm处测定吸光值,计算总黄酮含量。每种处理做3组重复,选取最佳提取温度,进行下一步单因素试验。
1.4.4 提取时间对海南风吹楠总黄酮含量的影响准确称取样品粉末0.5 g,按照料液比为1∶70 (g/mL),加入100%乙醇,在提取温度60 ℃、提取功率300 W的条件下分别超声辅助提取10、30、60、90、120 min,过滤,复提3次,定容于150 mL的容量瓶中。按照1.3.2节方法加样操作,于510 nm处测定吸光值,计算总黄酮含量。每种处理做3组重复,选取最佳提取时间。
1.5 响应面分析选取海南风吹楠叶片作为响应面试验对象,根据单因素试验结果,利用Design Expert 11软件设计响应面试验。因最佳乙醇浓度为100%,故只以料液比(A)、提取温度(B)、提取时间(C)为自变量,以海南风吹楠的总黄酮含量(Y)为考察指标,共计17个试验点进行组合试验,因素与水平见表 1。通过Design Expert 11软件做出A、B、C 3个因素交互作用的响应面图和等高线图,可以显著反映各因素之间相互作用的强弱。两个影响因素和响应量所形成的响应曲面坡度越陡峭,等高线形状越接近椭圆形,则说明两个因素交互作用越强,反之则越弱[17]。
| 水平 Level |
A: 料液比 A: Solid-liquid ratio |
B: 提取温度/℃ B: Extraction temperature/℃ |
C: 提取时间/min C: Extraction time/min |
| -1 | 1∶60 | 50 | 30 |
| 0 | 1∶70 | 60 | 60 |
| 1 | 1∶80 | 70 | 90 |
1.6 抗氧化活性的测定 1.6.1 DPPH·清除能力测定
使用总抗氧化能力(DPPH法)试剂盒,测定从海南风吹楠成年树不同组织部位中所提取的总黄酮的总抗氧化能力。以L-抗坏血酸作为阳性对照,分别向空白管加入50 μL提取液,再加入950 μL试剂;测定管加入50 μL海南风吹楠总黄酮提取液,再加入950 μL试剂1,充分混匀,室温避光反应20 min。将紫外可见分光光度计预热30 min,调节波长至515 nm, 于1 mL玻璃比色皿中测定吸光值。其中提取液:无水醋酸钠-冰醋酸溶液;试剂1:DPPH溶于甲醇溶液。根据公式(2)计算DPPH·清除率。
| $ \mathrm{DPPH} \cdot \text { 清除率 }(\%)=\frac{A_{\text {空白 }}-A_{\text {测定 }}}{A_{\text {空白 }}} \times 100 \%, $ | (2) |
式中,A空白为空白管的吸光值;A测定为测定管的吸光值。
1.6.2 ·OH清除能力测定使用羟自由基清除能力试剂盒,测定从海南风吹楠成年树不同组织部位中所提取的总黄酮的羟自由基清除能力。以L-抗坏血酸作为阳性对照,向对照管加入150 μL试剂1和150 μL试剂2、750 μL蒸馏水、300 μL试剂3;空白管中加入150 μL试剂1、900 μL蒸馏水、300 μL试剂3;测定管中加入150 μL试剂1和150 μL试剂2、450 μL蒸馏水、300 μL试剂3和300 μL海南风吹楠总黄酮提取液。充分混匀后,37 ℃保温20 min。将紫外可见分光光度计预热30 min,调节波长至510 nm,于1 mL玻璃比色皿中测定吸光值。其中试剂1:水杨酸-乙醇溶液;试剂2:FeSO4·7H2O溶液;试剂3:H2O2溶液。根据公式(3)计算·OH清除率。
| $ \text { · } \mathrm{OH} \text { 清除率 }(\%)=\frac{A_{\text {对照 }}-A_{\text {测定 }}}{A_{\text {对照 }}-A_{\text {空白 }}} \times 100 \%, $ | (3) |
式中,A对照为对照管的吸光值;A测定为测定管的吸光值;A空白为空白管的吸光值。
1.6.3 O2-·清除能力测定使用超氧阴离子清除能力试剂盒,测定从海南风吹楠成年树不同组织部位中所提取的总黄酮的超氧阴离子清除能力。以L-抗坏血酸作为阳性对照,对照管和测定管分别加入40 μL试剂1和160 μL试剂2,再向对照管中加入100 μL蒸馏水,充分混匀,25 ℃反应1 min后,对照管加入200 μL试剂3,测定管加入100 μL海南风吹楠总黄酮提取液和200 μL试剂3,37 ℃反应30 min,再向对照管和测定管中分别加入200 μL试剂4和200 μL试剂5,充分混匀,37 ℃显色20 min。将紫外可见分光光度计预热30 min,调节波长至530 nm,于1 mL玻璃比色皿中测定吸光值。其中试剂1:Tris-HCL溶液,含四甲基乙二胺(TEMED);试剂2:过硫酸铵;试剂3:盐酸羟胺溶液;试剂4:对氨基苯磺酸-醋酸溶液;试剂5:α-萘胺-醋酸溶液。根据公式(4)计算O2-·清除率。
| $ \mathrm{O}_2{ }^{-} \text {清除率 }(\%)=\frac{A_{\text {对照 }}-A_{\text {测定 }}}{A_{\text {对照 }}} \times 100 \%, $ | (4) |
式中,A对照为对照管的吸光值;A测定为测定管的吸光值。
1.7 数据处理使用SPSS 20.0、Origin 2022、Design Expert 11等软件对试验数据进行分析并作图。
2 结果与分析 2.1 单因素试验 2.1.1 料液比对海南风吹楠总黄酮含量的影响由图 1可知,海南风吹楠总黄酮含量随着料液比的增加,主要呈先上升后下降的峰型趋势,其中料液比在1∶40-1∶60区间总黄酮含量的变化趋势较平缓,1∶60-1∶80区间总黄酮含量的变化趋势较剧烈。当料液比为1∶70时,总黄酮含量最高,为2.6%。当料液比较小时,总黄酮含量较低的原因可能是所加溶剂较少,无法将黄酮类成分充分提取出来。当料液比较大时,总黄酮含量出现下降的现象,可能是因为溶剂含量增大,促进样品中其他杂质溶出,从而导致提取出的总黄酮含量下降。当料液比为1∶70-1∶80时,总黄酮含量呈急剧下降趋势,可能是样品中总黄酮的溶出受到溶液中浓度差的影响。因此,确定最佳料液比为1∶70。
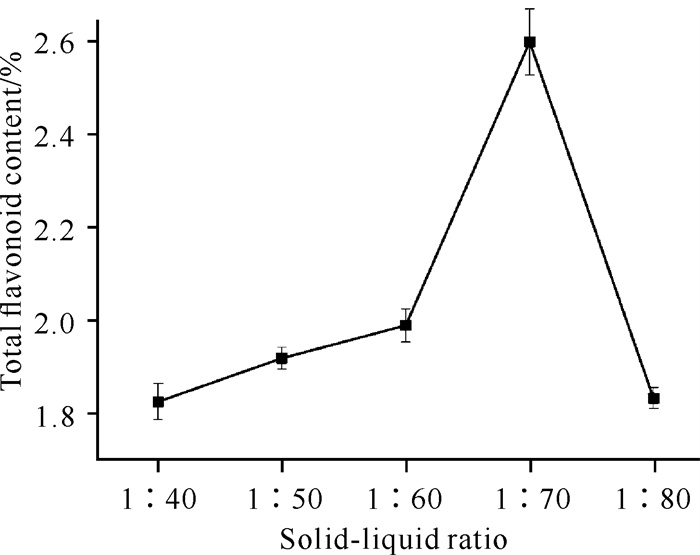
|
| 图 1 料液比对海南风吹楠总黄酮含量的影响 Fig. 1 Effect of solid-liquid ratio on the total flavonoid content of H.hainanensis |
2.1.2 乙醇浓度对海南风吹楠总黄酮含量的影响
由图 2可知,海南风吹楠总黄酮含量随着乙醇浓度的升高,呈现出持续上升趋势。当乙醇浓度为100%时,海南风吹楠总黄酮含量最高,为5.1%;乙醇浓度为20%-80%时,上升趋势均较为平缓;为80%-100%时,呈现急剧上升趋势。可能是因为大部分总黄酮类成分呈弱极性或非极性,根据相似相溶的原理,随着乙醇浓度的持续增加,溶剂极性不断减弱,从而促进大部分黄酮类成分溶出。因此,确定最佳乙醇浓度为100%。
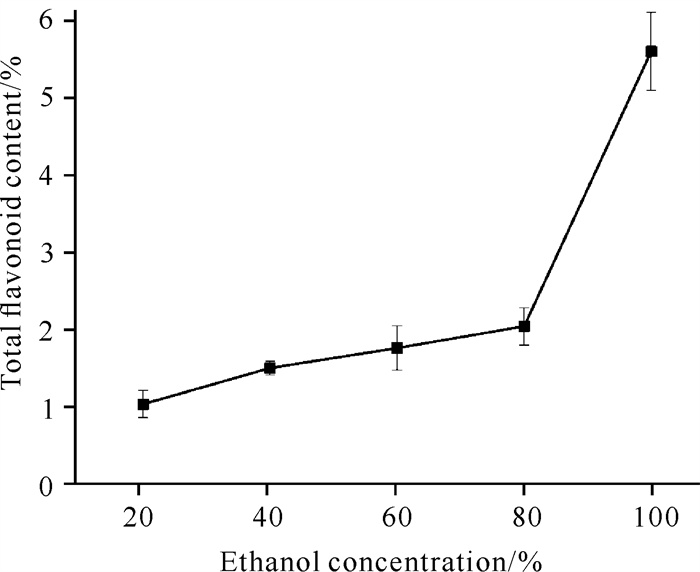
|
| 图 2 乙醇浓度对海南风吹楠总黄酮含量的影响 Fig. 2 Effect of ethanol concentration on the total flavonoid content of H.hainanensis |
2.1.3 提取温度对海南风吹楠总黄酮含量的影响
由图 3可知,海南风吹楠总黄酮含量随着提取温度的增加,主要呈先上升后下降的峰型趋势。当提取温度为60 ℃时,总黄酮含量最高,为5.9%。低温时,随着温度持续升高,溶液中的分子运动加快,溶液黏度尚未饱和,黄酮类成分扩散性增强。温度过高容易导致黄酮类成分结构被破坏,同时样品细胞中其他内容物溶出增多,溶液黏度逐渐饱和,从而抑制黄酮类成分溶出。因此,确定最佳提取温度为60 ℃。
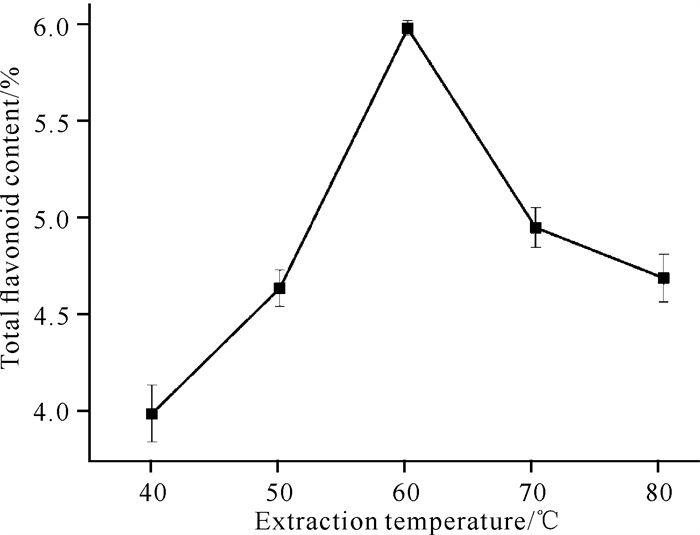
|
| 图 3 提取温度对海南风吹楠总黄酮含量的影响 Fig. 3 Effect of extraction temperature on the total flavonoid content of H.hainanensis |
2.1.4 提取时间对海南风吹楠总黄酮含量的影响
由图 4可知,海南风吹楠总黄酮含量随着提取时间的增加,主要呈先上升后下降的峰型趋势。当提取时间在60 min时,总黄酮含量达到最高,为6.6%。提取时间过短,易导致黄酮类成分溶出不完全,提取出的总黄酮含量下降。随着提取时间的增加,细胞内外的总黄酮浓度趋于平衡,此时总黄酮含量达到最大值。当提取时间继续延长,过长时间的热效应会使黄酮成分结构遭到破坏,其他杂质的溶出增多,使得总黄酮得率进一步下降。因此,确定最佳提取时间为60 min。
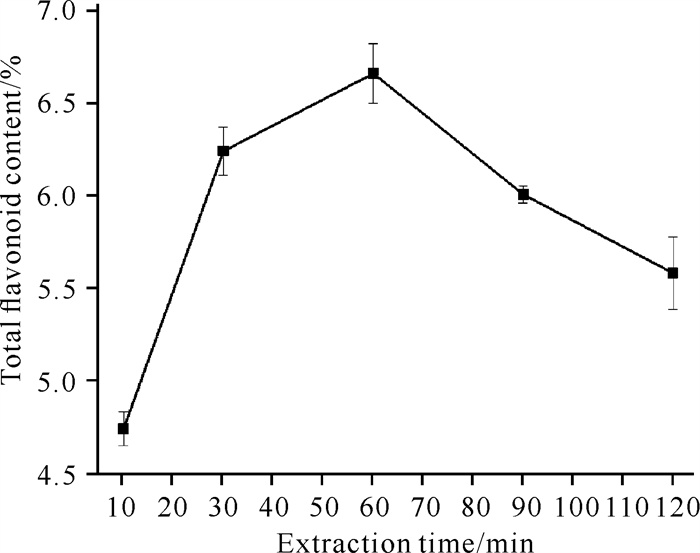
|
| 图 4 提取时间对海南风吹楠总黄酮含量的影响 Fig. 4 Effect of extraction time on the total flavonoid content of H.hainanensis |
2.2 响应面试验 2.2.1 响应面试验结果
根据表 1设定的因素和水平,将料液比(A)、提取温度(B)、提取时间(C)设定为考察因素,并分别设置3个水平,以海南风吹楠成年树总黄酮含量为响应值(Y),共计17个试验点,其中12个为析因点,5个为零点,其响应面试验结果见表 2。
| 试验号 Test number |
A:
料液比 A: Solid- liquid ratio |
B: 提取温度/℃ B: Extraction temper- ature/℃ |
C: 提取时间/min C: Extraction time/min |
总黄酮含量/% Total flavonoid content/% |
| 1 | 1∶60 | 50 | 60 | 4.221 |
| 2 | 1∶80 | 50 | 60 | 4.191 |
| 3 | 1∶60 | 70 | 60 | 5.533 |
| 4 | 1∶80 | 70 | 60 | 5.377 |
| 5 | 1∶60 | 60 | 30 | 2.739 |
| 6 | 1∶80 | 60 | 30 | 3.415 |
| 7 | 1∶60 | 60 | 90 | 3.452 |
| 8 | 1∶80 | 60 | 90 | 3.339 |
| 9 | 1∶70 | 50 | 30 | 4.714 |
| 10 | 1∶70 | 70 | 30 | 4.508 |
| 11 | 1∶70 | 50 | 90 | 4.156 |
| 12 | 1∶70 | 70 | 90 | 5.986 |
| 13 | 1∶70 | 60 | 60 | 7.237 |
| 14 | 1∶70 | 60 | 60 | 7.252 |
| 15 | 1∶70 | 60 | 60 | 7.456 |
| 16 | 1∶70 | 60 | 60 | 7.283 |
| 17 | 1∶70 | 60 | 60 | 7.468 |
2.2.2 回归模型方差分析
使用Design Expert 11软件对海南风吹楠成年树响应面试验结果(表 2)进行回归拟合分析,得到方程Y=7.34+0.0471A+0.5153B+0.1946C-0.0315AB-0.1973AC+0.509BC-2.06A2-0.4520B2-2.05C2,其回归模型方差分析结果见表 3。该模型F值为147.32,P < 0.000 1,表明该模型具有高度的显著性,具有统计学意义;失拟项的P值为0.088 6(P>0.05),表明该模型失拟性不显著,试验结果受未知因素的影响较小;模型相关系数R2为0.994 7,调整后相关系数Radj2为0.988 0,两者均接近于1,表明该模型于实际试验拟合程度良好,具有较高的准确性和通用性,可用于对海南风吹楠成年树总黄酮含量的分析和测定。其中提取温度(B)的P < 0.000 1(P < 0.01),表明提取温度对模型具有极显著影响;提取时间(C)的P=0.0184(P < 0.05),表明提取时间对模型具有显著影响;料液比(A)的P=0.483 3(P>0.05),表明料液比对模型影响不显著;交互项中BC、A2、B2、C2的P < 0.01,表明对模型均呈极显著影响;AB、AC的P>0.05,表明对模型影响均不显著;比较A、B、C之间的F值,FB>FC>FA,表明各因素的影响程度依次是提取温度>提取时间>料液比。由以上分析可以看出,不同因素对海南风吹楠成年树提取出的总黄酮含量影响并不是单一线性关系,而是各因素相互作用的结果。
| 方差来源 Source of variance |
平方和 Sum of square |
自由度 df |
均方 Mean square |
F值 F value |
P值 P value |
| Model | 43.01 | 9 | 4.78 | 147.32 | < 0.000 1 |
| A | 0.017 8 | 1 | 0.017 8 | 0.547 7 | 0.483 3 |
| B | 2.12 | 1 | 2.12 | 65.48 | < 0.000 1 |
| C | 0.303 0 | 1 | 0.303 0 | 9.34 | 0.018 4 |
| AB | 0.004 0 | 1 | 0.004 0 | 0.122 4 | 0.736 8 |
| AC | 0.155 6 | 1 | 0.155 6 | 4.80 | 0.064 6 |
| BC | 1.04 | 1 | 1.04 | 31.95 | 0.000 8 |
| A2 | 17.81 | 1 | 17.81 | 549.09 | < 0.000 1 |
| B2 | 0.860 1 | 1 | 0.860 1 | 26.52 | 0.001 3 |
| C2 | 17.63 | 1 | 17.63 | 543.50 | < 0.000 1 |
| Residual | 0.227 1 | 7 | 0.032 4 | ||
| Lack of Fit | 0.175 6 | 3 | 0.058 5 | 4.55 | 0.088 6 |
| Pure Error | 0.051 4 | 4 | 0.012 9 | ||
| Cor Total | 43.24 | 16 | |||
| Note: P < 0.05 indicates significant difference, P < 0.01 indicates extremely significant difference. | |||||
2.2.3 响应面分析
由图 5可知,料液比、提取温度和提取温度、提取时间之间的交互作用较强,料液比、提取时间之间的交互作用较弱。

|
| 图 5 交互因素对海南风吹楠成年树总黄酮含量影响的响应面图 Fig. 5 Response surface plots of effects of interactions between factors on the total flavonoid content in adult trees of H.hainanensis |
2.2.4 海南风吹楠总黄酮最佳提取工艺确定及验证
通过Design Expert 11软件对以上数据的分析计算,得到海南风吹楠总黄酮最佳提取工艺为料液比1∶72.2,提取温度55.1 ℃,提取时间55.7 min。在此条件下,模型预测从海南风吹楠成年树中提取出的总黄酮含量为6.862%。在最佳条件下,实际测得海南风吹楠成年树中总黄酮含量为6.823%,实际值与预测值仅相差0.039%,表明该模型分析的结果准确性和可信度较高。
2.3 海南风吹楠各生长阶段不同部位总黄酮含量在上述响应面试验分析得到的海南风吹楠的最佳提取工艺下,分别提取海南风吹楠成年树、幼树、幼苗不同部位的总黄酮含量,其结果见表 4。成年树、幼树、幼苗不同部位的总黄酮含量存在显著差异,具有统计学意义。海南风吹楠成年树不同部位总黄酮含量树干皮>枝皮>根>种皮>种子>根皮>树干>种壳>叶片>枝,其中树干皮总黄酮含量最高,为16.061%;枝总黄酮含量最低,为5.917%。海南风吹楠幼树不同部位总黄酮含量枝皮>叶片>树干皮>根皮>枝>树干>根,其中枝皮总黄酮含量最高,为7.413%。海南风吹楠幼苗不同部位总黄酮含量叶片>根皮>枝>枝皮>根,其中叶片总黄酮含量最高,为10.465%。从不同生长阶段方面观察,除叶片外,与幼树和幼苗相比,成年树各部位总黄酮含量均较高,为5.917%-16.061%;其次为幼苗,整体的总黄酮含量为2.543%-10.465%;幼树整体的总黄酮含量最低,为1.741%-7.413%。
| Unit: % | |||||||||||||||||||||||||||||
| 部位 Part |
成年树 Adult trees |
幼树 Young trees |
幼苗 Seedlings |
||||||||||||||||||||||||||
| Leaf | 6.823±0.010i | 6.198±0.008b | 10.465±0.010a | ||||||||||||||||||||||||||
| Branch | 5.917±0.012j | 3.368±0.006e | 4.172±0.008c | ||||||||||||||||||||||||||
| Branch bark | 11.493±0.009b | 7.413±0.014a | 3.544±0.011d | ||||||||||||||||||||||||||
| Trunk | 7.906±0.010g | 2.181±0.005f | - | ||||||||||||||||||||||||||
| Trunk bark | 16.061±0.016a | 5.218±0.010c | - | ||||||||||||||||||||||||||
| Root | 11.185±0.011c | 1.741±0.009g | 2.543±0.013e | ||||||||||||||||||||||||||
| Root bark | 8.098±0.033f | 4.359±0.008d | 5.513±0.014b | ||||||||||||||||||||||||||
| Seed | 9.312±0.012e | - | - | ||||||||||||||||||||||||||
| Seed coat | 10.642±0.021d | - | - | ||||||||||||||||||||||||||
| Seed shell | 7.032±0.017h | - | - | ||||||||||||||||||||||||||
| Note: different lowercase letters in the same column indicate significant differences(P<0.05). | |||||||||||||||||||||||||||||
2.4 海南风吹楠成年树不同部位抗氧化活性 2.4.1 DPPH·的清除能力
海南风吹楠成年树不同部位的DPPH·清除率如表 5所示, 不同部位之间的DPPH·清除率存在显著差异,具有统计学意义。成年树的DPPH·清除率在15.611%-86.268%区间,其中树干皮>种皮>种子>根皮>枝皮>种壳>根>树干>叶片>枝。树干皮总黄酮的DPPH·清除率最高,为86.268%;种皮次之,为79.719%;根总黄酮含量最低,为15.611%。经检测,对照品(L-抗坏血酸)的DPPH·清除率为93.361%,成年树的树干皮和种皮总黄酮的DPPH·清除率均达到L-抗坏血酸的80%以上,说明这两个部位的DPPH·清除能力较强。
| 部位 Part |
清除率/% Scavenging rate/% |
| Leaf | 22.950±0.030i |
| Branch | 15.611±0.018j |
| Branch bark | 53.550±0.032e |
| Trunk | 36.707±0.024h |
| Trunk bark | 86.268±0.024a |
| Root | 43.075±0.013g |
| Root bark | 62.406±0.016d |
| Seed | 67.546±0.013c |
| Seed coat | 79.719±0.010b |
| Seed shell | 45.208±0.011f |
| Note:different lowercase letters in the same column indicate significant differences(P<0.05). | |
2.4.2 ·OH的清除能力
海南风吹楠成年树不同部位的·OH清除率如表 6所示,不同部位之间的·OH清除率存在显著差异,具有统计学意义。从整体来看,除叶片部位,其余部位对·OH清除能力均较弱。叶片总黄酮的·OH清除率最高,为72.675%;种皮总黄酮的·OH清除率最低,为0.028%。经检测,对照品(L-抗坏血酸)的·OH清除率为91.974%,成年树叶片总黄酮对·OH清除率接近对照品的80%,说明叶片的·OH清除能力较强。
| 部位 Part |
清除率/% Scavenging rate/% |
| Leaf | 72.675±0.026a |
| Branch | 15.577±0.020b |
| Branch bark | 0.115±0.010f |
| Trunk | 1.654±0.009c |
| Trunk bark | 0.385±0.174e |
| Root | 0.326±0.008e |
| Root bark | 0.304±0.011e |
| Seed | 1.606±0.340c |
| Seed coat | 0.028±0.010g |
| Seed shell | 1.095±0.146d |
| Note: different lowercase letters in the same column indicate significant differences(P<0.05). | |
2.4.3 O2-·的清除能力
海南风吹楠成年树不同部位的O2-·清除率如表 7所示。不同部位之间的O2-·清除率存在显著差异,具有统计学意义。成年树总黄酮的O2-·清除率在0.277%-50.351%区间,其中树干>枝>枝皮>根>叶片>根皮>种壳>树干皮>种皮>种子。树干总黄酮的O2-·清除率最高,为50.351%;枝、枝皮、根3个部位总黄酮的O2-·清除率相对较高,分别为48.196%、46.604%、46.195%;种子总黄酮的O2-·清除率最低,仅为0.277%。经检测,对照品(L-抗坏血酸)的O2-·清除率为90.784%,成年树树干总黄酮的O2-·清除率达到L-抗坏血酸的55%以上,说明树干的O2-·清除能力较强。
| 部位 Part |
清除率/% Scavenging rate/% |
| Leaf | 38.160±0.008e |
| Branch | 48.196±0.010b |
| Branch bark | 46.604±0.024c |
| Trunk | 50.351±0.009a |
| Trunk bark | 14.928±0.040g |
| Root | 46.195±0.010d |
| Root bark | 33.337±0.027f |
| Seed | 0.277±0.023j |
| Seed coat | 1.005±0.037i |
| Seed shell | 17.692±0.010g |
| Note: different lowercase letters in the same column indicate significant differences(P<0.05). | |
3 讨论
植物中总黄酮含量及抗氧化活性对维持人体生理机能起着重要作用[18, 19]。研究表明,黄酮类化合物具有丰富的药理活性,如神经保护[20]、抗菌[21]、抗炎[22]、抗癌[23]、抗病毒[24]等。本研究通过响应面模型发现,海南风吹楠不同生长阶段的总黄酮含量受不同因素的相互影响,很少仅受单个因素影响,故各影响因素在最佳水平下,才能充分提取海南风吹楠总黄酮。采用最佳提取工艺,充分提取海南风吹楠不同生长阶段不同部位的总黄酮,发现成年树整体总黄酮含量较高,且成年树树干皮的总黄酮含量最高,为16.061%,高于同为肉豆蔻科的肉豆蔻(Myristica fragrans,总黄酮含量2.503%)[25]、水松(Glyptostrobus pensilis,总黄酮含量1.310%)[26]、红豆杉(Taxus wallichiana var. chinensis,总黄酮含量6.703%)[27]、贵州金花茶(Camellia huana,总黄酮含量5.410%)[28]、当归藤(Embelia parviflora,总黄酮含量12.590%)[29]。由此可见,海南风吹楠的总黄酮含量较为丰富。
生物在进行正常生命活动过程中离不开自由基,适量受控的自由基对人体有益,多余不受控的自由基则会夺取临近分子的电子,造成细胞功能丧失、免疫系统障碍、基因突变甚至死亡[30]。因此,开发和利用高效无毒的天然自由基清除剂,已成为当今科学发展的趋势。DPPH·是一种较为稳定的自由基,能被具有抗氧化能力的物质清除,清除率越大表示其抗氧化能力越强,因此常用于衡量活性物质或食品的抗氧化能力[31]。本研究发现海南风吹楠成年树树干皮的DPPH·清除率最高,为86.268%,达到L-抗坏血酸的80%以上,高于中药广陈皮(82.93%)[32]、束花石斛(81.92%)[33]、葛根(74.25%)[34]。·OH是一种较为活泼的活性分子,具有极强的得电子能力,能与大多数物质发生氧化反应;而抗氧化剂能减少或消除·OH的产生,从而抑制氧化反应的发生[31]。海南风吹楠成年树叶片的·OH清除率为72.675%,具有较强的抗氧化能力,其余部位对·OH的清除能力均较弱。O2-·是细胞代谢过程中产生的一种具有很强氧化能力的自由基,在生物体内可长时间攻击靶向目标,破坏细胞DNA,损伤人类机体功能[35]。海南风吹楠成年树树干O2-·清除率最高,为50.351%,表明其抗氧化能力较强。本研究发现海南风吹楠不同部位对不同自由基的清除能力不同,且其抗氧化能力并非完全由总黄酮含量决定,也可能与所含黄酮类化合物类型有关,需进一步分离鉴定。如今,随着临床对药用植物的逐渐重视,总黄酮含量高及抗氧化能力强的药用植物被广泛应用,如罗汉果(Siraitia grosvenorii)[36]、槐米(Flos sophorae immaturus)[37, 38]、红豆杉[39]等。综上,海南风吹楠总黄酮含量较高,抗氧化活性突出,拥有巨大的药用开发潜力。
4 结论本研究采用超声辅助提取法,提取海南风吹楠成年树、幼树、幼苗不同部位的总黄酮,通过单因素试验和响应面分析,确定总黄酮最佳提取工艺,即料液比为1∶72.2,提取温度为55.1 ℃,提取时间为55.7 min。
除叶片外,海南风吹楠成年树各部位总黄酮含量均较高,为5.917%-16.061%;其次为幼苗,整体的总黄酮含量为2.543%-10.465%;幼树整体的总黄酮含量较低,为1.741%-7.413%。其中,成年树树干皮的总黄酮含量最高,为16.061%。
海南风吹楠成年树树干皮和种皮总黄酮的DPPH·清除能力较强,叶片总黄酮的·OH清除能力较强。树干、枝、枝皮、根总黄酮的O2-·清除率均较高,其中树干的O2-·清除率最高。
海南风吹楠总黄酮含量较高,抗氧化活性突出,具有广阔的开发应用前景。本研究初步探讨了海南风吹楠总黄酮的药用潜力,后期可进行更深入的研究,如体外抗氧化试验、细胞试验和动物试验等药理试验,来评估植物总黄酮的药用价值,从而更全面地了解其生物活性和应用潜力。
| [1] |
冯志舟. "争光树": 风吹楠[J]. 云南林业, 2011, 32(4): 61. |
| [2] |
胡永华, 吴裕, 许玉兰, 等. 风吹楠种子油的脂肪酸成分分析[J]. 热带农业科技, 2010, 33(4): 27-28. DOI:10.3969/j.issn.1672-450X.2010.04.010 |
| [3] |
王成和, 王少君, 刘彦军, 等. 肉豆蔻酸酯的合成[J]. 大连轻工业学院学报, 1995(1): 15-19. |
| [4] |
吴志平, 张治柳, 黄克瀛. 肉豆蔻酸异丙酯的合成工艺研究[J]. 中南林学院学报, 2000, 20(4): 72-75. DOI:10.3969/j.issn.1673-923X.2000.04.020 |
| [5] |
洪玮, 陈辉, 王霞, 等. 超临界流体技术进行熔融肉豆蔻酸的微粉化[J]. 厦门大学学报(自然科学版), 2008, 47(4): 541-546. DOI:10.3321/j.issn:0438-0479.2008.04.018 |
| [6] |
葛虹, 张之强, 孙玲新. 肉豆蔻酸单乙醇酰胺硫酸酯盐的物化性能[J]. 精细石油化工, 2009, 26(2): 1-3. |
| [7] |
葛虹, 张之强, 孙玲新. 肉豆蔻酸单乙醇酰胺硫酸酯盐的润湿性能研究[J]. 北京工商大学学报(自然科学版), 2009, 27(2): 1-3, 11. |
| [8] |
中国医学科学院药用植物研究所海南分所. 南药园植物名录[M]. 北京: 中国农业出版社, 2007: 26-27.
|
| [9] |
符国瑷. 海南岛热带雨林药用植物资源开发利用对策[J]. 热带林业, 2004, 32(1): 7, 6. DOI:10.3969/j.issn.1672-0938.2004.01.003 |
| [10] |
黄全. 拯救海南的"血树"[J]. 热带林业科技, 1984, 4(1): 49-50. |
| [11] |
彭伟. 风吹楠化学成分的研究[D]. 昆明: 云南师范大学, 2017.
|
| [12] |
邝芳, 吴伟, 杨雯新, 等. 琴叶风吹楠的化学成分研究[J]. 云南民族大学学报(自然科学版), 2019, 28(3): 229-232. DOI:10.3969/j.issn.1672-8513.2019.03.003 |
| [13] |
童应成. 大叶风吹楠化学成分的研究[D]. 昆明: 云南师范大学, 2022.
|
| [14] |
马琴, 詹睿, 陈业高. 风吹楠属植物化学成分及活性研究进展[J]. 广州化工, 2014, 42(12): 11-13. DOI:10.3969/j.issn.1001-9677.2014.12.006 |
| [15] |
蒋迎红. 极小种群海南风吹楠生态学特性及濒危成因分析[D]. 长沙: 中南林业科技大学, 2018.
|
| [16] |
蔡超男, 侯勤曦, 慈秀芹, 等. 极小种群野生植物海南风吹楠的遗传多样性研究[J]. 热带亚热带植物学报, 2021, 29(5): 547-555. |
| [17] |
李勇, 邓卓丹, 许均华. 响应面超声提取鳄梨皮果胶工艺及其氧化特性[J]. 食品工业, 2021, 42(11): 15-20. |
| [18] |
景年华, 史俊友, 安仙香, 等. 银杏叶黄酮及多糖超声波辅助提取工艺优化[J]. 中国野生植物资源, 2023, 42(9): 17-24. DOI:10.3969/j.issn.1006-9690.2023.09.004 |
| [19] |
徐源, 赫丁轩. 艾叶黄酮提取工艺的优化及抗氧化活性分析[J]. 安徽农学通报, 2023, 29(14): 43-48. DOI:10.3969/j.issn.1007-7731.2023.14.012 |
| [20] |
SHAH S, NARANG R, SINGH V J, et al. A review on anticancer profile of flavonoids: sources, chemistry, mechanisms, structure-activity relationship and anticancer activity[J]. Current Drug Research Reviews, 2023, 15(2): 122-148. DOI:10.2174/2589977515666230120144852 |
| [21] |
ZHANG Y Q, BIAN S Q, HU J, et al. Natural deep eutectic solvent-based microwave-assisted extraction of total flavonoid compounds from spent sweet potato (Ipomoea batatas L.) leaves: optimization and antioxidant and bacteriostatic activity[J]. Molecules, 2022, 27(18): 5985. DOI:10.3390/molecules27185985 |
| [22] |
LI Z C, LIN M L, LI Y D, et al. Total flavonoids of Sophora flavescens and kurarinone ameliorated ulcerative colitis by regulating Th17/Treg cell homeostasis[J]. Journal of Ethnopharmacology, 2022, 297: 115500. DOI:10.1016/j.jep.2022.115500 |
| [23] |
HASSAN S S U, SAMANTA S, DASH R, et al. The neuroprotective effects of fisetin, a natural flavonoid in neurodegenerative diseases: focus on the role of oxidative stress[J]. Frontiers in Pharmacology, 2022, 13: 1015835. DOI:10.3389/fphar.2022.1015835 |
| [24] |
MORIMOTO R, HANADA A, MATSUBARA C, et al. Anti-influenza a virus activity of flavonoids in vitro: a structure-activity relationship[J]. Journal of Natural Medicines, 2023, 77(1): 219-227. DOI:10.1007/s11418-022-01660-z |
| [25] |
卓微伟, 李凤, 胡君. 响应面法优化超声辅助提取肉豆蔻总黄酮工艺及其抗氧化活性研究[J]. 食品研究与开发, 2021, 42(19): 126-133. DOI:10.12161/j.issn.1005-6521.2021.19.018 |
| [26] |
刘特津, 钟希文, 张文霞, 等. 正交试验法优化水松叶中总黄酮的提取工艺研究[J]. 中国合理用药探索, 2017, 14(1): 4-7. DOI:10.3969/j.issn.2096-3327.2017.01.002 |
| [27] |
江石平, 朱婉萍. 超声辅助低共熔溶剂提取红豆杉叶总黄酮工艺的优化[J]. 中成药, 2021, 43(12): 3442-3445. DOI:10.3969/j.issn.1001-1528.2021.12.034 |
| [28] |
文治瑞, 王佳菜, 刘丽明, 等. 超声波辅助提取金花茶中黄酮类物质工艺及体外抗氧化研究[J]. 食品安全质量检测学报, 2020, 11(13): 4364-4370. |
| [29] |
姜鹏程, 陆晔晗, 常芮宁, 等. 当归藤总黄酮超声提取工艺优化[J]. 中成药, 2023, 45(12): 4081-4085. |
| [30] |
成宏斌, 李晓波, 贾笑英, 等. 野菠萝果中多糖、黄酮与多酚的含量测定及抗氧化研究[J]. 现代食品, 2021, 7(1): 83-89. |
| [31] |
赵楠楠, 朱晓冉, 李德海. 红松壳多酚、黄酮和多糖含量及抗氧化活性相关性的研究[J]. 现代食品科技, 2017, 33(12): 44-49, 55. |
| [32] |
唐婷范, 徐紫薇, 李霞清, 等. 超声波辅助提取广陈皮黄酮的工艺优化及其抗氧化活性的研究[J]. 中国调味品, 2024, 49(3): 15-19. |
| [33] |
查兰松, 敖茂宏. 不同干燥方法对束花石斛的质量和抗氧化活性的影响[J]. 浙江农业科学, 2024, 65(2): 443-448. |
| [34] |
彭常安, 孙浩浩, 刘小燕. 葛根总黄酮的提取及抗氧化性研究[J]. 芜湖职业技术学院学报, 2023, 25(4): 32-37. |
| [35] |
HUANG D J, OU B, PRIOR R L. The chemistry behind antioxidant capacity assays[J]. Journal of Agricultural and Food Chemistry, 2005, 53(6): 1841-1856. |
| [36] |
高宇思, 孙桂菊. 药食两用物质罗汉果活性成分及其功效研究进展[C]//亚洲营养学会联合会, 中国营养学会. Abstract Book of the 14th Asian Congress of Nutrition-Food & Nutrition, [S. l. ]: [s. n. ], 2023: 1.
|
| [37] |
张珩, 石晓琳. 槐米总黄酮的抗炎和镇痛作用[J]. 临床医学研究与实践, 2018, 3(31): 4-6. |
| [38] |
王菲, 王晨, 朱风仪, 等. 槐米黄酮的纯化和体外抗氧化活性研究[J]. 应用化工, 2021, 50(8): 2182-2186. |
| [39] |
杨洋, 苏晓萍, 朱婧, 等. 红豆杉抗肿瘤活性成分及机制研究进展[J]. 职业与健康, 2021, 37(13): 1859-1863. |



