2. 广西壮族自治区中国科学院广西植物研究所,广西桂林 541006;
3. 广西植物功能物质与资源持续利用重点实验室,广西桂林 541006;
4. 广西师范大学生命科学学院,广西桂林 541006;
5. 桂林医学院药学院,广西桂林 541199
2. Guangxi Institute of Botany, Guangxi Zhuang Autonomous Region and Chinese Academy of Sciences, Guilin, Guangxi, 541006, China;
3. Guangxi Key Laboratory of Plant Functional Phytochemicals and Sustainable Utilization, Guilin, Guangxi, 541006, China;
4. School of Life Sciences, Guangxi Normal University, Guilin, Guangxi, 541006, China;
5. School of Pharmacy, Guilin Medical College, Guilin, Guangxi, 541199, China
随着我国“健康中国”战略的实施与发展,药食兼用植物资源逐渐被人们知悉[1]。很多药食兼用植物除了药用和食用价值外,还具有很高的园林观赏和生态价值,被推广应用到园林景观中[2]。鱼腥草(Houttuynia cordata)作为中华人民共和国国家卫生健康委员会公布的药食兼用植物之一[3],又名蕺菜、侧耳根等,属三白草科(Saururaceae)蕺菜属(Houttuynia)多年生草本植物,其嫩茎、叶、根常作蔬菜食用,且株型紧凑,花期长,叶为绿色或紫色,互生,心形或阔卵形,有很高的观赏和食用价值,园林开发利用潜力巨大。研究表明,鱼腥草不仅可以利用自身的化感作用抑制杂草[4],而且对重金属有很强的富集作用[5],可作为矿区、农田等重金属污染土壤的修复植物。因此,在观赏特性和生态修复方面,鱼腥草是一种优秀的园林地被植物。
光作为一种信号源和能量源,不仅给植物提供生长发育的能量,而且能调控植物的开花等生理过程,进而影响植物的观赏性[6, 7]。刘雪丽等[8]研究发现海州常山(Clerodendrum trichotomum)在轻度遮阴环境下观赏期提前,而过度遮阴则会明显抑制其生长和观赏性的发挥。刘林等[9]研究发现在林缘光环境下三花杜鹃(Rhododendron triflorum)生长更优,在园林应用中要适度遮阴。Lee等[10]研究发现不同光环境对植物的花期、开花数量及生长均会产生显著影响。因此,研究不同光环境对植物开花和生长的影响,对植物在园林应用中的科学栽培管理具有十分重要的意义。
目前,已有人工控制试验从光强和光质两方面进行探索,发现光强对鱼腥草光合作用的影响很大[11],在不同生境下选择合适的光照条件可以最大化促进鱼腥草有效成分的积累[12],且遮光不利于鱼腥草生长[13]。同时,不同光质的光源对鱼腥草幼苗的调控作用不同[14],红光促进幼苗地上茎的生长,黄、蓝光促进幼苗地下茎的生长,绿光抑制幼苗地上茎粗和鲜质量的增长,且在同等光强下不同光质对鱼腥草的生长具有一定的胁迫,但也能够促进光合系统Ⅱ的电子传递[14-16]。综上,有关光对鱼腥草影响的研究主要集中在产量与活性成分上,其园林应用相关的研究鲜有报道。为了将其更好地应用于园林中,减少植物配置的盲目性,充分发挥其观赏价值,本研究将通过比较同一林地不同生长光环境下鱼腥草的开花特性、叶片形态、生长和叶片光合生理特性,来揭示光环境对鱼腥草花期和生长的影响机制,找出其最佳的生长光环境,为其在园林景观中的栽培应用提供科学依据和技术指导。
1 材料与方法 1.1 试验地概况试验地位于广西桂林市雁山区广西植物研究所(110°18′E,25°04′N,海拔162 m),属亚热带季风气候区,年平均无霜期316 d,年平均气温19.1 ℃,年平均降水量1 750 mm,年平均相对湿度82%。
1.2 方法 1.2.1 设置试验样地2018年4月,在广西植物研究所试验地的同一银杏(Ginkgo biloba)林下由南向北依次设置3个不同光环境[林缘(LY)、疏林(SL)、密林(ML)]的5 m×10 m的鱼腥草种植样地(表 1)。样地间隔12 m;地形南低北高,且为向阳斜坡;其土壤概况具体见王满莲等[17]的描述。其中LY选取银杏林边缘5 m内的区域;SL选取银杏林中比较稀疏的区域,树距为4-8 m;ML选取银杏林中种植密集的区域,树距为2-4 m。采用大小一致的鱼腥草根蘖苗进行移栽,密度20 cm×20 cm,进行一致的常规除草、施肥、浇水管护。在试验样地中每隔2 m设置1个1 m×1 m的无杂草鱼腥草单一种群样方,每个光环境下3个生物学重复。于晴朗无云天气正午用美国SPECTRUM 3415A光量子计(北京多晶电子科技有限公司)测定样地冠层下和露天环境(2 006.67 μmol·m-2·s-1)的光强(光量子计启动2 min后记录稳定状态的数据),每个样方测量3个位点,取平均值为其光强(表 1)。样地透光率采用以下公式计算:
| $ \text { 透光率 ( } \% \text { )=冠层光强/露天环境光强 } \times 100 \% $ |
| 光环境类型 Light environment |
光强/ (μmol·m-2·s-1) Light intensity/ (μmol·m-2·s-1) |
光照比例/% Light ratio/% |
样地乔木和灌木种类 Species of trees and shrubs in the sampling plot |
| LY | 1 914.67 | 95 | G.biloba, Hypericum monogynum, Illicium difengpi, Sterculia lanceolate, et al. |
| SL | 1 012.67 | 50 | G.biloba, Osmanthus fragrans, Elaeagnus pungens, Mahonia fortune, et al. |
| ML | 96.20 | 5 | G.biloba, Cinnamomum cassia, Heteropanax fragrans, Amomum tsaoko, et al. |
1.2.2 鱼腥草花期物候观察
参照张丽芳等[18]的方法,观测鱼腥草群体和单株花期。
群体花期:通过观察3种光环境下每个样方中鱼腥草的群体花期,分别记录群体始花期(约5%分株开花日期)、盛花期(约50%分株开花日期)及末花期(约95%分株开花结束日期)。
单株花期:在3种光环境下,采用五点取样法,在每个样方中从中心到4个角随机选取3个分株进行标记,观察并记录单株开花持续时间(单株第一朵花开放的日期至最后一朵花凋谢的日期)和单株开花数目。盛花期,在每个样方中分别标记3个生长状况一致的花蕾,记录单花序的开花持续时间。开花比例采用以下公式计算:
| $ \text { 开花比例 ( } \% \text { )=当天开花分株数/群体分株数 } \times 100 \% $ |
2018年5月中旬,在3种光环境下,每个样方分别选取10株生长状况良好、长势一致的完整植株,对其生长指标进行测定,其中,株高、叶长、叶宽用卷尺测量,茎粗用游标卡尺测量。5月下旬生长指标和光响应曲线测定结束后,在各样方中分别采集10株生长状况良好、叶片完整的鱼腥草地上部分,对茎、叶鲜重、叶面积采用电子天平和Li-3000C型叶面积仪(美国LI-COR公司)进行测定;茎、叶干重在105 ℃烘箱中杀青30 min,于80 ℃烘干至恒重后用电子天平测定;含水量及各部位生物量采用以下公式计算:
| $ \text { 含水量 }(\%)=(\text { 叶鲜重 }- \text { 叶干重) } / \text { 叶干重 } \times 100 \% $ |
| $ \text { 叶生物量分配比 }(\%)=(\text { 叶干重 }/ \text{ 单株生物量) } \times 100 \% $ |
| $ \text { 茎生物量分配比 }(\%)=(\text { 茎干重 }/ \text{ 单株生物量) } \times 100 \% $ |
叶绿素含量参考朱广廉等[19]的方法测定。在3个光环境下的每个样方中选取3株生长状况一致的分株,采集从底部向上的第3-5片完全展开且无病虫害的功能叶3片,放入避光的冰盒中带回实验室,立即采用95%乙醇浸提,每个处理使用电子天平精密称取0.100 g,剪碎后充分匀浆,密封于25 mL棕色容量瓶中,置于暗处浸泡24 h左右,至组织发白。采用SuPerMax系列紫外分光光度计(上海闪谱生物科技有限公司)分别在649、665 nm波长下测定吸光度,并根据以下公式计算叶绿素a(Ca)、叶绿素b(Cb)、叶绿素a+b[C(a+b)]以及叶绿素a/b(Ca/b)的值。
| $ \text { 叶绿素 } a: \mathrm{C} a=13.95 A_{665}-6.88 A_{649} $ |
| $ \text { 叶绿素 } b: \mathrm{C} b=24.96 A_{649}-7.32 A_{665} $ |
| $ \text { 叶绿素 } a+b: \mathrm{C}(a+b)=\mathrm{C} a+\mathrm{C} b $ |
| $ \text { 叶绿素 } a / b: \mathrm{C} a / b=\mathrm{C} a / \mathrm{C} b $ |
其中,A665和A649分别表示665、649 nm波长下的吸光度。
1.2.5 鱼腥草光响应曲线测定5月下旬,选择晴朗无风天气于08:00-11:30采用Li-6400型便携式光合测定仪(美国LI-COR公司)测定光响应曲线。各光环境下的植株分别选取从底部向上的第3-5片长势良好、完整无病害的叶片为试验对象,先用1 500 μmol·m-2·s-1光强对叶片诱导10 min,再设置光强梯度分别为2 000、1 500、1 200、1 000、800、600、400、300、200、150、100、50、20、10、0 μmol·m-2·s-1,每个梯度停留3 min测定光响应曲线。记录净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr)等光合参数,各光环境下3个样方分别随机选取1株进行测定。采用双曲线修正模型对不同光环境下鱼腥草叶片的Pn-PAR曲线进行拟合[20],并计算鱼腥草的最大净光合速率(Pnmax)、表观量子效率(AQY)、光饱和点(LSP)、光补偿点(LCP)和暗呼吸速率(Rd)等光响应参数。
1.3 数据处理采用Excel 2021软件对原始数据进行汇总与整理。采用SPSS 26.0软件对数据进行单因素方差分析(One-way ANOVA),采用Duncan法在0.5水平上进行多重比较,并用皮尔逊(Pearson)法对生长性状和光合特性数据进行相关性分析。数据以3个重复的平均值±标准误表示。使用叶子飘的光合计算4.1.1软件对光响应曲线进行拟合,并计算出表观量子效率、最大净光合速率、光饱和点、光补偿点和暗呼吸速率等参数,用Origin 2021软件作图。
2 结果与分析 2.1 不同光环境对鱼腥草开花特性的影响鱼腥草的花为穗状花序,生于茎顶或与叶对生于节上,花轴基部有4片花瓣状白色苞片。整个花序极为素雅,具有较高观赏价值,其花期主要集中在4月中旬至6月中旬。如图 1所示,不同光环境对鱼腥草的花期和开花数量均有影响。不同光环境下,始花期和盛花期分别相差4-6 d和2-3 d;末花期和最后一朵花开放结束日期分别相差3-5 d和4-11 d。如表 2所示,SL环境下第一朵花开放日期比LY和ML均提前3-8 d,其中LY和SL的单花开花持续时间以及群体、单株的开花数量均显著大于ML。说明鱼腥草在LY环境下花期整体偏长,开花数量最多,但SL环境下单花花期最长。
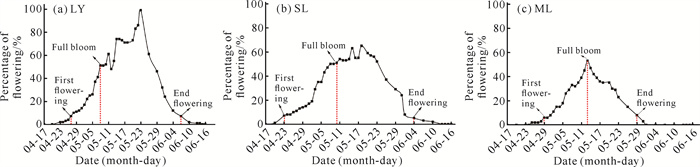
|
| 图 1 不同光环境下鱼腥草的开花动态 Fig. 1 Flowering dynamics of Houttuynia cordata Thunb.in different light environments |
| 光环境类型 Light environment |
第一朵花开 放日期/(月-日) Date of opening of the first flower (month-day) |
群体开花 持续时间/d Population flowering duration/d |
单株开花 持续时间/d Duration of flowering of a single plant/d |
单花开花 持续时间/d Duration of single flowering/d |
群体开花数量 Number of flowers in the population |
单株开花数量 Number of flowers per plant |
| LY | 04-20 | 54.33±3.21a | 31.11±1.62a | 12.33±0.67b | 223.67±65.25a | 5.56±1.67a |
| SL | 04-17 | 51.00±5.57a | 29.11±2.20a | 14.67±0.33a | 147.00±33.86b | 4.89±1.76a |
| ML | 04-25 | 31.67±5.69b | 13.67±3.66b | 10.67±0.33c | 15.33±9.02c | 1.22±0.97b |
| Note: different lowercase letters in the same column indicate significant differences between treatments at the P < 0.05 level. | ||||||
2.2 不同光环境对鱼腥草生长特性的影响
由表 3可知,不同光环境对鱼腥草的生长有显著影响。其中LY下鱼腥草的单位面积分株数量显著大于SL和ML,而SL与ML间无显著差异;株高和茎粗随着光强的降低而显著降低(P<0.05),与光强的变化呈正相关。LY分株叶面积显著大于ML(P<0.05),但与SL相比无显著差异。比叶面积和植株含水量则与光强呈负相关,均随光强的减弱而显著升高(P<0.05)。如表 4所示,3种光环境下分株叶生物量、茎生物量和地上生物量均存在显著差异(P<0.05),表现为LY>SL>ML,与光强的变化呈正相关。
| 光环境类型 Light environment |
分株数量/ (株·m-2) Number of divisions/ (divisions·m-2) |
株高/cm Plant height/cm |
茎粗/mm Stem diameter/mm |
叶面积/cm2 Leaf area/cm2 |
比叶面积/ (cm2·g-1) Specific leaf area/ (cm2·g-1) |
含水量/% Moisture content/% |
| LY | 71.33±4.03a | 34.47±3.40a | 4.14±0.39a | 32.78±4.05a | 215.69±72.99c | 3.83±0.49c |
| SL | 60.66±7.72b | 27.12±1.54b | 3.17±0.43b | 30.57±3.21ab | 300.14±44.99b | 5.78±0.57b |
| ML | 66.33±8.26b | 24.08±2.34c | 2.69±0.65c | 22.78±4.62b | 474.6±114.33a | 7.99±1.02a |
| Note: different lowercase letters in the same column indicate significant differences between treatments at the P < 0.05 level. | ||||||
| 光环境类型 Light environment |
叶生物量/ (g·株-1) Leaf biomass/ (g·plant-1) |
茎生物量/ (g·株-1) Stem biomass/ (g·plant-1) |
地上生物量/(g·株-1) Above-ground biomass/ (g·plant-1) |
| LY | 1.17±0.11a | 0.97±0.07a | 2.14±0.17a |
| SL | 0.56±0.15b | 0.32±0.07b | 0.89±0.20b |
| ML | 0.12±0.03c | 0.10±0.01c | 0.22±0.04c |
| Note: different lowercase letters in the same column indicate significant differences between treatments at the P < 0.05 level. | |||
2.3 不同光环境对鱼腥草叶片叶绿素含量的影响
3种光环境下鱼腥草叶片的叶绿素a、叶绿素b、叶绿素a+b含量和叶绿素a/b均有显著性差异(表 5),且随着光强减弱而显著降低。
| 光环境类型 Light environment |
叶绿素a含量/ (mg·g-1) Chlorophyll a content/(mg·g-1) |
叶绿素b含量/ (mg·g-1) Chlorophyll b content/(mg·g-1) |
叶绿素a+b含量/ (mg·g-1) Chlorophyll a+b content/(mg·g-1) |
叶绿素a/b/ (mg·g-1) Chlorophyll a/b/ (mg·g-1) |
| LY | 1.23±0.02a | 0.67±0.02a | 1.90±0.04a | 1.83±0.02a |
| SL | 0.94±0.04b | 0.54±0.01b | 1.48±0.04b | 1.75±0.04b |
| ML | 0.80±0.00c | 0.51±0.01c | 1.31±0.00c | 1.56±0.02c |
| Note: different lowercase letters in the same column indicate significant differences between treatments at the P < 0.05 level. | ||||
2.4 不同光环境对鱼腥草叶片光合特性的影响
由图 2可知,不同光环境下鱼腥草叶片的净光合速率(Pn)、气孔导度(Gs)和蒸腾速率(Tr)的光响应趋势相似,随光强的增大均呈上升趋势,而其叶片胞间CO2浓度(Ci)随光强的增强均呈现下降趋势,且ML环境下的Ci整体高于LY和SL。
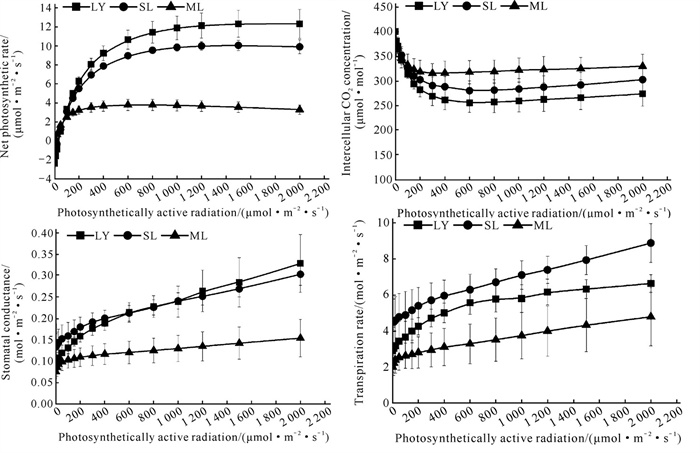
|
| 图 2 不同光环境下鱼腥草光合指标 Fig. 2 Photosynthetic indexes of Houttuynia cordata Thunb.in different light environments |
不同光环境下鱼腥草的光合光响应参数见表 6。各参数均在LY环境下最高;最大净光合速率、光饱和点、光补偿点和暗呼吸速率在ML环境下最低,且均显著低于SL;表观量子效率则在SL环境下最低,但与ML环境下无显著差异。
| 光环境类型 Type of light environment |
AQY/ (mol·mol-1) |
Pnmax/ (μmol·m-2·s-1) |
LSP/ (μmol·m-2·s-1) |
LCP/ (μmol·m-2·s-1) |
Rd/ (μmol·m-2·s-1) |
| LY | 0.084±0.005a | 12.37±1.77a | 1 740.63±279.33a | 33.03±6.01a | 2.40±0.50a |
| SL | 0.070±0.002b | 10.10±0.68a | 1 540.93±349.43a | 26.30±1.84a | 1.63±0.10b |
| ML | 0.075±0.006ab | 3.79±0.74b | 689.88±40.24b | 7.39±1.47b | 0.50±0.05c |
| Note: different lowercase letters in the same column indicate significant differences between treatments at the P < 0.05 level. | |||||
2.5 鱼腥草花期、生长性状和光合特性相关性系数
由表 7可知,不同光环境下鱼腥草花期、生长指标和光合特性指标呈正相关关系。茎粗、叶面积、群体开花持续时间与Pnmax、LSP、LCP具有显著相关性,其中LSP与叶面积呈极显著正相关(P<0.01)、与茎粗和群体开花时间呈显著正相关(P<0.05),株高与茎粗、叶面积呈显著正相关(P<0.05),茎粗与叶面积呈极显著正相关(P<0.01)、与群体开花持续时间和群体开花数量呈显著正相关(P<0.05),群体开花持续时间与群体开花数呈极显著正相关(P<0.01)。
| 相关指标 Relevant indicator |
株高 Plant height |
茎粗 Stem diameter |
叶面积 Leaf area |
群体开花 持续时间 Population flowering duration |
群体开 花数量 Number of flowers in a population |
Pnmax | LSP | LCP |
| Plant height | 1 | |||||||
| Stem diameter | 0.790* | 1 | ||||||
| Leaf area | 0.740* | 0.946** | 1 | |||||
| Population flowering duration | 0.517 | 0.703* | 0.789* | 1 | ||||
| Number of flowers in a population |
0.579 | 0.709* | 0.775* | 0.826** | 1 | |||
| Pnmax | 0.726* | 0.912** | 0.976** | 0.801** | 0.757* | 1 | ||
| LSP | 0.687* | 0.792* | 0.933** | 0.738* | 0.677* | 0.950** | 1 | |
| LCP | 0.690* | 0.868** | 0.959** | 0.832** | 0.909** | 0.935** | 0.900** | 1 |
| Rd | 0.760* | 0.874** | 0.940** | 0.813** | 0.919** | 0.922** | 0.881** | 0.986** |
| Note: * and ** indicate correlation significance at the P < 0.05 and P < 0.01 levels, respectively. | ||||||||
3 讨论
植物开花是由遗传和环境因素共同决定的复杂过程,其中光照作为一个重要的环境因子,对植物的成花起关键作用[21]。在园艺花卉的花期研究中发现,适度的光强可延长花期并促进植物的生长发育和增加花量,从而提高园艺花卉植物的观赏性;过低的光强则会抑制植物生长和成花[22-24]。受林冠层遮阴的影响,本研究中3种生长环境的光强表现为LY>SL>ML,鱼腥草的群体开花数量、单花花期与生长环境中光强呈显著相关关系(表 3)。在光强较高的LY下鱼腥草体内开花相关活性物质的合成加快,并伴随着光合产物运输至茎端积累成花[21],因此,开花数量最多且花期最长;而在光强较弱的ML下,光合产物积累不足,导致鱼腥草茎端的碳水化合物分配不足,开花数量减少,花期变短,该结果与Rezazadeh等[25]的研究结果一致。
光照影响植物形态建成和同化产物分配的同时,植物也通过形态和生理机能的变化来适应环境的变化,以达到最佳生理状态[26, 27]。通过对鱼腥草生长状况和生物量的研究发现,鱼腥草在光强较弱的ML下形态细小,且地上生物量均显著低于LY和SL,主要原因是在ML下,鱼腥草光照不足,有机物积累水平低,影响了自身的形态建成,导致叶面积小,生物量低。已有研究表明,高郁闭度会导致林下红光、蓝光减少[28],鱼腥草在此环境下表现出避荫特性以适应ML环境。反之,在LY环境下,光合作用强,有利于鱼腥草捕获光能及构建运输功能,与魏明月等[29]发现烟草在强光环境下出现“粗茎暴脉”现象,通过较大生物量捕获光能,维持光合作用的高速运转,避免光抑制的研究结果一致。
叶绿素是植物进行光合作用的关键色素,可以促进植物对光能的吸收利用[30]。鱼腥草在不同光环境下的叶绿素含量、叶绿素a/b值与最大净光合速率呈显著正相关,叶绿素a+b含量在LY下最高,ML下最低,表明强光下鱼腥草通过提高叶绿素含量来增强叶片捕获和利用光能的能力,光合速率增大;叶绿素a/b值可反映光反应色素与捕光色素的比例,弱光下鱼腥草的捕光色素比例增大,通过增多光能吸收来减少弱光限制,对ML表现出一定的适应性。鱼腥草的光合特性对光环境具有较高的可塑性,经Pn-PAR曲线拟合,鱼腥草最大净光合速率、光饱和点和光补偿点在LY下最高,而在ML下最低,且LY下表观量子效率高于SL和ML,说明其在较强的光照条件下光合效率高于弱光,更适合在光强较强的LY生长。
4 结论鱼腥草具有很强的光适应能力,在不同光环境下均能生长。鱼腥草在光强相对较强的林缘下光合速率最高、生长状况和成花效果最好,单株花期持续1个月,群体观赏期可长达54 d左右;疏林下开花时间与林缘相近,但整体的开花数量和花期不及林缘;在密林下开花情况和生长状况均最差,影响观赏性的发挥,且不适宜鱼腥草的种植。因此,在园林景观应用中,鱼腥草应栽植于林缘环境,在发挥极致观赏性的同时,与其他乔木、灌木等观赏植物进行搭配,不仅能增加园林景观的层次感,也可丰富药食同源植物在园林中的应用种类。
| [1] |
胡思, 王超, 孙贵香, 等. 大健康产业背景下药食同源资源开发的现状与对策研究[J]. 湖南中医药大学学报, 2021, 41(5): 815-820. DOI:10.3969/j.issn.1674-070X.2021.05.032 |
| [2] |
吴林芳, 高薇, 邓丽丽, 等. 广西典型药食同源植物开发利用价值的综合评价[J]. 广西科学院学报, 2023, 39(1): 27-34. |
| [3] |
张国忠. 鱼腥草生理生态特性研究概述[J]. 内蒙古林业调查设计, 2015, 38(2): 117-118, 132. |
| [4] |
周念. 几种常见野生蔬菜的生态功能利用研究进展[J]. 广东农业科学, 2012, 39(15): 42-45. |
| [5] |
张青青, 江落雁, 蒋成爱. 4种重金属在鱼腥草中的分布特点及其影响因素[J]. 三峡生态环境监测, 2023, 8(3): 78-87. |
| [6] |
种培芳, 陈年来. 光强对园艺植物光合作用影响的研究进展[J]. 甘肃农业大学学报, 2008(5): 104-109. |
| [7] |
冷寒冰, 苏鸣, 张春英. 锦绣杜鹃对不同光环境的光合特性响应及适应机制[J]. 生态学杂志, 2023, 42(8): 1793-1801. |
| [8] |
刘雪丽, 陈月, 吴瑞宁, 等. 人工群落光环境对海州常山生长与观赏品质的影响[J]. 中国农学通报, 2016, 32(28): 90-96. |
| [9] |
刘林, 张良英, 费文群, 等. 不同光环境下三花杜鹃光合特性的比较[J]. 北方园艺, 2017(10): 62-65. |
| [10] |
LEE H B, LEE J H, AN S K, et al. Growth characteristics and flowering initiation of Phalaenopsis Queen Beer 'Mantefon' as affected by the daily light integral[J]. Horticulture, Environment, and Biotechnology, 2019, 60: 637-645. |
| [11] |
黄春燕, 吴卫, 郑有良, 等. 鱼腥草光合蒸腾特性及影响因素的分析[J]. 西北植物学报, 2006(5): 989-994. |
| [12] |
孙贵佳, 权秋梅, 廖咏梅, 等. 不同生境鱼腥草形态特征及主要有效成分含量差异分析[J]. 广西植物, 2014, 34(3): 408-413. |
| [13] |
曾至诚. 光强对鱼腥草光合特性与化学成分的影响[D]. 长沙: 湖南大学, 2012.
|
| [14] |
张寒, 钟军, 熊兴耀. 不同光质对鱼腥草幼苗生长及生理特性的影响[J]. 湖南农业科学, 2013(5): 23-26. |
| [15] |
王昭清. 不同光质的LED光源对鱼腥草生理生化及次生代谢的影响[D]. 太原: 山西师范大学, 2016.
|
| [16] |
钟军, 张寒, 熊兴耀. 鱼腥草幼苗叶片结构和光合荧光特性对不同光质的响应[J]. 湖南农业大学学报(自然科学版), 2018, 44(6): 592-596. |
| [17] |
王满莲, 白坤栋, 孔德鑫, 等. 种苗级别对半枫荷生长发育的影响[J]. 种子, 2016, 35(2): 69-72. |
| [18] |
张丽芳, 裘利洪. 蛛网萼开花物候、花部特征及繁育系统研究[J]. 广西植物, 2017, 37(10): 1301-1311. |
| [19] |
朱广廉, 钟海文. 植物生理学实验[M]. 北京: 北京大学出版社, 1990.
|
| [20] |
陈兰英, 肖娟. 不同生境密蒙花光合生理特性及光合曲线最适模型[J]. 生物学杂志, 2022, 39(1): 69-74. |
| [21] |
刘浪涛, 祖超, 鱼欢, 等. 光强对作物库源关系及成花影响的研究进展[J]. 热带农业科学, 2018, 38(11): 1-6, 15. |
| [22] |
杜清福, 商丽丽, 吕家豪, 等. 不同光强对甘薯光合特性和开花的影响[J/OL]. 作物杂志: 1-7[2024-01-24]. http://kns.cnki.net/kcms/detail/11.1808.S.20230330.1208.005.html.
|
| [23] |
SEDDIGH M, JOLLIFF G D. Light intensity effects on meadowfoam growth and flowering[J]. Crop Science, 1994, 34(2): 497-503. |
| [24] |
岳高峰, 韩志强, 薛志伟, 等. 不同遮阴对牡丹花期和光合特性的影响[J]. 江苏农业科学, 2020, 48(17): 166-170. |
| [25] |
REZAZADEH A, HARKESS R L, TELMADARREHEI T. The effect of light intensity and temperature on flowering and morphology of potted red firespike[J]. Horticulturae, 2018, 4(4): 36. |
| [26] |
王磊, 杨倩倩, 高俊鸽, 等. 不同光照环境对秃疮花表型多样性的影响[J]. 西南林业大学学报(自然科学), 2023, 43(4): 68-75. |
| [27] |
唐世梅, 蔡文淇, 张大毛, 等. 光强对三个虎耳草观赏品种的形态及生理指标的影响[J]. 广西植物, 2023, 43(4): 699-711. |
| [28] |
KRESLAVSKI V D, LYUBIMOV V Y, SHIRSHIKOVA G N, et al. Preillumination of lettuce seedlings with red light enhances the resistance of photosynthetic apparatus to UV-A[J]. Journal of Photochemistry and Photobiology B: Biology, 2013, 122C(9): 1-6. |
| [29] |
魏明月, 云菲, 刘国顺, 等. 不同光环境下烟草光合特性及同化产物的积累与分配机制[J]. 应用生态学报, 2017, 28(1): 159-168. |
| [30] |
刘金炽, 招礼军, 朱栗琼, 等. 遮光对红鳞蒲桃幼苗光合特性的影响[J]. 广西科学, 2020, 27(6): 646-654. DOI:10.13656/j.cnki.gxkx.20201214.015 |



