2. 云南新联环境科技有限公司, 云南昆明 650000
2. Yunnan Xinlian Environmental Technology Co., Ltd., Kunming, Yunnan, 650000, China
城市污水处理厂生化尾水中硝酸盐氮(NO3--N)和磷(P)是生化处理的重要参数,也是影响出水水质的主要污染物之一,其主要来源于人类活动排放。当生化尾水中的NO3--N和P含量过高时,会导致水体富营养化,进而引发藻类过度繁殖、水生态系统崩溃等问题。若不小心摄入过多的NO3--N会对人体健康造成严重威胁,如诱发癌症和高铁血红蛋白血症等[1]。
目前,城市污水处理厂生化尾水中NO3--N常规的处理方法是异养反硝化法,异养反硝化的优点在于还原效率高和处理能力强,但是生化尾水中碳氮比(C/N)普遍较低,需要额外投加碳源提高反硝化速率,在遇到水质波动时,投加量不好把握,容易造成二次污染。同时,投加的碳源大部分生成CO2,增加温室气体的排放。自养反硝化技术因其无需添加碳源而受到广泛关注。硫自养反硝化是自养反硝化研究中较为广泛的方向,具有产泥少、不需要外加有机物等优点。目前最常用的硫自养电子供体为单质硫(S0),其反应方程式如下[2]:
| $ \begin{aligned} \quad 55\mathrm{~S}+50 \mathrm{NO}_3^{-}+38 \mathrm{H}_2 \mathrm{O}+20 \mathrm{CO}_2 \uparrow+4 \mathrm{NH}_4^{+} \rightarrow 4 \mathrm{C}_5 \mathrm{H}_7 \mathrm{O}_2 \mathrm{~N}+25 \mathrm{~N}_2 \uparrow+55 \mathrm{SO}_4^{2-}+64 \mathrm{H}^{+}, \end{aligned} $ | (1) |
由式(1)可知,单质硫作为电子供体时会产生大量的硫酸根(SO42-),理论上每去除1 g NO3-会产生7.54 g的SO42-,并伴随着H+的生成。自养反硝化的适宜pH值为7-8[3],若pH值过低,会对反硝化产生较强的抑制作用。有学者研究了单质硫和石灰石的自养反硝化系统,发现加入石灰石后可以在一定程度上抵消硫自养反硝化处理过程中所生成的H+[4],但存在出水硬度和总溶解固体水平提高的问题,且容易造成反应器堵塞。
硫铁矿(FeS2)因在地壳中含量丰富,可作为自养反硝化的潜在电子供体而备受关注[5],其化学反应方程式如下[6]:
| $ \begin{aligned} \quad 2 \mathrm{FeS}_2+6 \mathrm{NO}_3^{-}+4 \mathrm{H}_2 \mathrm{O} \rightarrow 4 \mathrm{SO}_4^{2-}+3 \mathrm{~N}_2 \uparrow+ 2 \mathrm{Fe}(\mathrm{OH})_3+2 \mathrm{H}^{+}, \end{aligned} $ | (2) |
由式(2)可知,理论上每去除1 g NO3-会产生4.57 g SO42-,远小于单质硫的7.54 g。Pang等[6]研究表明,在不同pH值、温度和NO3--N浓度下进行的批量实验中,FeS2是脱氮的有效电子供体。魏秋等[7]研究表明,铁/硫化物可去除90%以上的氮、磷。菱铁矿(FeCO3)能驱动硝酸盐向氮气的转化,化学反应方程式如下[8]:
| $ \begin{aligned} \quad 5 \mathrm{FeCO}_3+\mathrm{NO}_3^{-}+8 \mathrm{H}_2 \mathrm{O} \rightarrow 5 \mathrm{Fe}(\mathrm{OH})_3+0.5 \mathrm{~N}_2 \uparrow+4 \mathrm{CO}_2 \uparrow+\mathrm{HCO}_3^{-}。\end{aligned} $ | (3) |
FeCO3自养反硝化过程会产生碱度和碳酸根,在缓冲体系pH值变化的同时,部分Fe2+氧化产生的Fe3+与PO43-反应生成沉淀,Fe3+水解产生Fe(OH)3,Fe(OH)3具有高比表面积,对PO43-有较好的吸附作用[9],从而达到同时去除氮和磷的目的[10]。Wang等[11]研究表明,以菱铁矿作为电子供体在水力停留时间(Hydraulic Retention Time, HRT)为8 h和4 h时,装置总磷(TP)去除率分别为(72.8±28.5)%和(60.8±32.1)%。若将硫自养反硝化与FeCO3自养反硝化耦合,FeCO3也可作为反硝化电子供体发生自养反硝化,缓冲pH值下降对反硝化作用带来的不利影响,并为系统中的自养微生物提供无机碳源,减少SO42-的生成。
本研究针对城市污水厂生化尾水的水质特点,以硫铁矿和菱铁矿作为复合矿源滤料,探究其在不同C/N以及不同HRT下的脱氮除磷性能,同时结合高通量测序技术,对复合矿源滤料表面微生物群落结构进行分析,以期为污水处理厂低C/N下生化尾水的深度脱氮提供技术参考。
1 材料与方法 1.1 材料 1.1.1 实验装置采用升流式反硝化反应器,如图 1所示,反应器为圆柱形,材质为有机玻璃。设计尺寸:内径50 mm,外径60 mm,高度1 000 mm,有效容积1.9 L。流量由蠕动泵控制,升流式设计有助于反应过程中气体排出,同时创造厌氧环境,利于反硝化发生。本实验中硫铁矿粒径为2-3 mm,菱铁矿粒径为4-5 mm;两者按体积比2∶1混合后用于填充反应器,填充滤层高度为600 mm,反应器底部设100 mm承托层。
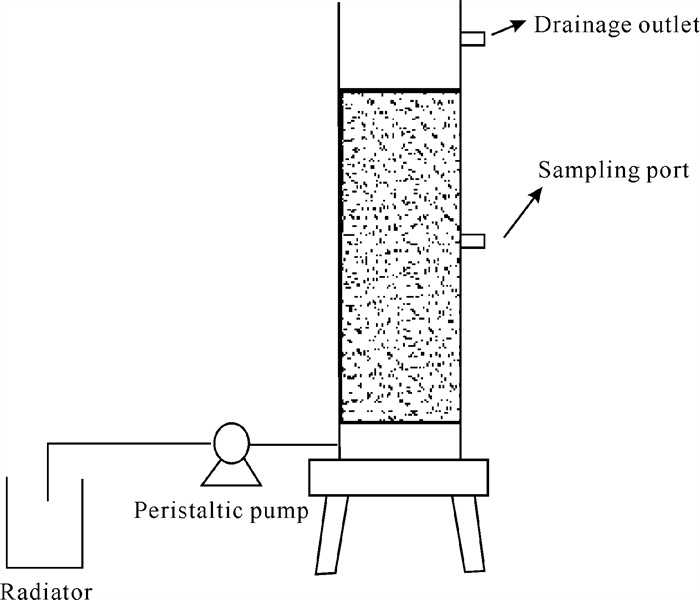
|
| 图 1 实验装置示意图 Fig. 1 Schematic diagram of experimental device |
1.1.2 仪器设备
UV-6100A紫外可见分光光度计购自上海元析仪器有限公司;FA224C电子分析天平购自上海力辰仪器科技有限公司;PHS-25型pH计购自上海雷磁传感器科技有限公司;BT100-2J蠕动泵购自保定融柏恒流泵制造有限公司;扫描电子显微镜(SEM)及能谱仪(JSM-6380LV)购自日本日立公司。
1.2 方法 1.2.1 进水水质及接种污泥实验用水为人工模拟城市污水厂生化尾水,以葡萄糖(C6H12O6·H2O)作为碳源;添加氯化铵(NH4Cl),使氨氮(NH4+-N)浓度约为2 mg/L;添加硝酸钾(KNO3),使氨氮(NO3--N)浓度约为10 mg/L;添加磷酸二氢钾(KH2PO4),使TP浓度约为1 mg/L。选用含硫代硫酸盐的培养基进行微生物富集与培养[12]。接种污泥取自江苏宜兴某污水处理厂厌氧池,取来的厌氧污泥经沉降并倒掉上清液后置于2 L的塑料桶内,加入液体培养基后密封,室温避光培养进行自养反硝化菌的驯化。定期更换培养基[13],培养周期为60 d。培养基成分:Na2S2O3·5H2O 5.00 g/L、KH2PO4 2.02 g/L、KNO3 2.00 g/L、NaHCO3 1.00 g/L、NH4Cl 0.50 g/L、MgCl2·6H2O 0.50 g/L、FeSO4·7H2O 0.01 g/L。
1.2.2 复合矿源滤料自养反硝化实验反应器在室温下连续运行98 d,前8 d为反应器挂膜阶段,反应器接种20 mL驯化好的污泥,采用连续进水方式对反应器进行挂膜。利用蠕动泵将容器中的模拟废水打入反应器中,并将反应器出水回流至上述容器,HRT为24 h。反应器运行分为两部分,第一部分通过改变进水水质,探究不同C/N下复合矿源滤料自养反硝化的脱氮除磷性能,共分为5个梯度,C/N分别为0.8-1.2、1.8-2.2、2.8-3.2、3.8-4.2、4.8-5.2。第二部分通过改变HRT,探究不同HRT下复合矿源滤料自养反硝化的脱氮除磷性能,共分为4个梯度,HRT分别为2、4、6、8 h。运行期间检测水中NO3--N、亚硝酸盐氮(NO2--N)、NH4+-N和TP浓度,以及pH值等指标,运行结束后取反应器内生物膜进行高通量测序[14]。
1.3 水质指标测定水样经0.45 μm滤膜过滤后进行水质指标的测定,水质指标测定方法均按照《水和废水监测分析方法》(第四版)[15]进行。NO3--N的测定采用紫外分光光度法,NO2--N的测定采用N-(1-萘基)-乙二胺分光光度法,NH4+-N的测定采用纳氏试剂分光光度法,TP的测定采用钼酸盐分光光度法,pH值采用PHS-25型pH计进行测定;高通量测序分析委托生工生物工程(上海)股份有限公司完成。
2 结果与分析 2.1 不同C/N下系统脱氮除磷性能分析 2.1.1 脱氮性能分析由图 2(a)可以看出,随着C/N的提高,反应器对NO3--N的去除率总体呈现上升趋势。C/N为0.8-1.2时,NO3--N平均去除率为47.82%;C/N为1.8-2.2时,NO3--N平均去除率为57.73%;C/N为2.8-3.2时,进、出水NO3--N平均浓度分别为10.31 mg/L和1.43 mg/L,NO3--N平均去除率达到86.12%,NO3--N去除性能明显提升。C/N为3.8-4.2和4.8-5.2时,NO3--N平均去除率分别为97.1%和98.2%,出水NO3--N浓度低于0.3 mg/L,NO3--N去除性能进一步提升。表明提高C/N可以强化反硝化作用。
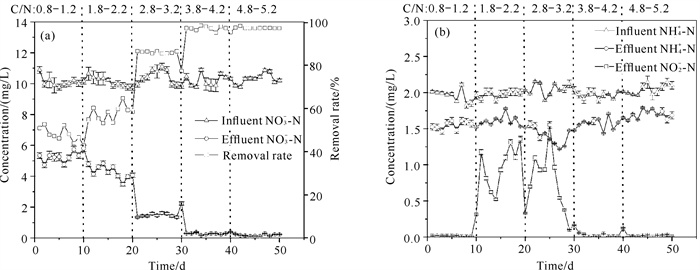
|
| 图 2 不同C/N下氮形态变化 Fig. 2 Changes of nitrogen forms under different C/N |
由图 2(b)可以看出,NO2--N在C/N为0.8-1.2时没有出现积累,这与此时NO3--N的去除率低有关,反应器内的NO2--N主要由NO3--N转化得来。NO2--N在C/N为1.8-2.2和2.8-3.2时存在积累现象,出水浓度在0.10-1.55 mg/L波动。C/N为3.8-4.2和4.8-5.2时,NO2--N浓度低于0.1 mg/L。可以发现,以复合矿源滤料为电子供体时,当NO3-浓度较高时,其对NO2-还原酶产生抑制作用;当NO3-几乎完全被去除时,其对NO2-还原酶的抑制作用才消失。
反应器对NH4+-N具有一定的去除性能,但总体效果不明显。进水NH4+-N浓度为(2.00±0.14) mg/L,出水NH4+-N浓度为(1.57±0.20) mg/L。这是因为以葡萄糖为电子供体的异养反硝化菌会利用NH4+-N进行合成代谢,反应方程式如下[16]:
| $ \begin{gathered} \quad \mathrm{C}_6 \mathrm{H}_{12} \mathrm{O}_6+2.8 \mathrm{NO}_3^{-}+0.5 \mathrm{NH}_4^{-}+2.3 \mathrm{H}^{+} \rightarrow 0.5 \mathrm{C}_5 \mathrm{H}_7 \mathrm{NO}_2+1.4 \mathrm{~N}_2+3.5 \mathrm{CO}_2+6.4 \mathrm{H}_2 \mathrm{O}。\end{gathered} $ | (4) |
与此同时,硫铁矿自养反硝化中也可利用部分NH4+-N[17]。C/N为3.8-4.2和4.8-5.2时,出水NH4+-N浓度呈上升趋势,这与硝酸盐异化还原为铵(Dissimilatory Nitrate Reduction to Ammonium,DNRA)有关,DNRA伴随着生物反硝化过程,且硝酸根浓度较低时,DNRA作用更加强烈[18]。总的来说,复合矿源滤料对NH4+-N的去除没有负面影响,但对进水中低碳源的生物滞留系统有反硝化作用。
2.1.2 除磷性能及pH值变化情况分析复合矿源反硝化系统除磷情况如图 3所示。C/N为0.8-1.2时,出水TP浓度平均值为1.450 mg/L,出现高于进水TP浓度的现象,是因为在反应启动期,驯化微生物的培养基中加入了一定量的KH2PO4,导致反应器内此时残留的磷酸根浓度比进水TP浓度更高;随着反应的进行,残留磷酸根排出,反应器表现出较优的除磷性能。当C/N为2.8-3.2时,出水TP浓度在0.234-0.304 mg/L,TP平均去除率为73.08%;C/N为4.8-5.2时,出水TP浓度在0.341-0.477 mg/L,TP平均去除率为61.27%。表明随着C/N的提高,TP的去除率下降。
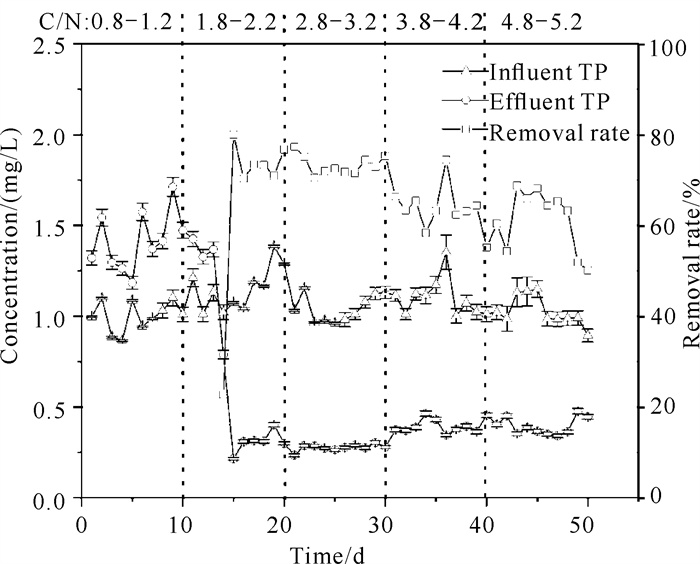
|
| 图 3 不同C/N下TP的去除性能 Fig. 3 TP removal performance under different C/N |
pH值是影响生物脱氮的一个重要因素,硫铁矿自养反硝化过程会产生H+,而pH值过低会对反硝化产生较强的抑制作用[6]。由图 4可以看出,在反应器中菱铁矿自养反硝化过程会产生碱度,缓冲体系pH值的变化。当进水pH值为7.22-7.77时,出水pH值能够维持在7.14-7.67。自养反硝化菌的适宜pH值为7-8[3],复合矿源滤料可以保证反应器内自养反硝化微生物群落的活性和脱氮效果。当C/N为0.8-1.2时,进、出水pH值差值相较C/N为4.8-5.2时较大,这表明在低C/N时生成较多的H+,可以推断此时反应器内大多发生自养反硝化反应,C/N为0.8-1.2时的自养反硝化速率要高于C/N为4.8-5.2时。
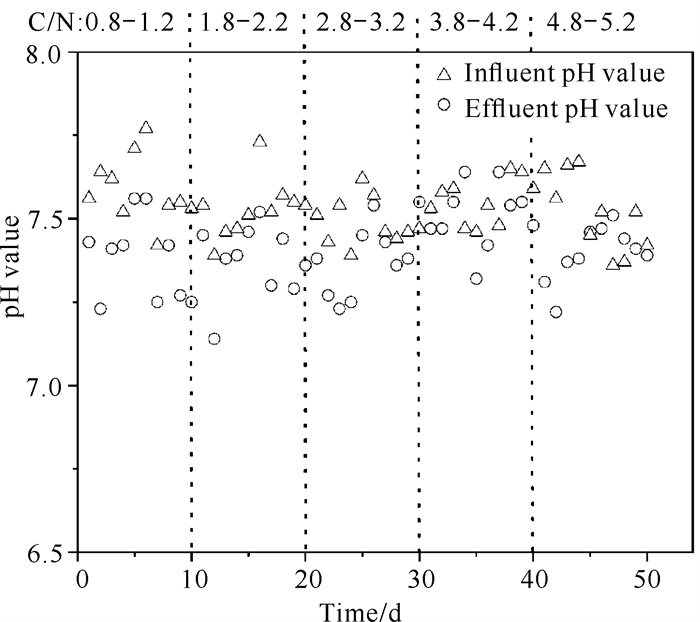
|
| 图 4 不同C/N下pH值变化情况 Fig. 4 pH changes under different C/N |
2.2 不同HRT下系统脱氮除磷性能分析 2.2.1 脱氮性能分析
HRT是生物反应器非常重要的工程控制参数[19]。不同HRT下反应器进、出水NO3--N浓度变化情况如图 5(a)所示。随着HRT的延长,NO3--N去除率提高,在HRT为2 h时,进、出水NO3--N平均浓度分别为9.97 mg/L和7.60 mg/L,平均去除率为23.77%,此时HRT较短,NO3--N不能完全参加反应;在HRT为4 h,进、出水NO3--N平均浓度分别为10.34 mg/L和6.28 mg/L,平均去除率为39.27%。HRT由2 h延长至4 h,NO3--N平均去除率随HRT的延长而提高,但是提高的幅度不大。当HRT由4 h延长至6 h时,NO3--N的平均去除率达到了87.8%,NO3--N去除率有明显变化。研究表明,以复合矿源滤料为电子供体的自养反硝化过程在较短的HRT下NO3--N去除效果不明显,当HRT延长至6 h时达到较高的脱氮效果。HRT为8 h时,脱氮效果进一步得到提升,反应器内NO3--N的平均去除率达到96.3%,随着HRT的增加,复合矿源自养反硝化系统展现出较优的脱氮性能。
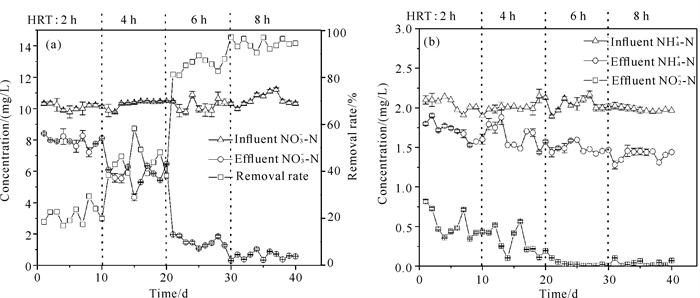
|
| 图 5 不同HRT下氮形态变化(a.NO3--N;b.NH4+-N、NO2--N) Fig. 5 Changes of nitrogen forms under different HRT(a.NO3--N; b.NH4+-N、NO2--N) |
出水NO2--N浓度及进出水NH4+-N浓度如图 5(b)所示。可以看出NO2--N积累量随HRT的延长总体呈减小趋势,HRT为2 h时,反应器出水NO2--N平均浓度为0.52 mg/L;HRT为4 h时,反应器出水NO2--N平均浓度为0.30 mg/L,HRT在2 h和4 h时出现NO2--N积累现象,这是因为反应体系的HRT较短,不足以使NO3--N有效渗透入微生物菌团内部,微生物无法充分利用底物,导致反硝化反应不完全[20]。当HRT延长至6 h时,NO2--N浓度维持在0.10 mg/L以下,此时反硝化反应较为彻底,无明显的NO2--N积累现象。随着HRT的延长,NH4+-N去除效果提升。HRT为2 h时,进、出水NH4+-N平均浓度分别为2.03 mg/L和1.70 mg/L,HRT延长至8 h时进、出水NH4+-N平均浓度分别为2.01 mg/L和1.46 mg/L。
2.2.2 除磷性能及pH值变化情况分析反应器对TP的去除随HRT变化情况如图 6所示。当HRT分别为2、4、6、8 h时,TP平均去除率分别为79.74%、75.35%、74.75%、74.17%。可见,由复合矿源滤料组成的自养反硝化系统在HRT为2-8 h时都表现出明显的除磷效果以及对HRT变化的适应能力。在进水TP浓度为1 mg/L左右的水体中,复合矿源滤料反应器出水TP尽管有波动,但均低于0.3 mg/L,满足《地表水环境质量标准》(GB 3838-2002) Ⅳ类标准。
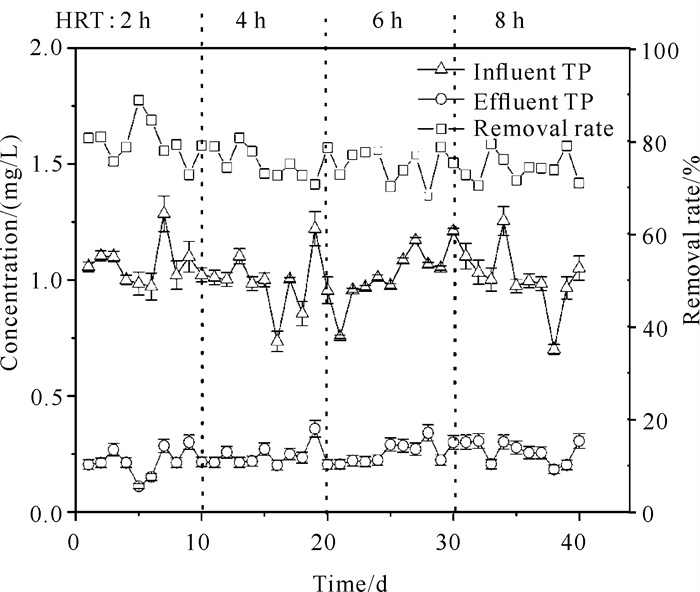
|
| 图 6 不同HRT下TP的去除性能 Fig. 6 TP removal performance under different HRT |
图 7为复合矿源滤料自养反硝化系统在不同HRT下pH值的变化情况。可以看出在进水pH值为7.44-7.81时,反应器出水pH值为7.21-7.64,且随着HRT的增大,出水pH值较进水pH值呈现降低趋势,这是因为随着HRT的延长,反硝化菌对硝态氮的去除率提高,产生H+的量也增多。但pH值均为7-8。可见不同HRT下反应系统可以将pH值维持在适宜反硝化微生物生长发育的区间。
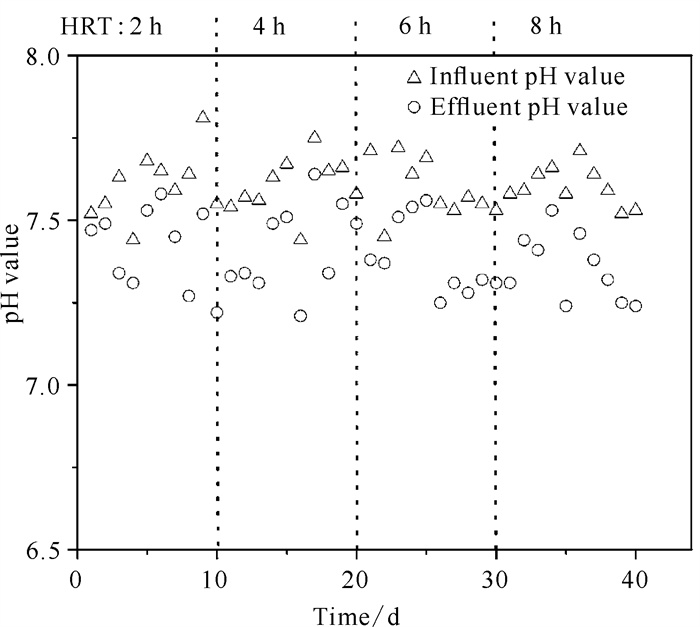
|
| 图 7 不同HRT下pH值变化情况 Fig. 7 Changes in pH value under different HRT |
2.3 自养反硝化系统微生物群落结构解析
对稳定运行时期的滤料进行SEM观察和高通量测序分析。从图 8可以看出,微生物形态呈杆状,而现有相关报道表明大部分自养反硝化细菌都呈杆状[21],因此其可能是自养反硝化菌。

|
| 图 8 稳定运行期滤料表面SEM图 Fig. 8 SEM image of filter material surface in stable operation period |
群落结构可以反映不同分类水平下体系中微生物种类的相对丰度,对系统功能分析具有重要意义。由图 9的高通量测序分析结果可知,门水平相对丰度最高的4个菌门分别是变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、拟杆菌门(Bacteroidetes)和酸杆菌门(Acidobacteria),各占样品微生物总量的39.78%、16.15%、15.06%和7.37%,这4个菌门之和占总样品微生物总量的78.36%。有研究表明,最常见的自养反硝化微生物大多来自变形菌门和拟杆菌门[22]。绿弯菌门是一种复杂菌门,包含好氧嗜热菌、厌氧光养菌等多种微生物,能够将多糖、蛋白质等大分子有机物分解为乙酸等低分子有机酸,并被认为能够参与自养反硝化过程[23]。乳杆菌门(Ignavibacteriae)中也有部分与硫自养反硝化过程相关的细菌,其相对丰度为1.37%。

|
| 图 9 样品微生物在门水平的相对丰度图 Fig. 9 Relative abundance of microorganisms at phylum level |
由图 10可知,复合矿源反硝化系统中主要优势菌属为硫杆菌属(Thiobacillus)、长绳菌属(Longilinea)、硫单胞菌属(Sulfurimonas)、土生单胞菌属(Terrimonas)和热单菌胞菌属(Thermomonas),其所占样品微生物总量比例分别为20.88%、4.11%、4.76%、3.44%和2.24%。硫杆菌属是目前报道最多且最具有代表性的硫自养反硝化菌属,在厌氧条件下以反硝化的方式利用S2-、S2O32-或单质硫还原NO3-、NO2-进行生命活动[24]。此外,热单菌胞菌属也能够以亚铁离子作为电子供体进行自养反硝化反应[25],因此可以推断反应器内主要的微生物反应为硫自养反硝化及部分铁自养反硝化反应。
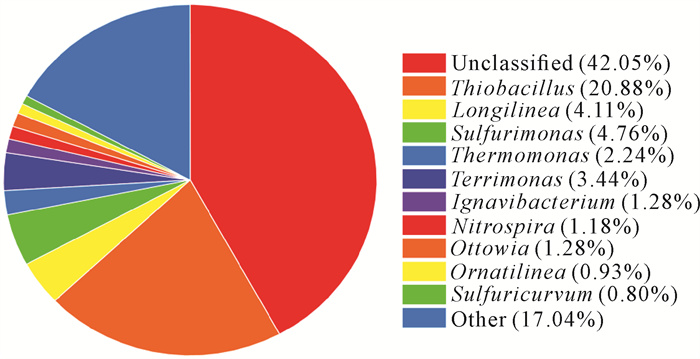
|
| 图 10 样品微生物在属水平的相对丰度 Fig. 10 Relative abundance of microorganisms at genus level |
3 讨论 3.1 不同C/N比下的脱氮除磷性能
城市污水厂生化尾水具有硝酸盐氮和磷浓度高、C/N低的水质特点。张朋锋等[26]研究了不同碳源对反硝化脱氮速率的影响,其中以葡萄糖作为碳源的最佳C/N为8-9,当C/N为3时,异养反硝化出水NO3--N浓度仅比进水低0.6 mg/L。王洪贞等[27]以葡萄糖为外源性碳源,在200 mg (COD)/L的投加量下,NO3--N浓度由初始的28.10 mg/L降至15.32 mg/L,平均去除率为45.6%。可见在低C/N时,异养反硝化的去除效果并不理想。本研究以复合矿源作为自养反硝化滤料,发现其在低C/N下表现出较优的脱氮性能。从C/N对TP去除的影响实验中可以发现,随着C/N的提高,TP的去除效果下降。反应器内TP的去除是因为硫铁矿在反硝化过程中被生物氧化产生铁离子[28],菱铁矿在自养反硝化过程中溶出亚铁离子,铁离子不仅与PO43-生成溶度积小的沉淀物,而且铁离子强烈水解、聚合生成的多核羟基络合物能有效吸附、沉淀PO43-,在反硝化脱氮的同时同步除磷。当C/N提高时,碳源充足,异养反硝化作用更强,NO3--N被异养反硝化菌还原,仅产生少量的Fe2+、Fe3+等产物,从而导致TP去除率降低;在低C/N时,异养反硝化作用减弱,复合矿源滤料自养反硝化逐渐起主导作用,使得TP去除率升高,这表明低C/N有助于加强复合矿源滤料反硝化脱氮作用,并提高TP去除率。
3.2 不同HRT下的脱氮除磷性能在探究复合矿源滤料在不同HRT下的脱氮除磷性能时,发现较短的HRT对氮的去除效果并不明显。推断一方面是因为在HRT较短时,污染物与生物膜的接触不充分,导致自养反硝化菌在短时间内无法发挥作用[29];另一方面,硫铁矿与菱铁矿作为矿源滤料,溶解度相对较低,在HRT较短时,能够被微生物利用的部分非常有限,不能为反硝化提供充足的电子供体。复合矿源滤料自养反硝化系统HRT在2-8 h时都表现出明显的除磷性能以及对HRT变化的适应能力。这与Wu等[30]的研究结果相似,其采用菱铁矿作为滤料进行同步脱硝除磷,发现当HRT由10 h缩短到5 h时并未对除磷产生影响。郑绍智等[31]研究了硫磺和火山岩为填料的自养反硝化系统,在HRT为4 h时,出水pH值为5.4-6.6,受pH值变化的影响,后期硫自养反硝化作用减弱。本研究中菱铁矿可以缓冲体系pH值的变化,反应器内pH值均能维持在适宜微生物生长发育的7-8。
4 结论以硫铁矿和菱铁矿作为复合矿源滤料的升流式反应器可以实现在低C/N生化尾水下对NO3--N和TP的深度处理。以硫铁矿为硫源的自养反硝化过程在较短的HRT时去除效果不明显,HRT为8 h时,对NO3--N的去除率可达到96.3%。HRT的变化对水中TP的去除几乎没有影响,出水总磷尽管有波动,但是均低于0.3 mg/L,满足《地表水环境质量标准》(GB 3838-2002) Ⅳ类标准。在不同HRT和C/N的批次实验中,复合矿源作为自养反硝化滤料,可以缓冲自养反硝化造成的H+下降,在进水pH值为7.22-7.81时,反应体系内pH值维持在7.14-7.67。对稳定运行期污泥进行高通量测序,结果表明:在门水平上变形菌门、绿弯菌门、拟杆菌门和酸杆菌门是自养反硝化菌的主要菌门,占样品微生物总量的78.36%;在属水平上,硫杆菌属丰度最高,占样品微生物总量的20.88%,在反应中占主导地位,是反硝化过程的主要贡献者。
| [1] |
LI P J, LIN K R, FANG Z Q, et al. Enhanced nitrate removal by novel bimetallic Fe/Ni nanoparticles supported on biochar[J]. Journal of Cleaner Production, 2017, 151: 21-33. DOI:10.1016/j.jclepro.2017.03.042 |
| [2] |
MORA M, FERNÁNDEZ M, GÓMEZ J M, et al. Kinetic and stoichiometric characterization of anoxic sulfide oxidation by SO-NR mixed cultures from anoxic biotrickling filters[J]. Applied Microbiology and Biotechnology, 2015, 99(1): 77-87. DOI:10.1007/s00253-014-5688-5 |
| [3] |
刘锋, 张雪智, 王苏琴, 等. 硫代硫酸盐驱动自养反硝化耦合厌氧氨氧化强化总氮去除[J]. 化工进展, 2022, 41(2): 990-997. |
| [4] |
DRISCOLL C T, BISOGNI JAMES J J. The use of sulfur and sulfide in packed bed reactors for autotrophic denitrification[J]. Journal (Water Pollution Control Federation), 1978, 50(3): 569-577. |
| [5] |
YAN R W, KAPPLER A, MUEHE E, et al. Effect of reduced sulfur species on chemolithoautotrophic pyrite oxidation with nitrate[J]. Geomicrobiology Journal, 2018, 36(1): 19-29. |
| [6] |
PANG Y M, WANG J L. Insight into the mechanism of chemoautotrophic denitrification using pyrite (FeS2) as electron donor[J]. Bioresource Technology, 2020, 318: 124105. DOI:10.1016/j.biortech.2020.124105 |
| [7] |
魏秋, 王春荣, 宋俊学, 等. 硫/铁硫化物自养反硝化脱氮除磷研究进展[J]. 工业水处理, 2022, 42(12): 10-16, 25. |
| [8] |
YANG Y, CHEN T H, ZHANG X, et al. Simultaneous removal of nitrate and phosphate from wastewater by siderite based autotrophic denitrification[J]. Chemosphere, 2018, 199: 130-137. DOI:10.1016/j.chemosphere.2018.02.014 |
| [9] |
YANG Y, CHEN T H, SUMONA M, et al. Utilization of iron sulfides for wastewater treatment: a critical review[J]. Reviews in Environmental Science and Bio/Technology, 2017, 16(2): 289-308. DOI:10.1007/s11157-017-9432-3 |
| [10] |
王鑫瑜. 硫铁尾矿自养反硝化系统构建及市政污水氮磷污染物去除能效研究[D]. 合肥: 安徽建筑大学, 2021.
|
| [11] |
WANG W, WEI D Y, LI F C, et al. Sulfur-siderite autotrophic denitrification system for simultaneous nitrate and phosphate removal: from feasibility to pilot experiments[J]. Water Research, 2019, 160: 52-59. DOI:10.1016/j.watres.2019.05.054 |
| [12] |
周可, 潘元, 田天, 等. 铁自养反硝化污泥富集培养过程中化学与生物作用的变化规律[J]. 环境工程学报, 2021, 15(8): 2789-2800. |
| [13] |
PU J Y, FENG C P, LIU Y, et al. Pyrite-based autotrophic denitrification for remediation of nitrate contaminated groundwater[J]. Bioresource Technology, 2014, 173: 117-123. DOI:10.1016/j.biortech.2014.09.092 |
| [14] |
ZHANG R C, XU X J, CHEN C, et al. Interactions of functional bacteria and their contributions to the performance in integrated autotrophic and heterotrophic denitrification[J]. Water Research, 2018, 143: 355-366. DOI:10.1016/j.watres.2018.06.053 |
| [15] |
国家环境保护总局, 《水和废水监测分析方法》编委会. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2002.
|
| [16] |
ARCHNA A, SHARMA S K, SOBTI R. Nitrate removal from ground water: a review[J]. E-Journal of Chemistry, 2012, 9(4): 1667-1675. |
| [17] |
TONG S, RODRIGUEZ-GONZALEZ L C, FENG C P, et al. Comparison of particulate pyrite autotrophic denitrification (PPAD) and sulfur oxidizing denitrification (SOD) for treatment of nitrified wastewater[J]. Water Science and Technology, 2017, 75(1/2): 239-246. |
| [18] |
张稳. 基于硫铁矿自养反硝化同步去除二级出水中氮磷的研究[D]. 北京: 中国地质大学, 2019.
|
| [19] |
刘锋, 张龙飞, 耿雅雯, 等. 碳源强化硫自养反硝化对污水处理厂二级出水深度脱氮的研究[J]. 安全与环境学报, 2023, 23(3): 864-873. |
| [20] |
LE T, PENG B, SU C Y, et al. Nitrate residual as a key parameter to efficiently control partial denitrification coupling with anammox[J]. Water Environment Research, 2019, 91(11): 1455-1465. DOI:10.1002/wer.1140 |
| [21] |
李雅倩, 邹雪华, 刘海波, 等. 不同磁黄铁矿自养反硝化脱氮除磷作用[J]. 环境科学学报, 2022, 42(10): 233-240. |
| [22] |
CHEN D, WANG H Y, YANG K, et al. Performance and microbial communities in a combined bioelectrochemical and sulfur autotrophic denitrification system at low temperature[J]. Chemosphere, 2018, 193: 337-342. DOI:10.1016/j.chemosphere.2017.11.017 |
| [23] |
张衡, 王婧, 王斌, 等. 不同环境因素对厌氧甲烷氧化型自养反硝化系统脱氮性能的影响及其微生物群落分析[J]. 环境工程学报, 2021, 15(11): 3707-3717. DOI:10.12030/j.cjee.202011111 |
| [24] |
PENG C, GAO Y L, FAN X, et al. Enhanced biofilm formation and denitrification in biofilters for advanced nitrogen removal by rhamnolipid addition[J]. Bioresource Technology, 2019, 287: 121387. DOI:10.1016/j.biortech.2019.121387 |
| [25] |
黄召伟. 农村生活污水户用处理设施强化脱氮技术研究[D]. 上海: 上海师范大学, 2022.
|
| [26] |
张朋锋, 马乐宁, 赵金, 等. 深床反硝化生物滤池碳源优选研究[J]. 中国给水排水, 2020, 36(3): 92-96. |
| [27] |
王洪贞, 李毅. 不同外碳源对生物反硝化影响的研究[J]. 科学技术与工程, 2013, 13(19): 5728-5731. |
| [28] |
LIU T, HU Y T, CHEN N, et al. High redox potential promotes oxidation of pyrite under neutral conditions: implications for optimizing pyrite autotrophic denitrification[J]. Journal of Hazardous Materials, 2021, 416: 125844. DOI:10.1016/j.jhazmat.2021.125844 |
| [29] |
田海莹, 宋新山, 王宇晖. 不同价态硫素强化人工湿地反硝化脱氮作用的研究[J]. 工业水处理, 2020, 40(7): 75-79. |
| [30] |
WU M Z, LIU J D, GAO B, et al. Phosphate substances transformation and vivianite formation in P-Fe containing sludge during the transition process of aerobic and anaerobic conditions[J]. Bioresource Technology, 2021, 319: 124259. DOI:10.1016/j.biortech.2020.124259 |
| [31] |
郑绍智, 刘会娟, 彭剑峰, 等. 异养-自养耦合深度脱氮系统的生物脱氮性能研究[J]. 环境科学研究, 2020, 33(2): 385-391. |



