2. 国际竹藤中心竹藤资源与环境研究所, 国家林业和草原局/北京市共建竹藤科学与技术重点实验室, 北京 100102;
3. 国际竹藤中心三亚研究基地, 海南三亚 572022
2. Key Laboratory National Forestry and Grassland Administration/Beijing for Bamboo & Rattan Science and Technology, Institute of Resources and Environment, International Centre for Bamboo and Rattan, Beijing, 100102, China;
3. Sanya Research Base, International Center for Bamboo and Rattan, Sanya, Hainan, 572022, China
直径小于2 mm的根通常被定义为细根,是森林生态系统根系的重要组成部分,在物质循环和能量流动中有重要作用[1]。树种多样性是指在特定生态系统中树的种类数量和相对丰富度,树种多样性通过影响森林的结构和功能,进而为全球环境健康和生物多样性做出贡献。例如,树种丰富度的变化可能影响土壤微生物的结构和功能,进而影响细根的生长和分解,最终改变土壤的碳(C)循环和肥力生产力[2]。这归因于不同的树种在资源获取、光合作用和生长策略上有所不同,使得它们能更有效地利用可用资源。树种多样性增加了生态系统的稳定性,使其对环境变化和外来干扰更有韧性[3]。多样的树种组合为森林提供了功能冗余,即当某些树种受到威胁或减少时,其他树种可以“填补”其功能空缺[4]。此外,不同树种通过其叶片和根系分泌不同的有机物,这些有机物通过影响土壤微生物的活动,从而影响土壤中养分的释放和循环,细根的生长可以增加土壤的孔隙度,提高土壤的渗透性和结构稳定性,从而促进水分和气体在土壤中流动[5]。Gill等[6]在其研究中发现,细根的增长率和死亡率对土壤的物理性质产生了显著影响,尤其是在提高土壤的孔隙度和结构稳定性方面。Eissenstat[7]指出,细根通过分泌有机酸和酶,能够有效吸收土壤中的某些养分,这为植物增加了竞争优势并提高了土壤的肥力。由于具有树种多样性的森林通常生产力更高,可能会吸收和储存更多的碳,这对于减缓全球气候变化具有重要意义[8]。细根的分布会影响土壤微生物,细根与土壤微生物的互动对土壤养分循环和有机物分解至关重要,细根的死亡和分解为微生物提供了食物来源,而微生物的活动又促进了养分的释放,从而供给植物[9, 10]。不同植物种类的细根可能与不同土壤微生物共生,这进一步影响了土壤的化学性质和功能[11]。Ma等[12]研究表明,混交林中细根生物量(Fine Root Biomass, FRB)与各自单一栽培中细根生物量的对数响应比随着物种丰富度的增加而增加。Jactel等[13]研究也表明,在混交林中,不同树种的根系结构差异能促使细根生物量的增加。因此,针对树种混交模式对细根生长影响的研究,对全面认识混交林细根变异规律和作用机制具有重要意义。
叶面积指数(Leaf Area Index,LAI)通常用于描述植物冠层的茂密程度,它可以反映植物对太阳光的捕获能力,进而与光合速率及生产力紧密相关[14-17]。细根生物量的大小与上层植物的生产力、水分和养分吸收能力密切相关。在高叶面积指数的环境中,细根可能会增加,以满足植物对养分和水分的需求[18]。因此,叶面积指数和细根生物量之间的关系,尤其在生态系统的能量转换和养分循环中,值得深入探讨。针叶树种的根系结构通常适应于较贫瘠的土壤,这意味着在较深的土层中可能会有更高的细根生物量,能够在较深的土层中有效地探寻水分和养分[19]。阔叶树种会在较浅的土层中形成更密集的细根网络,以快速吸收表层土壤中的水分和养分[20]。
树种多样性从多方面影响细根生物量,其具体的影响机制尚需要探索。本研究探究树种混交模式如何影响细根生物量,拟为森林管理、生态恢复和生物多样性保护等提供理论参考依据。
1 材料与方法 1.1 研究区概况研究区域位于广西凭祥市中国林业科学研究院热带林业实验中心(106°39′50″-106°59′30″E,21°57′47″-22°19′27″N),海拔250-800 m,最高峰1 045 m,坡度以25°-35°为主。该研究区域为南亚热带季风型半湿润-湿润气候区,水热资源和光照资源丰富,年平均降水量1 200-1 500 mm,降雨多集中在4-9月,具有明显的旱季和湿季;年平均气温20.5-21.7 ℃,积温6 000-7 600 ℃;年蒸发量1 261-1 388 mm,相对湿度80%-84%。成土母岩母质主要有岩浆岩类(如花岗岩和流纹岩)、泥页岩,土壤种类有土地红壤、山地黄壤、砖红壤性红壤和紫色土,土壤肥沃。植被以马尾松(Pinus massoniana)、杉木(Cunninghamia lanceolata)等针叶树种和红锥(Castanopsis hystrix)、格木(Erythrophleum fordii)、香梓楠(Michelia gioii)等珍贵优良阔叶树种为主。
1.2 试验设计本试验依托位于广西凭祥市的中国林业科学研究院热带林业实验中心实验基地,选取青山实验场、白云小试区和伏波实验场3个平台,所选研究区域在造林之前均为马尾松纯林。青山实验场于2004年造林;白云小试区于2006年改造为多树种林;伏波实验场在2008年进行近自然改造,林内树种丰富,多样性高。经过对实验场的踏查,于2020年10-11月,在所有实验场内进行完全随机设计试验,选择坡度、高度和坡向较为一致的地块作为试验样地。如表 1所示,根据试验需求,将23个树种混交模式划分为5种树种丰富度,分别为1、2、3、5和>6。树种丰富度按树种的种类数量决定,如纯林的树种丰富度为1。对树种丰富度1、2、3、5的林分每种随机设置4个20 m×20 m的重复样地,树种丰富度>6的林分设置7个样地,总共71个样地。根据混交的树种类型,将23个树种混交模式分为4种林分混交类型,分别为针叶纯林、阔叶纯林、针阔混交和阔阔混交。
| 树种丰富度 Tree species richness |
树种混交模式 Mixed tree species pattern |
分组编号 Group number |
| 1 | Cunninghamia lanceolata | a |
| Pinus massoniana | b | |
| Mytilaria laosensis | c | |
| Erythrophleum fordii | d | |
| Michelia macclurei | e | |
| Castanopsis hystrix | f | |
| 2 | Castanopsis hystrix, Mytilaria laosensis | g |
| Pinus massoniana, Erythrophleum fordii | h | |
| Pinus massoniana, Castanopsis hystrix | i | |
| 3 | Pinus massoniana, Erythrophleum fordii, Quercus griffithii | j |
| Cunninghamia lanceolate, Erythrophleum fordii, Quercus griffithii | k | |
| Cunninghamia lanceolate, Castanopsis hystrix, Michelia gioii | l | |
| Pinus massoniana, Castanopsis hystrix, Michelia gioii | m | |
| Erythrophleum fordii, Castanopsis hystrix, Mytilaria laosensis | n | |
| 5 | Cunninghamia lanceolate, Erythrophleum fordii, Castanopsis hystrix, Manglietia glauca, Quercus griffithii | o |
| Pinus massoniana, Castanopsis hystrix, Manglietia glauca, Quercus griffithii, Erythrophleum fordii | p | |
| >6 | Adenanthera microsperma, Mytilaria laosensis, Castanopsis hystrix, Litsea monopetala, Manglietia glauca, Michelia baillonii, Albizia kalkora | q |
| Choerospondias axillaris, Mytilaria laosensis, Gmelina hainanensis, Castanopsis hystrix, Bischofia javanica, Aporosa villosa, Michelia baillonii | ||
| Betula alnoides, Castanopsis hystrix, Liquidambar formosana, Erythrophleum fordii, Cunninghamia lanceolate, Bischofia javanica, Melicope pteleifolia, Styrax tonkinensis | ||
| Mytilaria laosensis, Liquidambar formosana, Choerospondias axillaris, Michelia macclurei, Triadica cochinchinensis, Cunninghamia lanceolate, Elaeocarpus sylvestris, Excentrodendron hsienmu | ||
| Michelia baillonii, Mytilaria laosensis, Michelia odora, Erythrophleum fordii, Castanopsis hystrix, Cunninghamia lanceolate, Gmelina hainanensis, Choerospondias axillaris, Michelia macclurei | ||
| Mytilaria laosensis, Michelia odora, Michelia baillonii, Castanopsis hystrix, Erythrophleum fordii, Liquidambar formosana, Cunninghamia lanceolate, Ficus oligodon, Manglietia glauca, Sterculia lanceolata | ||
| Manglietia glauca, Erythrophleum fordii, Castanopsis hystrix, Michelia macclurei, Michelia odora, Canarium album, Manglietia fordiana var.hainanensis, Cunninghamia lanceolate, Ficus oligodon, Michelia baillonii |
1.3 样品测定方法
于2022年8月5日在试验样地进行采样。采样前,需先清除土壤表层上未分解的凋落物和腐殖质,从而露出土壤表面进行采样。使用内径5.5 cm的土钻按照“S”型路线随机钻取5个土芯,钻孔深度为40 cm。取出的土柱按0-10、10-20和20-40 cm进行分割,分别装入样品盒带回实验室处理。土样经浸泡、漂洗、过筛后,挑出根系,用游标卡尺准确计量直径2 mm以下的细根,制成标准样。随后将细根样品在65 ℃下烘干至恒重后称重。细根生物量的计算公式如下:
| $ \text { 细根生物量 }=\frac{\text { 细根干重 }}{\text { 土钻面积 } \times 10^{-4}} \text。$ |
使用Hemiview冠层分析系统测量样地的叶面积指数。Hemiview冠层分析系统由Hemiview分析软件、SLM8自平衡支架、单脚相机架、佳能Cannon EOS 50D单反相机、Sigma EX-DC 4.5 mm鱼眼镜头组成。在9月,将相机安装到自平衡支架上,通过支架上的罗盘将仪器朝北固定,调平后运用适当的相机设置拍照,照片要在光照均匀的晴天或阴天拍摄,拍摄后使用Hemiview软件对冠层照片进行分析。
使用体积为100 cm3的环刀进行采样,每个试验样地采集3个样品,用于计算土壤容重和孔隙度。同时,对试验样地内胸径(Diameter at Breast Height,DBH)大于2 cm的树木进行每木检尺,记录树高(Tree Heigh,TH)、胸径、坐标等信息。
总氮(Total Nitrogen,TN)、土壤有机碳(Soil Organic Carbon,SOC)、碳氮比(Carbon to Nitrogen ratio,C/N)、土壤孔隙度(Soil Porosity,SP)、容重(Bulk Density,BD)、pH值等指标均为测试0-10 cm土层样品得到的指标。
1.4 数据分析本研究运用Origin Pro 2023、R 3.3.1、SPSS 25.0等软件进行数据处理和分析。采用Excel 2019和SPSS 25.0软件对数据进行统计与分析。采用最小显著性差异(Least Significant Difference,LSD)法多重比较相同土层中不同树种丰富度林分之间细根生物量、树种丰富度、土壤理化性质、胸径、树高、叶面积指数、林分密度(Stand Density,SD)的差异,显著性水平设置为P < 0.05。使用Pearson相关性分析树种丰富度、林分状况、土壤理化性质与细根生物量之间的相关性,显著性水平设置为P < 0.05。利用冗余分析(Redundancy Analysis,RDA)筛选出影响细根生物量的关键因子。使用Origin Pro 2023和R 3.3.1软件绘图,图表中所有结果均为平均值±标准误。
2 结果与分析 2.1 试验样地的林分状况和土壤理化性质试验样地的林分状况如表 2、表 3所示。平均胸径随着树种丰富度的增加而减小,树种丰富度1林分的平均胸径最大,为19.04 cm,比最小的树种丰富度>6林分(15.01 cm)高26.85%。树高随着树种丰富度的增加而减小,并且树种丰富度1林分的树高(13.59 m)显著大于其他树种丰富度林分,比最小的树种丰富度>6林分(10.70 m)高27.01%。林分密度在各树种丰富度林分之间无显著差异。叶面积指数在各树种丰富度的林分之间无显著差异,树种丰富度5和>6林分的叶面积指数最大(2.58),比最小的树种丰富度2林分(2.31)高11.69%。总氮在各树种丰富度林分中含量为1.87-2.16 g·kg-1且差异不显著(P>0.05),随树种丰富度的增加呈现出先减后增的变化趋势。土壤有机碳在各树种丰富度林分中含量为26.80-32.30 g·kg-1,差异不显著(P>0.05),树种丰富度5林分的土壤有机碳含量比树种丰富度2林分高20.52%。碳氮比在各树种丰富度林分中为13.11-16.30,树种丰富度5林分的碳氮比比树种丰富度>6林分高24.33%。土壤孔隙度在各树种丰富度林分中为52.26%-59.23%,树种丰富度3林分的土壤孔隙度比树种丰富度2林分高13.34%。容重在各树种丰富度林分中为1.05-1.16 g·cm-3,树种丰富度>6林分的容重比树种丰富度5林分高10.48%。pH值在各树种丰富度林分中为4.11-4.66,树种丰富度>6林分的pH值(4.66)显著大于其他树种丰富度林分,树种丰富度5林分的pH值(4.11)最小,树种丰富度>6林分的pH值比树种丰富度5林分高13.38%。
| 树种丰富度 Tree species richness |
平均胸径/cm Average DBH/cm |
树高/m TH/m |
林分密度/(Trees·hm-2) SD/(Trees·hm-2) |
叶面积指数 LAI |
| 1 | 19.04±1.16a | 13.59±0.64a | 917.71±88.04a | 2.37±0.08a |
| 2 | 17.59±0.96ab | 11.58±0.58b | 820.83±75.37a | 2.31±0.07a |
| 3 | 16.29±0.55b | 11.85±0.59b | 907.50±64.25a | 2.35±0.06a |
| 5 | 15.85±0.72ab | 11.44±0.74b | 918.75±67.44a | 2.58±0.19a |
| >6 | 15.01±0.84b | 10.70±0.71b | 871.43±72.26a | 2.58±0.15a |
| Note: different lowercase letters in the same column indicate significant differences between different forest stand types (P < 0.05). | ||||
| 树种丰富度 Tree species richness |
总氮/
(g·kg-1) TN/(g·kg-1) |
土壤有机碳/
(g·kg-1) SOC/(g·kg-1) |
碳氮比 C/N |
土壤孔隙度/% SP/% |
容重/(g·cm-3) BD/(g·cm-3) |
pH值 pH value |
| 1 | 2.07±0.07a | 30.61±1.31a | 14.72±0.31b | 54.71±1.57ab | 1.06±0.03ab | 4.34±0.07b |
| 2 | 1.87±0.11a | 26.80±2.57a | 13.96±0.66bc | 52.26±1.98b | 1.12±0.03ab | 4.32±0.04b |
| 3 | 1.97±0.06a | 30.06±1.49a | 15.18±0.38ab | 59.23±0.95a | 1.07±0.03ab | 4.18±0.05b |
| 5 | 1.96±0.14a | 32.30±3.20a | 16.30±0.54a | 57.47±1.47ab | 1.05±0.03b | 4.11±0.15b |
| >6 | 2.16±0.06a | 28.32±1.44a | 13.11±0.44c | 56.82±1.48ab | 1.16±0.03a | 4.66±0.13a |
| Note: different lowercase letters in the same column indicate significant differences between different forest stand types (P < 0.05). | ||||||
2.2 不同树种丰富度和树种组成对细根生物量的影响
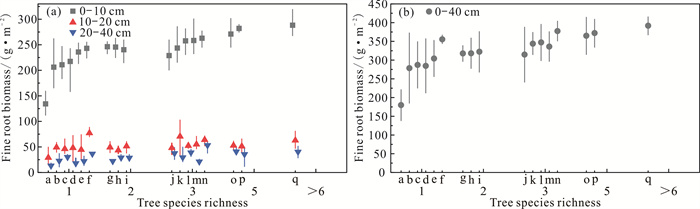
不同树种丰富度林分在各土层中的细根生物量均存在显著差异(P < 0.05),细根生物量分布规律均为0-10 cm土层>10-20 cm土层>20-40 cm土层(图 1)。在10-20 cm土层的细根生物量和树种丰富度无显著相关性(P=0.052),而0-10、20-40、0-40 cm土层的细根生物量和树种丰富度呈显著正相关(P < 0.001)(图 2)。不同的树种丰富度和树种组成使细根生物量存在差异,例如,在树种丰富度1林分中,杉木纯林的细根生物量低于其他林分,而红锥纯林的细根生物量最高;在树种丰富度3林分中,由格木、红锥和米老排(Mytilaria laosensis)这3种树种组成的林分的细根生物量显著高于其他树种混交模式(图 1)。
|
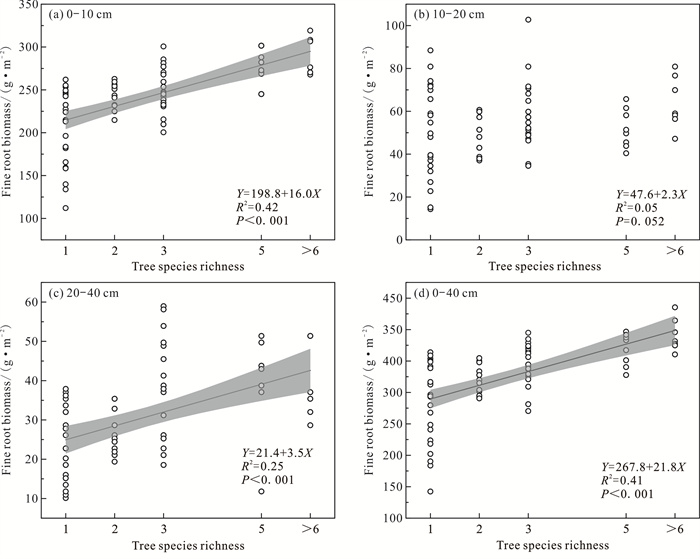
| 图 2 细根生物量与树种丰富度的关系 Fig. 2 Relationship between fine root biomass and tree species richness |
2.3 叶面积指数对细根生物量的影响
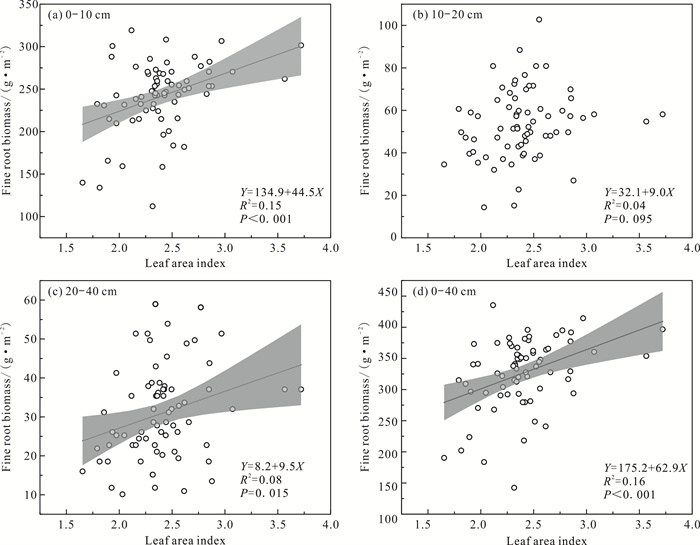
由图 3可知,0-10、20-40、0-40 cm土层的细根生物量与叶面积指数均呈显著正相关(P < 0.001、P=0.015、P < 0.001),细根生物量随着叶面积指数的增大而增大;而10-20 cm土层的细根生物量和叶面积指数没有显著相关性。
|
| 图 3 细根生物量与叶面积指数的关系 Fig. 3 Relationship between fine root biomass and leaf area index |
2.4 林分混交类型对细根生物量的影响
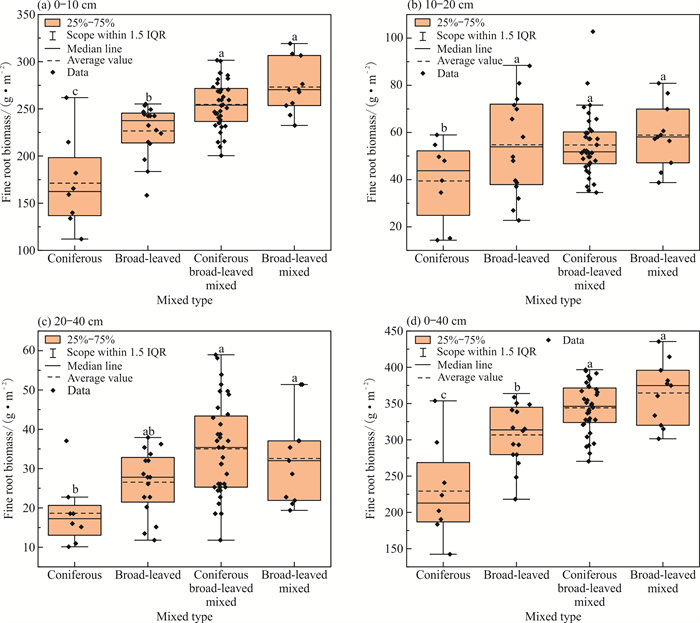
林分混交类型对细根生物量的影响如图 4所示。在0-10 cm土层中,细根生物量随林分混交类型的变化存在极显著差异(P < 0.01),其大小依次为阔阔混交>针阔混交>阔叶纯林>针叶纯林,其中针叶纯林显著小于其他混交类型林分。在10-20 cm土层中,针叶纯林的细根生物量显著小于其他混交类型林分,细根生物量大小依次为阔阔混交>阔叶纯林>针阔混交>针叶纯林。在20-40 cm土层中,细根生物量存在极显著差异(P < 0.01),针叶纯林显著小于针阔混交和阔阔混交,细根生物量大小依次为针阔混交>阔阔混交>阔叶纯林>针叶纯林。在0-40 cm土层中,不同混交类型林分的细根生物量存在极显著差异(P < 0.01),针叶纯林显著小于其他类型林分,细根生物量大小依次为阔阔混交>针阔混交>阔叶纯林>针叶纯林。
|
| Different letters represent significant differences. 图 4 林分混交类型对细根生物量的影响 Fig. 4 Effects of mixed stand types on fine root biomass |
2.5 Pearson相关性和冗余分析
如图 5所示,Pearson相关性分析表明,全树种丰富度林分的0-40 cm土层细根生物量与树种丰富度、叶面积指数呈显著正相关(P≤0.001),与土壤孔隙度呈正相关(P < 0.05);而与平均胸径、树高呈显著负相关(P≤0.001)。树种丰富度1林分的0-40 cm土层细根生物量与树种组成呈显著正相关(P≤0.001),与叶面积指数呈正相关(P < 0.05);10-20和20-40 cm土层的细根生物量分别与树高和林分密度呈负相关(P < 0.05)。树种丰富度2林分的20-40 cm土层细根生物量与树种组成和林分密度呈正相关(P < 0.05)。树种丰富度3林分的0-40 cm土层细根生物量与树种组成呈正相关(P < 0.05)。树种丰富度5和>6林分的0-40 cm土层细根生物量与pH值呈正相关(P < 0.05);20-40 cm土层细根生物量与平均胸径呈负相关(P < 0.05)。
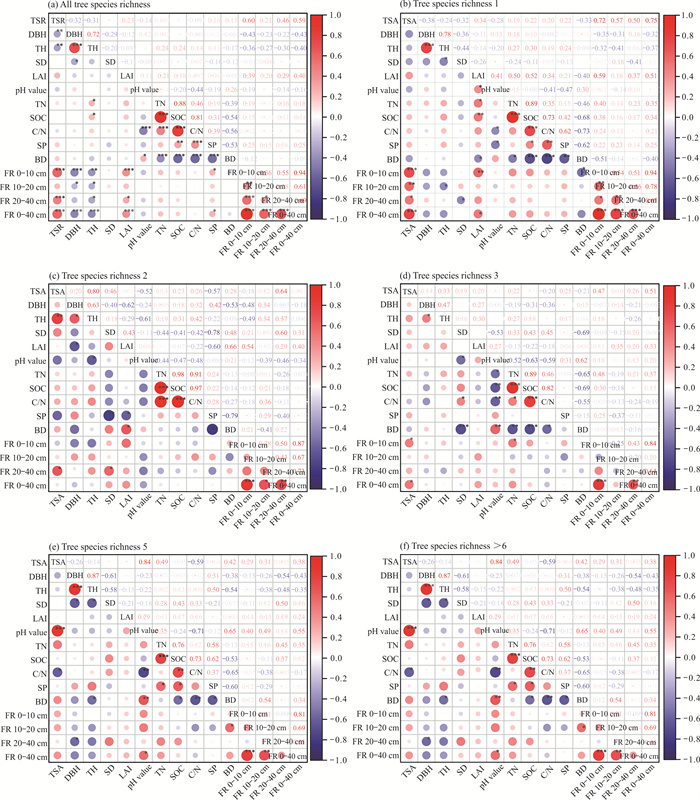
|
| *means P≤0.05, * * means P≤0.01, * * * means P≤0.001.TSR: tree species richness; TSA: tree species assembly of the same tree species richness; FR: fine root biomass. 图 5 细根生物量与各影响因子的Pearson相关性 Fig. 5 Pearson correlations between fine root biomass and influencing factors |
以细根生物量为响应变量,树种丰富度、林分结构、土壤理化性质等影响因子为解释变量进行冗余分析。结果表明,全树种丰富度林分的第一主轴和第二主轴分别解释了细根生物量变异的53.21%和0.56%;其中树种丰富度(P=0.002)、叶面积指数(P=0.006)、平均胸径(P=0.006)、容重(P=0.048)显著影响细根生物量[图 6(a)]。以细根生物量为响应变量,树种组成、林分结构、土壤理化性质等影响因子为解释变量进行冗余分析,结果表明,树种丰富度1林分的第一主轴和第二主轴分别解释了细根生物量变异的79.55%和3.53%;其中树种组成(P=0.002)、叶面积指数(P=0.042)、林分密度(P=0.028)显著影响细根生物量[图 6(b)]。树种丰富度2林分的第一主轴和第二主轴分别解释了细根生物量变异的87.76%和10.02%;其中林分密度(P=0.003)显著影响细根生物量[图 6(c)]。树种丰富度3林分的第一主轴和第二主轴分别解释了细根生物量变异的71.47%和8.79%;其中树种组成(P=0.036)、pH值(P=0.028)显著影响细根生物量[图 6(d)]。树种丰富度5林分的第一主轴和第二主轴分别解释了细根生物量变异的86.02%和11.07%;其中平均胸径(P=0.038)显著影响细根生物量[图 6(e)]。树种丰富度>6林分中没有显著影响细根生物量的因子,其P值均大于0.05[图 6(f)]。
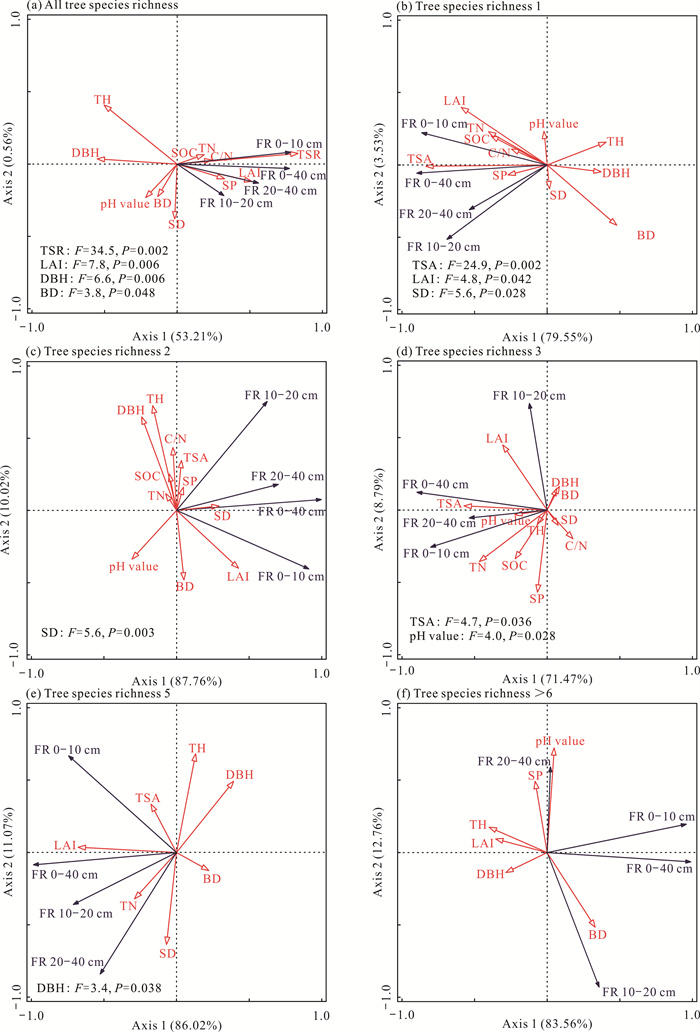
|
| TSR: tree species richness; TSA: tree species assembly of the same tree species richness; FR: fine root biomass. 图 6 细根生物量与各影响因子的冗余分析 Fig. 6 Redundancy analysis of fine root biomass and influencing factors |
3 讨论 3.1 不同树种丰富度和树种混交模式对细根生物量的影响
在树种丰富度较低的森林中,细根生物量可能受到某一占主导地位树种的影响。此树种的特定生长习性、根系分布和树种与土壤微生物的互动都会直接影响细根生物量。本研究中,杉木纯林的细根生物量极显著低于其他纯林,在某些单一树种主导的森林中,细根生物量可能会减少,这可能是由于树种间的竞争较小,或缺乏与其他树种的互补效应[21];红锥纯林的细根生物量显著高于其他纯林,在由某些单一树种组成的森林中,尤其是那些根系深入、耐阴性强的树种,细根生物量可能会增加,因为这些树种更可能在土壤中形成复杂的根系网络[22]。
本研究发现,高树种丰富度林分的细根生物量显著高于低树种丰富度林分。不同的树种组成可能导致细根生物量的显著差异,在树种丰富度3林分中,相较于其他树种混交模式,由格木、红锥和米老排组成的林分的细根生物量最高,说明不同树种的存在可能导致更加均衡的资源分配和更多的生态位分化,多样性的树种之间存在广泛的互补和相互作用,从而促进细根生物量的增加。Matesanz等[23]通过对比研究发现,某些特定的树种组成会促进细根生物量的增加,这可能是由于它们在资源利用、根系结构和与土壤微生物的互动上存在互补效应。高树种丰富度森林的细根生物量明显高于低、中树种丰富度森林,这是因为在高树种丰富度森林中,不同的树种利用了不同的土壤层次和资源,从而使细根的生长和分布最大化[24]。总的来说,树种丰富度对细根生物量有着明显的影响。随着树种丰富度的增加,细根生物量也呈现上升的趋势,这是由于树种间产生互补效应,从而提高资源利用效率。这涉及树种的生长习性、根系特点、与土壤微生物的互作方式以及树种间的互补和竞争关系。
土壤深度是影响细根分布的关键因素。不同土层的物理和化学性质,如土壤质地、水分和养分含量,都会影响细根的分布和生长,这种分布对森林生态系统的碳循环和养分循环具有重要意义。本研究中,细根生物量在0-10、10-20、20-40、0-40 cm土层中均随着树种丰富度的增加而增加,且Pearson相关性分析表明树种丰富度与各土层的细根生物量均存在显著正相关。由于在0-10 cm土层中有丰富的有机物质和养分,细根在此层的分布可能受到树种多样性的显著影响。在单一或低树种丰富度的森林中,细根可能更倾向于在此层集中[25]。当树种丰富度增加时,由于不同树种对养分的互补利用,导致表层土壤的细根生物量进一步增加[26]。本研究中,所有树种丰富度林分在10-20 cm土层中的细根生物量相比于0-10 cm土层均显著下降,但是,Jackson等[27]发现,与表层土壤相比,单一树种在10-20 cm的细根生物量略有下降,而在高树种丰富度的森林中,细根生物量可能会因为多树种之间的生态位隔离和互补效应而增加[28]。在低树种丰富度的森林中,20-40 cm土层的细根生物量可能会减少[29],而在高树种丰富度的森林中,由于多种树种可能采用不同的深层养分吸收策略,深层土壤的细根生物量可能会增加[30]。
3.2 叶面积指数和林分混交类型对细根生物量的影响植物通过其冠层吸收太阳光能,并将这些能量转化为生物量进行生长。本研究中,0-10、20-40、0-40 cm土层的细根生物量与叶面积指数存在正相关,其中,在0-10和0-40 cm土层中两者均呈显著正相关,细根生物量随着叶面积指数的增大而增大,在10-20 cm土层也呈上升趋势。较高的叶面积指数往往意味着植物有更高的光合速率,能够固定更多大气中的二氧化碳,这些被固定的碳部分通过植物残体进入土壤,为土壤微生物提供食物来源,促进微生物活动。微生物分解植物残体,将有机质转化为土壤中的稳定有机物,从而提高土壤有机碳含量。此外,较高的叶面积指数通常代表植被较茂盛,而茂盛的植被可以减轻雨水对土壤的冲刷,减缓土壤侵蚀,减少有机碳的流失,在这种情况下,细根生物量可能会增加,以提高对土壤中养分的吸收和利用,并满足植物对养分和水分的需求[31, 32],从而获得更高的总生物量和生产率[33]。因此,随着叶面积指数的增加,细根生物量相应增加。
本研究表明,针叶纯林在各个土层中的细根生物量最低,显著小于阔叶纯林、针阔混交和阔阔混交;针阔混交的细根生物量在各个土层中都较高;阔阔混交在0-10 cm土层土壤中的细根生物量最高,高于其他3种林分混交类型。阔叶树种在土壤表层中细根网络更密集,有利于快速吸收表层土壤中的水分和养分,因此在表层土壤中具有更高的细根生物量[1, 3, 20, 34, 35]。在针阔混交林中,不同树种的根系特性导致更复杂的细根分布,针叶树种在较深的土层中占优势,而阔叶树种则在表层土壤中占优势,这种混交类型使不同土层中的细根生物量都较高[19, 36, 37]。阔阔混交林在表层土壤中表现出较高的细根生物量,因为阔叶树种间具有细根竞争和重叠,影响细根的分布和总量[20, 38]。这些不同林分混交类型在不同土层中的细根分布和生物量上的差异,反映了树种对资源利用的适应策略。这些适应策略影响着植物对水分和养分的获取,以及植物与土壤间的相互作用。钱文丽等[39]和王力等[40]的研究表明,混交林的细根生物量与纯林相比显著提升。不同树种对细根生物量的贡献存在特异性,因此,在同一树种丰富度下不同树种混交能引入更多的树种特异性效应。
4 结论不同树种混交模式林分的细根生物量随土层加深均呈现下降趋势。在0-10、20-40 cm土层中,细根生物量与树种多样性呈显著正相关,相比之下,10-20 cm土层中的细根生物量对树种多样性的响应不如0-10 cm土层明显。细根生物量与叶面积指数呈显著正相关。针叶、阔叶的混交对细根生物量有显著影响,细根生物量大小依次为阔阔混交>针阔混交>阔叶纯林>针叶纯林。
| [1] |
SCHUSTER M J, WILLIAMS L J, STEFANSKI A, et al. Patterns of belowground overyielding and fine-root biomass in native and exotic angiosperms and gymnosperms[J]. Oikos, 2023, 2023(1): e08877. DOI:10.1111/oik.08877 |
| [2] |
TOPP C N, BRAY A L, ELLIS N A, et al. How can we harness quantitative genetic variation in crop root systems for agricultural improvement?[J]. Journal of Integrative Plant Biology, 2016, 58(3): 213-225. DOI:10.1111/jipb.12470 |
| [3] |
RUARK G A, ZARNOCH S J. Soil carbon, nitrogen, and fine root biomass sampling in a pine stand[J]. Soil Science Society of America Journal, 1992, 56(6): 1945-1950. DOI:10.2136/sssaj1992.03615995005600060049x |
| [4] |
HAKKENBERG C R, SONG C, PEET R K, et al. Forest structure as a predictor of tree species diversity in the North Carolina Piedmont[J]. Journal of Vegetation Science, 2016, 27(6): 1151-1163. DOI:10.1111/jvs.12451 |
| [5] |
DUAN P P, FU R T, NOTTINGHAM A T, et al. Tree species diversity increases soil microbial carbon use efficiency in a subtropical forest[J]. Global Change Biology, 2023, 29(24): 7131-7144. DOI:10.1111/gcb.16971 |
| [6] |
GILL R A, JACKSON R B. Global patterns of root turnover for terrestrial ecosystems[J]. New Phytologist, 2000, 147(1): 13-31. DOI:10.1046/j.1469-8137.2000.00681.x |
| [7] |
EISSENSTAT D. Root structure and function in an ecological context[J]. New Phytologist, 2000, 148(3): 353-354. DOI:10.1046/j.1469-8137.2000.00781.x |
| [8] |
NADELHOFFER K J, RAICH J W. Fine root production estimates and belowground carbon allocation in forest ecosystems[J]. Ecology, 1992, 73(4): 1139-1147. DOI:10.2307/1940664 |
| [9] |
CAMENZIND T, HÄTTENSCHWILER S, TRESEDER K K, et al. Nutrient limitation of soil microbial processes in tropical forests[J]. Ecological Monographs, 2018, 88(1): 4-21. DOI:10.1002/ecm.1279 |
| [10] |
TESTOLIN R, ATTORRE F, JIMÉNEZ-ALFARO B. Global distribution and bioclimatic characterization of alpine biomes[J]. Ecography, 2020, 43(6): 779-788. DOI:10.1111/ecog.05012 |
| [11] |
SON Y, HWANG J. Fine root biomass, production and turnover in a fertilized Larix leptolepis plantation in central Korea[J]. Ecological Research, 2003, 18(3): 339-346. DOI:10.1046/j.1440-1703.2003.00559.x |
| [12] |
MA Z L, CHEN H Y H. Effects of species diversity on fine root productivity in diverse ecosystems: a global meta-analysis[J]. Global Ecology and Biogeography, 2016, 25(11): 1387-1396. DOI:10.1111/geb.12488 |
| [13] |
JACTEL H, GRITTI E S, DRÖSSLER L, et al. Positive biodiversity-productivity relationships in forests: climate matters[J]. Biology Letters, 2018, 14(4): 20170747. DOI:10.1098/rsbl.2017.0747 |
| [14] |
YANG J, MEDLYN B E, DE KAUWE M G, et al. Applying the concept of ecohydrological equilibrium to predict steady state leaf area index[J]. Journal of Advances in Modeling Earth Systems, 2018, 10(8): 1740-1758. DOI:10.1029/2017MS001169 |
| [15] |
XIN Q C, ZHOU X W, WEI N, et al. A semiprognostic phenology model for simulating multidecadal dynamics of global vegetation leaf area index[J]. Journal of Advances in Modeling Earth Systems, 2020, 12(7): e2019MS001935. DOI:10.1029/2019MS001935 |
| [16] |
CHEN J M, RICH P M, GOWER S T, et al. Leaf area index of boreal forests: theory, techniques, and measurements[J]. Journal of Geophysical Research: Atmospheres, 1997, 102(D24): 29429-29443. DOI:10.1029/97JD01107 |
| [17] |
WARING B G, SMITH K R, GROTE E E, et al. Climatic controls on soil carbon accumulation and loss in a dryland ecosystems[J]. Journal of Geophysical Research: Biogeosciences, 2021, 126(12): e2021JG006492. DOI:10.1029/2021JG006492 |
| [18] |
KOVENOCK M, KOVEN C D, KNOX R G, et al. Leaf trait plasticity alters competitive ability and functioning of simulated tropical trees in response to elevated carbon dioxide[J]. Global Biogeochemical Cycles, 2021, 35(2): e2020GB006807. DOI:10.1029/2020GB006807 |
| [19] |
YANG K, ZHU J J, XU S, et al. Conversion from temperate secondary forests into plantations (Larix spp.): impact on belowground carbon and nutrient pools in northeastern China[J]. Land Degradation & Development, 2018, 29(11): 4129-4139. |
| [20] |
WANG C G, CHEN Z, YIN H, et al. The responses of forest fine root biomass/necromass ratio to environmental factors depend on mycorrhizal type and latitudinal region[J]. Journal of Geophysical Research: Biogeosciences, 2018, 123(5): 1769-1788. DOI:10.1029/2017JG004308 |
| [21] |
PANDEY R, BARGALI S S, BARGALI K, et al. Temporal variability in fine root dynamics in relation to tree girth size in sub-tropical sal (Shorea robusta) forests[J]. Land Degradation & Development, 2023, 34(5): 1522-1537. |
| [22] |
SMITH J E, MCKAY D, BRENNER G, et al. Early impacts of forest restoration treatments on the ectomycorrhizal fungal community and fine root biomass in a mixed conifer forest[J]. Journal of Applied Ecology, 2005, 42(3): 526-535. DOI:10.1111/j.1365-2664.2005.01047.x |
| [23] |
MATESANZ S, PESCADOR D S, PÍAS B, et al. Estimating belowground plant abundance with DNA metabarcoding[J]. Molecular Ecology Resources, 2019, 19(5): 1265-1277. DOI:10.1111/1755-0998.13049 |
| [24] |
FENG C, WANG Z, ZHU Q, et al. Rapid increases in fine root biomass and production following cessation of anthropogenic disturbances in degraded forests[J]. Land Degradation & Development, 2018, 29(3): 461-470. |
| [25] |
NEUMANN M, GODBOLD D L, HIRANO Y, et al. Improving models of fine root carbon stocks and fluxes in European forests[J]. Journal of Ecology, 2020, 108(2): 496-514. DOI:10.1111/1365-2745.13328 |
| [26] |
NAKANO A, IKENO H, KIMURA T, et al. Automated analysis of fine-root dynamics using a series of digital images[J]. Journal of Plant Nutrition and Soil Science, 2012, 175(5): 775-783. DOI:10.1002/jpln.201100316 |
| [27] |
JACKSON R B, COOK C W, PIPPEN J S, et al. Increased belowground biomass and soil CO2 fluxes after a decade of carbon dioxide enrichment in a warm-temperate forest[J]. Ecology, 2009, 90(12): 3352-3366. DOI:10.1890/08-1609.1 |
| [28] |
NOTTINGHAM A T, TURNER B L, WINTER K, et al. Root and arbuscular mycorrhizal mycelial interactions with soil microorganisms in lowland tropical forest[J]. FEMS Microbiology Ecology, 2013, 85(1): 37-50. DOI:10.1111/1574-6941.12096 |
| [29] |
SMITH S W, WOODIN S J, PAKEMAN R J, et al. Root traits predict decomposition across a landscape-scale grazing experiment[J]. New Phytologist, 2014, 203(3): 851-862. DOI:10.1111/nph.12845 |
| [30] |
ZHU Q, IVERSEN C M, RILEY W J, et al. Root traits explain observed tundra vegetation nitrogen uptake patterns: implications for trait-based land models[J]. Journal of Geophysical Research: Biogeosciences, 2016, 121(12): 3101-3112. DOI:10.1002/2016JG003554 |
| [31] |
POORTER H, RYSER P. The limits to leaf and root plasticity: what is so special about specific root length?[J]. New Phytologist, 2015, 206(4): 1188-1190. DOI:10.1111/nph.13438 |
| [32] |
钟兆全. 闽北毛竹林土壤有机碳含量特征及其影响因素[J]. 福建林业科技, 2017, 44(2): 36-42, 81. |
| [33] |
JOHNSEN K, MAIER C, SANCHEZ F, et al. Physiological girdling of pine trees via phloem chilling: proof of concept[J]. Plant, Cell & Environment, 2007, 30(1): 128-134. |
| [34] |
ZENG W X, XIANG W H, ZHOU B, et al. Positive tree diversity effect on fine root biomass: via density dependence rather than spatial root partitioning[J]. Oikos, 2021, 130(1): 1-14. DOI:10.1111/oik.07777 |
| [35] |
HERTEL D, STRECKER T, MÜLLER-HAUBOLD H, et al. Fine root biomass and dynamics in beech forests across a precipitation gradient: is optimal resource partitioning theory applicable to water-limited mature trees?[J]. Journal of Ecology, 2013, 101(5): 1183-1200. DOI:10.1111/1365-2745.12124 |
| [36] |
VAN DO T, SATO T, SAITO S, et al. Fine-root production and litterfall: main contributions to net primary production in an old-growth evergreen broad-leaved forest in southwestern Japan[J]. Ecological Research, 2015, 30(5): 921-930. DOI:10.1007/s11284-015-1295-x |
| [37] |
MAKITA N, HIRANO Y, MIZOGUCHI T, et al. Very fine roots respond to soil depth: biomass allocation, morphology, and physiology in a broad-leaved temperate forest[J]. Ecological Research, 2011, 26(1): 95-104. DOI:10.1007/s11284-010-0764-5 |
| [38] |
VALVERDE-BARRANTES O J, SMEMO K A, FEI-NSTEIN L M, et al. Aggregated and complementary: symmetric proliferation, overyielding, and mass effects explain fine-root biomass in soil patches in a diverse temperate deciduous forest landscape[J]. New Phytologist, 2015, 205(2): 731-742. DOI:10.1111/nph.13179 |
| [39] |
钱文丽, 卢元, 王韶仲, 等. 混交对红松人工林细根生物量和空间分布的影响[J]. 东北林业大学学报, 2016, 44(2): 1-5. |
| [40] |
王力, 吴福金, 邓文鑫, 等. 马尾松混交林细根生物量研究[J]. 安徽农业大学学报, 2013, 40(2): 225-232. |