2. 广西科学院, 广西南宁 530007
2. Guangxi Academy of Sciences, Nanning, Guangxi, 530007, China
心电图(ECG)是一种对心脏电活动的描记,反映了心脏的跳动规律和形态,是目前普遍被接受的心率测量途径,可用于诊断心律失常、心肌缺血、心肌梗死等多种疾病。持续性监测和分析ECG对心血管疾病的预防、控制和诊断具有重要意义[1]。然而传统的ECG信号采集方法,需要将电极贴在人体表面进行测量,不仅容易受到表面皮肤的干扰,同时会对患者的正常生理信号造成影响,在许多场景下对特殊病人来说存在较大局限性,不易于长期监测。
随着传感器技术的快速发展,低功率、低成本、便携式的雷达传感器,如24 GHz和60-77 GHz的高频、高带宽的毫米波雷达[2, 3],已经在各领域被大量使用。毫米波雷达不受温度、光照的影响,并具有一定穿透能力,能够通过分析人体表面的雷达回波信号,提取出高精度的心率和呼吸率等生理体征信息,相比红外、光学等技术,其在无接触式测量、运动目标、复杂场景和多目标监测方面具有独特优势,因此毫米波雷达技术目前已成为生理信号监测领域的研究热点,在睡眠监测、智能家居和疲劳驾驶等领域得到了广泛应用[4]。
基于毫米波雷达获取ECG信号,一种思路是先从雷达信号中提取心率和呼吸率。由于雷达在测量心率和呼吸率的过程中存在各种噪声和谐波的干扰,如何获取高精度的心率和呼吸率参数已成为该领域的研究重点[5, 6]。付阳烨[7]提出利用集合经验模式分解(EEMD)算法从雷达信号中提取心率和呼吸率参数,有效避免了呼吸多次谐波对心率的干扰问题;杨路等[8]提出一种改进的高精度反演算法,利用变分模式分解(VMD)对雷达信号进行分解重构,然后通过长短时记忆(LSTM)网络来预测生理体征信号,预测精度优于经验模式分解(EMD)和变分模态分解(VMD)等经典算法;韩丽有等[9]提出一种CNN-BiLSTM模型方法,对心率和呼吸波形进行预测,通过实验对比传统算法,心率和呼吸率预测精度都得到显著提升。另一种思路是直接通过雷达信号来反演ECG信号。Toda等[10]提出利用调频连续波(FMCW)雷达的回波信号,基于卷积神经网络(CNN)模型直接训练来获取ECG信号,实验证明在信噪比较低的情况下,该方法也能较好地重建ECG信号;Chen等[11]利用德州仪器(TI)的毫米波雷达和Transformer模型得到了高精度的ECG信号反演结果,整体平均误差低于0.1 mV,但其模型复杂度较高。
为了提高毫米波雷达ECG信号重建精度,同时兼顾模型轻量化的要求,以满足便携式、睡眠监测和连续ECG测量的需求,本文在目前研究的基础上,提出了一种融合小波变换和注意力(Attention)机制的AM-CNN-GRU神经网络模型ECG预测算法。通过对雷达测量的信号进行脉冲干扰去除和相位差分处理,去除直流干扰,并增强其中的生理体征信号,结合时间对齐后的ECG信号,准备好信号预测数据集。利用小波变换对雷达信号进行分解,挑选出其中与ECG信号相关性最高的分解层信号,并对不同层使用通道注意力机制后,通过CNN-GRU网络模型进行预测,有效提升网络预测精度。
1 方法 1.1 毫米波雷达信号预处理心率和呼吸过程会引起人体胸腔的起伏运动,毫米波雷达通过接收来自胸腔表面的回波信号,分析提取人体生理体征信息。雷达硬件设备通过将发射信号和回波信号进行混频,得到中频信号,并经过模数转换(ADC)模块采样后输出,人体胸腔的位移信号就包含在该中频信号的相位信息中,这部分信号处理操作集成在硬件系统上,因此对雷达信号的预处理主要从ADC模块采样信号开始。
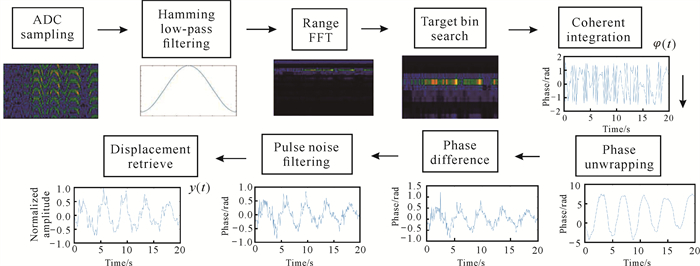
毫米波雷达信号预处理流程如图 1所示。首先利用汉明(Hamming)窗对ADC中频采样信号进行低通滤波,由于人体目标信号反映在相位信息上,需要对距离向(或快时间方向)进行快速傅里叶变换(FFT),目标回波强度和距离均反映在距离频域fR上;其次搜索距离频域,根据信号强度峰值找到人体目标所在的距离单元,人体目标可能占据多个距离单元,为提高生理信号的信噪比,对峰值区域一定距离范围内的单元进行相位相干累加,并采用Arctan解调方法,得到目标距离变化的相位信号φ(t);再次雷达信号的相位值φ被强制缠绕在[-π, π]之间,不能正确反映目标真实的位移变化,使用unwrap函数进行相位解缠绕,从而恢复真实相位变化值;最后为了去除其中的直流影响和基线漂移,对相位信号进行差分处理,并去除其中的脉冲噪声干扰,反演得到人体胸腔的形变信号y(t)。
|
| 图 1 毫米波雷达信号预处理流程 Fig. 1 Signal preprocessing workflow of Millimeter Wave Radar |
1.2 ECG信号反演算法 1.2.1 小波变换
毫米波雷达测量的人体心率和呼吸率等信号,在时间上均表现为非平稳信号,分析其在不同时间的频率特征极为重要,而小波变换具有的多分辨和时频分析能力,能够较好地分析雷达信号的时频局部化特征。小波变换将信号分解成不同尺度的子波分量,其中每个子波分量都包含特定频率范围的信息,基于小波基的相似性度量,对雷达信号中不同的时频特征进行匹配,可以有效去除噪声,提取出生理信号的瞬时变化,从而更好地获取高精度的生理体征信息。蒋滕等[12]和孔维涛等[13]将该方法应用到雷达信号心率提取中,证明了小波变换在雷达生理信号分析中具有较好的效果。
在实际处理中通常采用离散小波变换(DWT)。对雷达离散信号y(n),假定h(n)为小波滤波器函数,g(n)为尺度函数,则第j层第k个小波分解系数如下:
| $ \begin{aligned} & w_{j, k}=\sum\limits_{n=0}^{L_i-1} y(n) h\left(n-2^j k\right), \\ & v_{j, k}=\sum\limits_{n=0}^{L_i-1} y(n) g\left(n-2^j k\right) 。\end{aligned} $ |
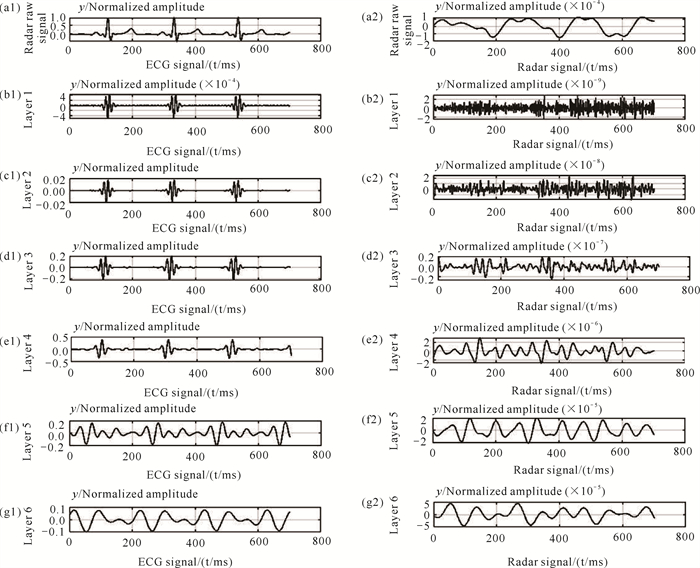
具体而言,将雷达原始信号与小波基函数进行卷积,得到1个低频和1个高频通道,低频通道包含信号的低频特征部分,高频通道包含信号的高频特征部分。然后,对低频通道进行下采样,得到下一个尺度的低频通道,重复上述过程,直到得到所有的尺度。为了详细说明雷达信号小波变换的特点,取一组实际测量雷达信号和对应时间采集的ECG信号,使用6层sym4小波变换进行分解,结果如图 2所示。
|
| 图 2 ECG信号和雷达信号小波分解结果 Fig. 2 Wavelet transform results for ECG and radar signals |
ECG信号和雷达信号计算的相关系数仅为0.253 9,若直接利用LSTM等网络对雷达信号进行ECG预测,难以得到比较好的结果,从图 2(a1)、(a2)可以看到两信号之间差异较大;通过对雷达信号进行小波分解,分解后的各层(层1至层6)信号与ECG信号的相关系数分别为0.002 7、0.109 7、0.312 8、0.419 3、0.318 5、0.694 4。从图 2也可以看到ECG信号与雷达信号的层3、层4、层5、层6之间表现出较明显的相关性,因此相比雷达原始信号,小波分解层信号具有更多与ECG信号相似的细节特征,同时可以去除原信号中高频部分的噪声干扰,如层1[图 2(b2)]和层2[图 2(c2)]。本文将小波分解结果中相关系数较高的多层信号组合,在网络模型中替代雷达原始信号进行训练,可以得到更好的ECG信号预测精度。
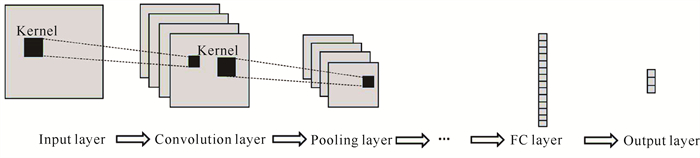
1.2.2 ECG信号反演模型 1.2.2.1 CNN模型CNN是计算机视觉中最常用的模型,具有局部连接、权值共享和多层次特征提取等特点。利用大量带标签的数据集,CNN模型可以自动提取数据特征信息,在图像和信号处理中得到了大范围应用。如图 3所示,CNN网络主要包含卷积层、池化层、全连接层等结构,多个卷积层和池化层用来提取输入数据的局部特征,最后通过全连接层进行分类或回归预测。
|
| 图 3 CNN网络结构 Fig. 3 Architecture of CNN network |
卷积层是CNN模型的核心部分,用于提取各种数据特征。卷积层是通过图像上的卷积核(滑动窗口)来实现特征提取的,在具体的卷积操作中,卷积核会与图像中的每个像素进行元素相乘并累加,得到一个新的像素值,这个过程会在图像的每个位置进行重复,最终得到一个新的特征图。卷积层计算公式如下:
| $ C_i^j=\sigma\left(\sum\limits_{k=1}^l w_{i k}^{j-1} \cdot x_i^{j-1}+b_i^j\right), $ |
式中,Cij表示第j层第i个卷积的计算结果,σ为激活函数,l表示j-1层的神经元数量,w和b分别表示卷积核权重和偏置,x为输入数据。
池化层用于减少特征图的大小,同时保留关键特征,一般放在卷积层之后,以减少计算量和防止过拟合问题。池化操作可以选择最大化池化和平均值池化,取决于在特征图中选择最大值或是平均值。全连接层用于将提取的特征映射到输出空间,实现最后的分类任务,其结构中每个神经元都会与前一层的所有神经元连接,但为了减少模型参数,可以在其后添加Dropout层,在数据训练过程中丢弃不必要的网络连接。
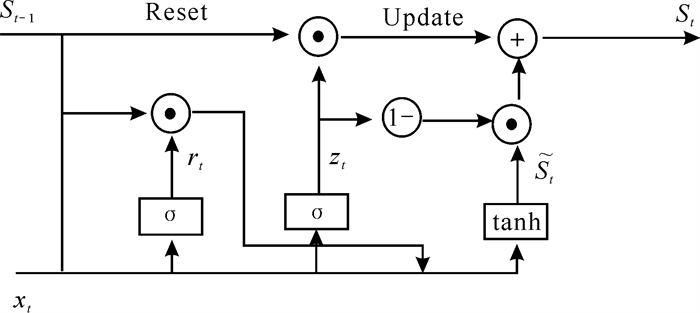
1.2.2.2 门控循环单元(GRU)网络GRU是一种比较简单高效的门控循环神经网络(RNN),与LSTM网络类似,都用于处理时间序列数据,但其结构更加简单,需要训练模型参数少,比LSTM网络具有更高的计算效率。GRU网络主要由更新门和重置门两个门控单元组成,并包含一个候选隐藏状态,其网络结构如图 4所示。更新门单元用于控制前一时刻的状态信息传递到当前状态的程度,重置门单元用于控制前一时刻状态信息被遗忘的程度。其计算公式如下:
| $ \begin{aligned} & z_t=\sigma\left(\boldsymbol{W}_z x_t+\boldsymbol{U}_z S_{t-1}\right), \\ & r_t=\sigma\left(\boldsymbol{W}_r x_t+\boldsymbol{U}_r S_{t-1}\right), \\ & \tilde{S}_t=\tanh \left(\boldsymbol{W}_s x_t+\boldsymbol{U}_s\left(r_t \otimes S_{t-1}\right)\right), \\ & S_t=z_t \otimes S_{t-1}+\left(1-z_t\right) \otimes \tilde{S}_t, \end{aligned} $ |
|
| 图 4 GRU网络结构 Fig. 4 Architecture of GRU network |
式中,zt为更新门,rt为重置门,
注意力机制是为了将模型聚焦于输入数据中重要部分的技术,在对时间序列数据处理过程中,模型并不只是关注当前的输入,还需要根据输入数据对之前的数据进行关注,从而更好地获取关键特征信息。注意力机制本质上是一种参数加权的方法,通过给数据各部分分配不同的权重,权重越高,表示模型越关注该部分的数据,使得模型在训练过程能够重点突出关键信息,从而提高模型的性能。其计算公式如下:
| $ \text { Attention }=\operatorname{Sof} \operatorname{tmax}\left(Q \times K^{\mathrm{T}}\right) \times \text { Value }, $ | (5) |
其中,注意力操作首先计算查询向量Q和键向量K的相似度,得到不同Value值的权重系数,然后利用Softmax对相似度(权重)进行归一化,最后根据权重对输入数据进行加权求和。
1.2.2.4 AM-CNN-GRU模型如前文所述,CNN和GRU网络可以较好地应用于生理体征信号分析。其中,CNN网络可以获取局部特征,对位移等变化不敏感,可以使用多个卷积层和池化层网络提取雷达信号中与ECG信号最相关的高维特征;而GRU网络擅长时间序列特征分析,使用多个GRU网络,捕捉时序信号的长期依赖关系,从而进行ECG信号的重建反演;此外,对输入信号采用小波变换处理,使用6层sym4小波分解结果中的3-6层信号,构成4通道数据输入到网络中,同时为了更好利用小波分析结果,使用通道注意力机制将各层小波分解信号进行融合。因此,本文设计的AM-CNN-GRU模型的网络结构如图 5所示。
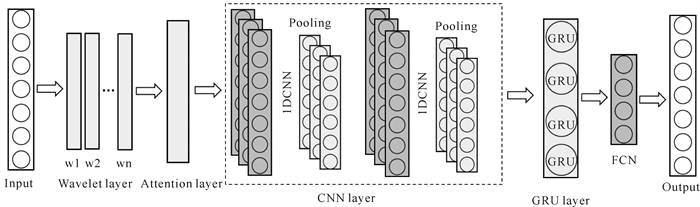
|
| 图 5 AM-CNN-GRU模型的网络结构 Fig. 5 Network architecture of AM-CNN-GRU model |
雷达测量信号首先使用小波分解,经过通道注意力模块后进入到CNN中,使用两层卷积层和池化层对雷达信号进行特征提取,卷积层采用1维卷积操作,利用不同的卷积核抽取得到相应的特征信号,池化层对特征信号进行压缩降采样,为了避免模型训练出现过拟合,两个卷积层操作后都有一个Dropout层,以一定概率丢弃部分网络。雷达时序信号经过CNN提取完高维特征后,特征图构成的时序信号随后进入后端的GRU网络中,以学习特征的时序信息,通过综合信号的长期和短期特征,进行ECG信号时间序列预测,最后输出状态进入到两个全连接层中进行分类,第一个全连接层后也同样加入了Dropout层,以提升网络的泛化性能。通过结合小波域特征、CNN网络和GRU网络特征提取结果,有效提高了ECG信号反演的准确度和鲁棒性。
AM-CNN-GRU网络的详细参数如表 1所示。其中注意力模块通道数与输入的小波信号一致;CNN卷积模块包含两个卷积层,卷积核大小分别为{32×1, 16×1},步长分别为8和4,通道数均为8,选择tanh函数作为激活函数,卷积层后的Dropout层丢弃概率设为0.2;GRU单元隐含层大小为8;两个FCN (Fully Convolutional Networks)全连接层大小分别为{4×8,1×4},第一个FCN全连接层层后的Dropout层丢弃概率为0.2。
| 网络层 Layer |
内核 Kernel |
步长 Stride |
通道 Channel |
参数数量 Parameter |
| Attention layer | 7 | - | 4 | 28 |
| Conv_1d convolutional layer 1 | 32 | 8 | 8 | 1 048 |
| Maxpooling layer 1 | 2 | 1 | 8 | - |
| Dropout layer 1 | - | - | 8 | - |
| Conv_1d convolutional layer 2 | 16 | 4 | 8 | 1 048 |
| Maxpooling layer 2 | 2 | 1 | 8 | - |
| Dropout layer 2 | - | - | 8 | - |
| GRU layer | 8 | - | - | 240 |
| FC layer 1 | - | - | 4 | 36 |
| Dropout layer 3 | - | - | 4 | - |
| FC layer 2 | - | - | 1 | 4 |
2 验证实验 2.1 模型训练 2.1.1 参数设置
模型训练过程中,损失函数采用的是预测信号与真实ECG信号之间的均方误差(Mean Square Error,MSE),模型使用反向传播算法计算梯度,使用Adam优化器来更新优化模型参数,学习率初始值设置为0.001,训练轮数(Epoch)为500。
2.1.2 误差评价指标为了验证和对比模型预测精度,本文选取3个误差评价指标,均方根误差(RMSE)、平均绝对误差(MAE)和最大绝对误差(MAX)。值越小,表示模型预测精度越高。计算公式如下:
| $ \begin{aligned} & \text { RMSE }=\sqrt{\frac{1}{N} \sum\limits_{i=1}^N\left(y_i-\tilde{y}_i\right)^2}, \\ & \text { MAE }=\frac{1}{N} \sum\limits_{i=1}^N\left|y_i-\tilde{y}_i\right|, \\ & \text { MAX }=\max _{i=1}^N\left(\left|y_i-\tilde{y}_i\right|\right), \end{aligned} $ |
式中,N表示预测值的总数,yi表示模型预测的ECG信号值,
本文使用Schellenberger等[14]提供的开源雷达数据集。该数据使用24 GHz毫米波雷达和心电图等设备同步采集,对11个被试人员在不同场景下(正常状态、屏气状态、运动后)的生理信号进行记录,总的数据采集时间超过200 min,不同设备测量数据都经过了时间同步校正。从这些测量数据中以长度1 024随机抽取1 000段的雷达信号和ECG信号,其中选择70%作为训练集,15%作为测试集,剩下15%作为验证集。将AM-CNN-GRU模型在该数据集上进行训练,在训练过程中得到模型在训练集和测试集上的损失值变化如图 6所示。训练集上的损失值随迭代次数增加不断下降,并最终保持在一个较低水平,测试集上的损失值变化和训练集基本一致,趋于较低水平,证明AM-CNN-GRU模型在经过大量数据训练后,没有出现过拟合现象,并且对ECG信号预测误差不断下降,具有较好的泛化性能。
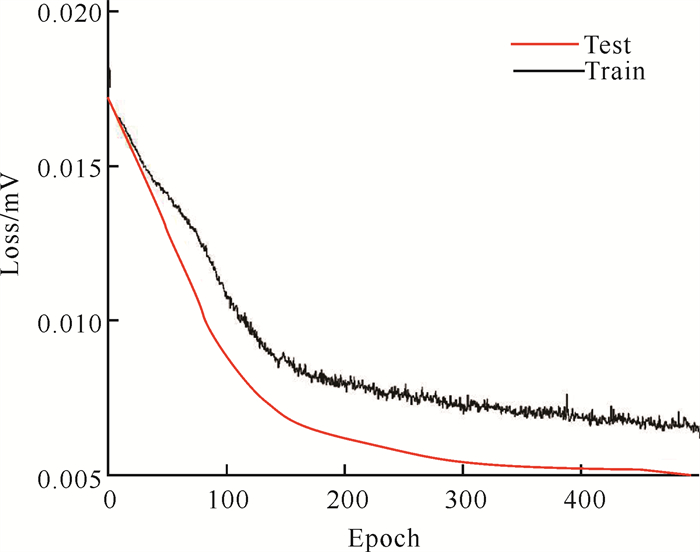
|
| 图 6 AM-CNN-GRU模型损失值 Fig. 6 Loss values of AM-CNN-GRU model |
为进一步对比验证本文模型的预测性能,将本文AM-CNN-GRU模型与LSTM[15]、CNN-LSTM[16]、CNN-BiLSTM[9]、WT-CNN-BiLSTM[17]模型在同一数据集上进行训练,模型训练参数均保持一致,保留500次迭代后的最优模型参数,对测试集结果进行预测,从而对比不同模型的准确性和稳定性。取3种不同状态下1组测试数据的预测结果,得到反演的ECG信号预测结果如图 7所示。LSTM模型ECG信号预测结果最差;CNN-LSTM和CNN-BiLSTM模型预测结果类似,但与真实ECG信号仍存在较大差距;而利用了小波分解的WT-CNN-BiLSTM模型,其预测结果基本接近于实际值;AM-CNN-GRU模型预测结果最好。另外,从不同场景对比结果可看到,运动后状态下各模型预测结果都比较差,拉低了整体的ECG信号预测精度,后续还需进一步优化模型。
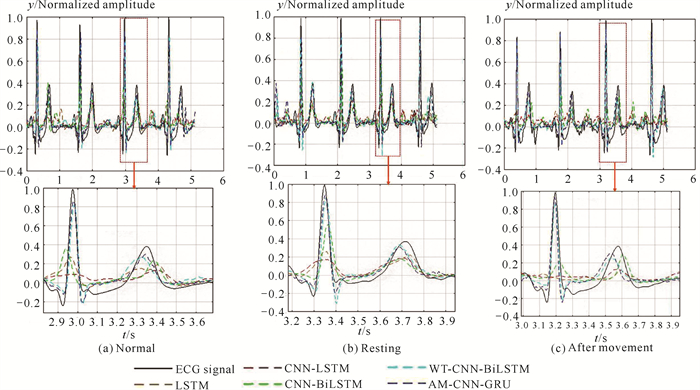
|
| 图 7 不同模型ECG信号预测结果 Fig. 7 EEG signal prediction results of different models |
为量化模型对比结果,使用RMSE、MAE和MAX 3个误差评价指标得到不同网络的预测结果,如表 2所示。AM-CNN-GRU模型在预测精度指标方面明显优于其他4种模型,RMSE仅为0.094 7 mV,同时模型训练时间也没有显著增加,证明了AM-CNN-GRU模型以较轻量化的网络结构,实现了最好的ECG信号预测性能。
| 模型 Model |
均方根误差/mV RMSE/mV |
平均绝对误差/mV MAE/mV |
最大绝对误差/mV MAX/mV |
训练时间/s Training time/s |
| LSTM | 0.193 3 | 0.160 6 | 0.683 3 | 191 |
| CNN-LSTM | 0.188 7 | 0.071 3 | 0.394 0 | 343 |
| CNN-BiLSTM | 0.180 4 | 0.069 8 | 0.365 2 | 347 |
| WT-CNN-BiLSTM | 0.113 2 | 0.064 9 | 0.321 0 | 433 |
| AM-CNN-GRU | 0.094 7 | 0.060 6 | 0.309 6 | 518 |
此外,从模型反演心率信号中,可看到P波、QRS波和T波等时间序列特征,也能与原始ECG信号较好地对应。下面对这3种特征波的反演精度[波形RMSE(mV)/波峰时间点平均误差(ms)]进行评估。利用特征提取算法从参考ECG信号中自动获取3种特征波的波峰位置,同时检查并手动补偿漏检的波峰位置,然后取出参考信号和雷达反演信号在P波、QRS波和T波对应时间位置的时间序列数据,对不同网络计算特征波估计误差。从表 3可以看出,本文提出的AM-CNN-GRU模型对特征波预测精度最高,其次是WT-CNN-BiLSTM模型。这两个模型的QRS波由于波形特征最为明显,其波形RMSE和波峰时间点平均误差都是最低的,而P波和T波反演精度相对较差,后续将进一步优化模型,提升对P波和T波的反演效果。另外,其他3种模型由于对ECG信号预测结果与真实值差异较大,对特征波反演效果也较差,其中QRS波信号峰值较大,相比P波和T波预测误差最大。
| 模型 Model |
精度/(mV/ms) Precision/(mV/ms) |
||
| P波 P waves |
QRS波 QRS waves |
T波 T waves |
|
| LSTM | 0.181 3/46.3 | 0.204 4/38.0 | 0.186 9/48.2 |
| CNN-LSTM | 0.179 3/43.4 | 0.195 7/32.9 | 0.182 0/44.6 |
| CNN-BiLSTM | 0.177 2/37.0 | 0.181 5/25.2 | 0.174 5/39.4 |
| WT-CNN-BiLSTM | 0.128 4/21.7 | 0.102 5/8.3 | 0.120 3/24.0 |
| AM-CNN-GRU | 0.115 7/21.5 | 0.091 2/8.8 | 0.100 6/23.6 |
2.3 消融实验分析
为了说明网络各部分模块对ECG信号预测性能的影响,对AM-CNN-GRU模型进行消融实验分析,从模型中分别移除一部分结构,在相同数据集上进行测试,ECG信号的预测结果如表 4所示。仅使用CNN-GRU网络对ECG信号反演结果误差较大,与CNN-BiLSTM模型反演效果相当;将输入层加入小波分解方法后,网络反演RCG信号精度得到了最大提升,RMSE由0.19 mV降低到0.12 mV量级;再加入注意力机制后,反演RCG信号精度也有部分提升,RMSE由0.12 mV下降到0.09 mV量级。该结果证明了使用小波分解方法可以将时频特征与时域特征进行有效融合,从而显著提升ECG信号反演结果,而注意力机制叠加到小波分解层后,通过利用权重对不同时频特征分量进行关注,对ECG信号反演效果也能得到提高。
| 结构 Block |
预测精度/mV Prediction precision/mV |
||
| 均方根误差 RMSE |
平均绝对误差 MAE |
最大绝对误差 MAX |
|
| CNN-GRU | 0.189 0 | 0.075 5 | 0.389 1 |
| WT | 0.115 8 | 0.067 5 | 0.323 3 |
| WT-AM | 0.094 7 | 0.060 6 | 0.309 6 |
3 结论
本文针对毫米波雷达ECG信号反演问题,提出了利用注意力机制融合小波分解信号的AM-CNN-GRU模型,对雷达信号小波分解中与ECG信号最相关的分解层,采用通道注意力机制模型对其赋予注意力权重,并在后端对CNN-LSTM模型进行轻量化改造,提出了包含两层卷积和多个Dropout层的CNN-GRU模型,提升网络的数据泛化性能。该模型无需对输入数据采用更多复杂的预处理,利用CNN和GRU网络自动提取多维特征信息,提高了模型预测精度。通过在开源雷达数据集上的实验验证,表明本文的模型相比现有的方法具有更高的ECG信号预测性能,总体RMSE低于0.1 mV。同时,目前模型对于运动后状态的信号预测效果较差,后续还需要利用更多的数据集进一步优化模型,提升网络的适用性。
| [1] |
吕婷婷, 丁子建, 袁亦方, 等. 深度学习在心电图自动诊断和预测心血管疾病中的应用[J]. 中国心血管杂志, 2021, 26(3): 290-293. DOI:10.3969/j.issn.1007-5410.2021.03.018 |
| [2] |
KATHURIA N, SEET B C. 24 GHz flexible antenna for Doppler radar-based human vital signs monitoring[J]. Sensors, 2021, 21(11): 3737. DOI:10.3390/s21113737 |
| [3] |
GÄNZLE T, KLÖCK C, HEUSCHKEL K. Real-time vital sign detection using a 77 GHz FMCW radar[C]//2022 IEEE-EMBS Conference on Biomedical Engineering and Sciences (IECBES). Piscataway, NJ: IEEE, 2022: 148-153.
|
| [4] |
SOUMYA A, KRISHNA M C, CENKERAMADDI L R. Recent advances in mmWave-radar-based sensing, its applications, and machine learning techniques: a review[J]. Sensors, 2023, 23(21): 8901. DOI:10.3390/s23218901 |
| [5] |
PATERNIANI G, SGRECCIA D, DAVOLI A, et al. Radar-based monitoring of vital signs: a tutorial overview[J]. Proceedings of the IEEE, 2023, 111(3): 277-317. DOI:10.1109/JPROC.2023.3244362 |
| [6] |
WANG W J, WANG X Y. Contactless vital signs monitoring[M]. Amsterdam: Elsevier, 2022: 181-203.
|
| [7] |
付阳烨. 基于毫米波雷达的生命体征检测与身份认证算法研究[D]. 南京: 南京邮电大学, 2023.
|
| [8] |
杨路, 雷雨霄, 余翔. 基于FMCW雷达的人体生命体征信号预测算法[J]. 雷达科学与技术, 2024, 22(1): 43-56. |
| [9] |
韩丽有, 谭钦红, 刘家森. 基于CNN-BiLSTM的FMCW雷达生命体征信号检测[J]. 激光杂志, 2024, 45(3): 68-73. |
| [10] |
TODA D, REN A, ICHIGE K, et al. ECG signal reconstruction using FMCW radar and convolutional neural network[C]//2021 20th International Symposium on Communications and Information Technologies (ISCIT). Piscataway, NJ: IEEE, 2021: 176-181.
|
| [11] |
CHEN J, ZHANG D, WU Z, et al. Contactless electrocardiogram monitoring with millimeter wave radar[J]. IEEE Transactions on Mobile Computing, 2024, 23(1): 270-285. DOI:10.1109/TMC.2022.3214721 |
| [12] |
蒋腾, 胡涛, 祝民鹏, 等. 基于连续小波变换的多数据心率提取方法[J]. 现代雷达, 2019, 41(5): 22-26. |
| [13] |
孔维涛, 欧阳锋, 张顺生, 等. 基于DWT及Hampel滤波的心率检测方法[J/OL]. 现代雷达, 2023: 1-13[2024-07-09]. http://kns.cnki.net/kcms/detail/32.1353.TN.20231225.1038.002.html.
|
| [14] |
SCHELLENBERGER S, SHI K, STEIGLEDER T., et al. A dataset of clinically recorded radar vital signs with synchronised reference sensor signals[J]. Scientific Data, 2020, 7(1): 291. DOI:10.1038/s41597-020-00629-5 |
| [15] |
李洪飞. 基于深度学习的毫米波雷达非接触心率检测技术研究[D]. 烟台: 烟台大学, 2024.
|
| [16] |
刘梓隆, 林志伟, 张利, 等. 基于呼吸心跳时序混叠信号的毫米波雷达身份识别[J]. 闽南师范大学学报(自然科学版), 2023, 36(3): 107-115. |
| [17] |
CHMURSKI M, ZUBERT M. Novel radar-based gesture recognition system using optimized CNN-LSTM deep neural network for low-power microcomputer platform[C]//Proceedings of the 13th International Conference on Agents and Artificial Intelligence. Setúbal, Portugal: Scitepress, 2021: 882-890.
|



