【研究意义】近年来随着水产养殖业的快速发展, 水产养殖动物病害问题也日益突出, 其中细菌性疾病已在世界范围内对渔业经济造成巨大的损失[1-3]。弧菌是一大群菌体短小、极生鞭毛、能运动、无芽胞的短杆状弯曲成弧形的革兰氏阴性菌, 隶属于弧菌科弧菌属[4]。弧菌广泛分布于自然界, 以水体中分布居多。大量研究表明, 多种弧菌可引起海水养殖鱼类、贝类及甲壳类等经济动物的流行性和暴发性死亡, 主要包括副溶血弧菌、灿烂弧菌、鳗弧菌、溶藻弧菌、哈维氏弧菌等。弧菌病给水产养殖业造成巨大经济损失, 并且该病还会导致野生海水鱼类、贝类及甲壳类的死亡, 进而威胁海洋自然生物资源[5-8]。因此, 对该疾病的预防与控制研究一直备受国内外研究人员的关注, 是海水养殖动物病害的主要研究领域之一。目前, 在水产养殖生产过程中, 抗生素的使用仍是解决水产养殖动物弧菌病的重要手段, 它能在短期内起到良好的治疗效果, 极大地降低养殖业的经济损失, 但由于抗生素在疾病防治上的广泛和长期使用, 耐药性弧菌的种类及数量不断攀升[9-11]。近年来, 抗药性弧菌菌株不断地被分离出来, 在这种情况下如果无选择地盲目使用抗生素, 不但得不到理想的治疗效果, 反而会使得菌株的耐药性进一步加剧, 从而给水产养殖业甚至人类生命健康安全带来更为严重的危害[12]。因此, 为有针对性地使用抗生素药物以达到理想的治疗效果, 对病原微生物开展抗生素敏感试验, 以获知菌株的耐药特性, 对于指导临床科学、合理、准确用药, 避免疾病的暴发流行及微生物耐药性加剧起着关键性的作用。【前人研究进展】目前, 在水产细菌病防治领域, 药敏检测方法主要采用K-B纸片法与肉汤稀释法, 其中K-B纸片法一般须由具备专业知识的人员在实验室条件下操作完成, 步骤繁琐且无法获得药物的最小抑菌浓度(MIC)值[13]。常规的肉汤稀释法虽然可以测定药物的MIC值, 但是实验周期长, 对结果判读不够直观[14]。因此, 以上两种方法都不适合在水产养殖生产中推广应用。【本研究切入点】以阿尔玛蓝染料作为颜色指示剂, 以海藻糖为包被保护剂, 制备获得弧菌快速药敏检测微孔板, 在对检测各项参数优选的基础上, 通过观测药敏检测微孔板内测试孔的颜色差异变化, 实现对药物MIC值的直观判定。【拟解决的关键问题】研究结果将为水产病原微生物的现场快速选药技术提供重要参考。
1 材料与方法 1.1 材料 1.1.1 菌株副溶血弧菌菌株VP-3(大菱鲆致病菌)、溶藻弧菌菌株VA-1(牙鲆致病菌)及灿烂弧菌菌株VS-1(刺参致病菌)由本实验室分离保存。
1.1.2 试剂和耗材培养基购自北京陆桥技术有限责任公司和上海生工生物工程公司, 抗生素(USP级)购自上海源叶生物科技有限公司, 阿尔玛蓝和96孔细胞培养板购自美国Thermo Fisher公司。
1.2 方法 1.2.1 增菌液筛选为实现弧菌快速生长以缩短药敏检测过程, 在Mueller-Hinton(MH)培养基配方的基础上, 对其进行改良以制成增菌液, 改良配方为MH0(牛肉浸粉6 g、可溶性淀粉1.5 g、酪蛋白水解物17.5 g、NaCl 15 g、2.8 mg CaCl2、4 mg MgCl2、蒸馏水1 L)、MH1(在配方MH0的基础上加上10%鱼汤)和MH2(在配方MH0的基础上加上10 g鱼肉蛋白胨)。为测定不同增菌液配方对副溶血弧菌菌株VP-3、溶藻弧菌菌株VA-1及灿烂弧菌菌株VS-1的增殖效果, 分别吸取1 mL过夜培养的3种菌液转入100 mL MH0、MH1和MH2中, 混合均匀后, 置于28℃摇床180 r/min振荡培养, 每隔2 h取样一次, 于600 nm波长下测定OD值, 以培养基作为空白对照, 绘制不同细菌在不同培养基中的生长曲线。
1.2.2 常用抗菌药物的配制依据水产常用药物种类和禁用药物目录, 确定检测药物的种类为氨苄青霉素、氟苯尼考、链霉素、阿米卡星、四环素、土霉素、强力霉素、多粘菌素B、沙拉沙星、恩诺沙星、利福平, 共11种。根据不同药物的特性分别采用不同的溶剂准确配制成浓度为5.12 mg/mL、3.2 mg/mL、6.4 mg/mL、10.24 mg/mL、1.6 mg/mL、1.6 mg/mL、1.6 mg/mL、2.56 mg/mL、6.4 mg/mL、6.4 mg/mL、6.4 mg/mL的抗菌药物储液, 其中氨苄青霉素、硫酸链霉素、阿米卡星、盐酸土霉素、盐酸强力霉素、盐酸四环素、多粘菌素B用超纯水配制; 氟苯尼考、利福平用甲醇溶解, 超纯水稀释配制; 沙拉沙星和恩诺沙星用0.1 mol/L的NaOH溶解, 超纯水稀释配制。配制好的药物储液经0.22 μm滤膜过滤后, 置于-20℃保存。
1.2.3 药敏检测微孔板的制备水产弧菌药敏检测板选用96孔无菌微孔板, 共有8行(A-H)12列(1-12), 根据用途不同分为3个区域:药敏检测区(A1:H11)、生长指示区(A12:D12)、质控区(E12:H12), 其中药敏检测区每一列微孔底部包被有不同种类浓度呈倍比稀释的抗菌药物(图 1)。具体制备方法如下:将1.2.2节所述配制好的药物10倍稀释; 用超纯水配置1 mg/mL的海藻糖, 用0.22 μm滤膜过滤; 将配制好的海藻糖溶液分别与以上不同浓度的药物1︰1混合, 然后分别取不同浓度的药物混合液20 μL与10 μL阿尔玛蓝混合均匀, 对应地加入检测板的检测区内(A1:H11), 作为包被含有药物和显色指示剂的检测孔; 在生长对照区(A12:D12)及质控区(E12:H12)内加入以无菌超纯水与海藻糖溶液1︰1混合液20 μL和10 μL阿尔玛蓝; 将微孔板置于无菌超净台内室温阴干, 最终获得药敏检测微孔板, 4℃保存备用。
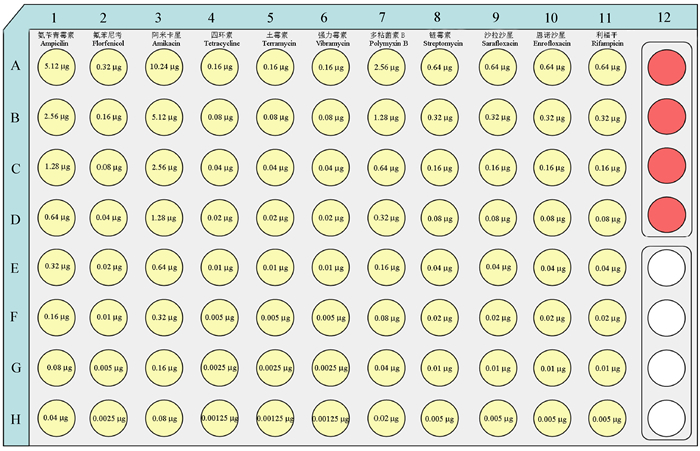
|
图 1 药敏检测微孔板内药物种类及包被量示意图 Fig.1 Schematic diagram of the antibiotic sensitivity testing plate with different antibiotic species and contents |
从固体培养基平板上分别挑取副溶血弧菌菌株VP-3、溶藻弧菌菌株VA-1及灿烂弧菌菌株VS-1单菌落, 将其接种于增菌液MH2培养基中, 置于28℃培养箱中震荡培养(转速120 r/min)至肉眼可见浑浊; 将增菌液用检测培养液MH0调整浓度至0.5麦氏比浊标准, 再稀释1 500倍, 使菌体浓度达到1×105CFU/mL; 将稀释好的菌液分别加入微孔检测板的药敏检测区及生长对照区, 每孔100 μL, 质控区内的每孔加入100 μL检测培养液, 然后置于28℃培养箱中静置避光培养6~10 h, 取出药敏检测微孔板肉眼观察记录各微孔内的颜色变化情况。
1.2.5 结果判定根据药敏检测微孔板内的颜色变化情况对药敏结果进行判读, 判读标准如下:
a.若质控区颜色呈蓝色, 则试验有效, 可以继续进行判读; 若呈粉红色, 则试验无效, 需重新进行检测。
b.若生长指示区呈粉色, 则可以继续进行MIC判读; 若生长指示区呈蓝色则需将检测板置于28℃培养箱内继续培养, 至颜色变为粉红色后, 再进行MIC判读。
c.若质控区呈蓝色, 生长指示区由蓝色变为粉色时, 则判读各列不同药物对菌体的MIC, 其中每列中与粉色微孔相邻的蓝色(或蓝紫色)孔所对应的药敏包被浓度即为该药物对待测弧菌的MIC。
1.2.6 利用常规试管稀释法测定3种弧菌的药物敏感性在无菌透明试管中分别接种1 mL浓度为1×105 CFU/mL的3种弧菌菌液, 分别在每个试管中加入以上11种8个浓度梯度的抗菌药物, 终浓度与微孔板检测法相同, 每个药物浓度处理设置3个重复, 置于28℃培养箱中静置培养, 肉眼观察至试管出现明显浊度, 且浊度不再变化, 记录结果, 以肉眼观察未出现浑浊现象的试管对应的最小药物浓度为MIC。
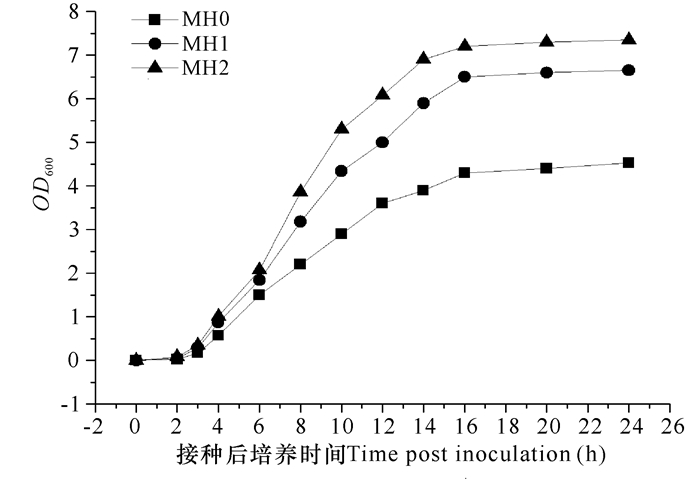
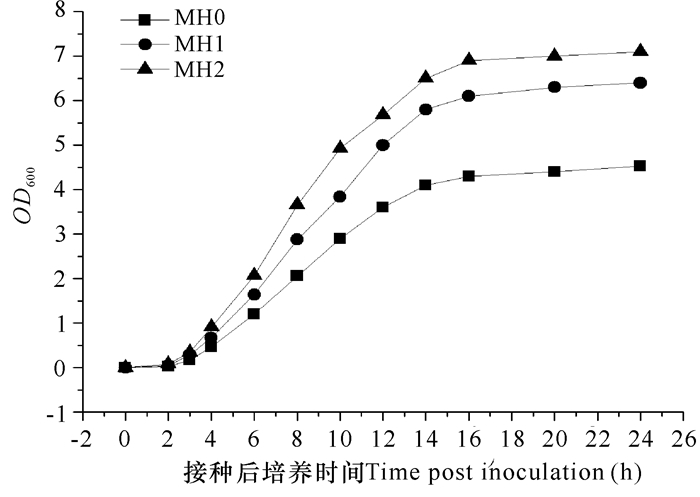
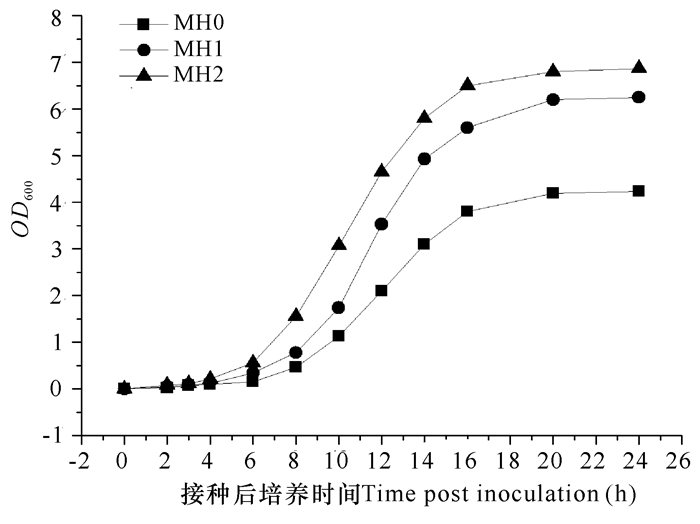
2 结果与分析 2.1 不同增菌液对3种弧菌增殖效果的影响通过副溶血弧菌菌株VP-3、溶藻弧菌菌株VA-1及灿烂弧菌菌株VS-1在增菌液MH0、MH1和MH2内的生长曲线情况(图 2~4), 可以看出改良后的MH1和MH2增菌效果均优于MH0, 不仅能够缩短3种菌株的生长延滞期, 使细菌在8 h内进入指数生长期, 且最终生物量也显著高于MH0。由于鱼肉蛋白胨获取方便, 因此将MH2作为药敏快速检测方法的增菌培养基; 为避免添加鱼肉蛋白胨对药敏检测结果的干扰, 以MH0作为药敏检测培养基。
|
图 2 不同培养基条件下副溶血弧菌菌株VP-3的生长曲线 Fig.2 The growth curves of V.parahemolyticus strain VP-3 in three different culture media |
|
图 3 不同培养基条件下溶藻弧菌菌株VA-1的生长曲线 Fig.3 The growth curves of V.alginolyticus strain VA-1 in three different culture media |
|
图 4 不同培养基条件下灿烂弧菌菌株VS -1的生长曲线 Fig.4 The growth curves of V.splendidus strain VS -1 in three different culture media |
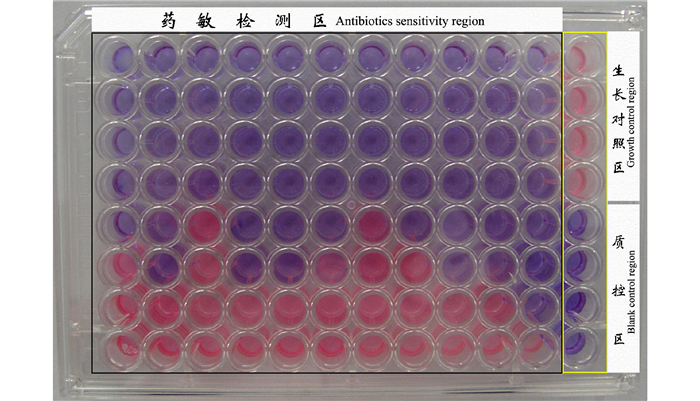
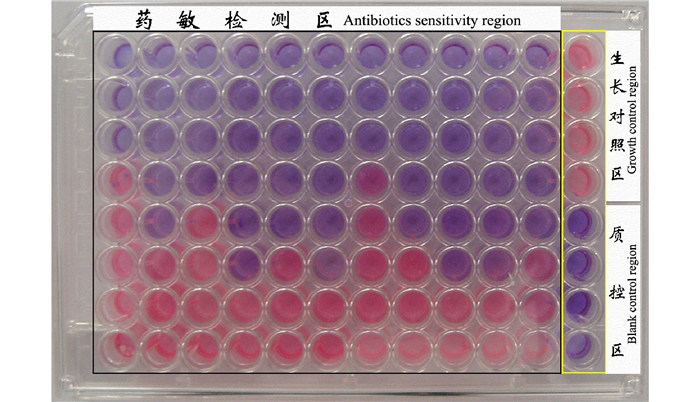
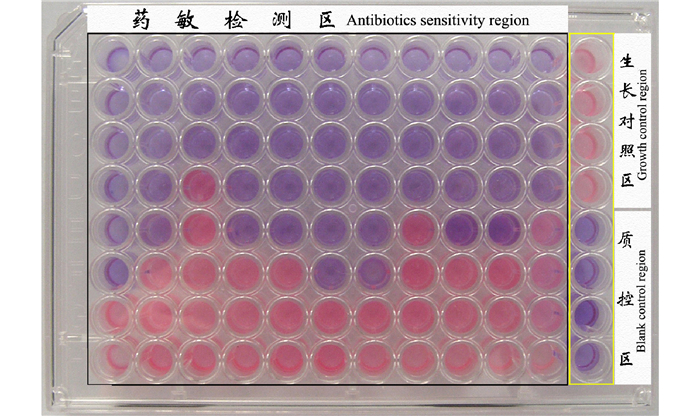
利用包被显色指示剂的药敏微孔板检测发现, 培养一定时间后(副溶血弧菌菌株VP-3为6 h、溶藻弧菌菌株VA-1为6 h, 灿烂弧菌菌株VS-1为8 h)生长对照区孔内颜色变粉色, 药敏检测区孔内颜色各不相同, 反映不同药物不同浓度对3种弧菌生长的抑制作用不同(图 5~7)。以每列中与粉色微孔相邻的蓝色(或蓝紫色)孔所对应的药敏包被浓度即为MIC, 结果显示, 氨苄青霉素、氟苯尼考、阿米卡星、四环素、土霉素、强力霉素、多粘菌素B、链霉素、沙拉沙星、恩诺沙星、利福平对副溶血弧菌的MIC分别为3.2 μg/ml、0.1 μg/mL、12.8 μg/mL、0.05 μg/mL、0.05 μg/mL、0.1 μg/mL、3.2 μg/mL、0.4 μg/mL、0.2 μg/mL、0.2 μg/mL、0.1 μg/mL; 对溶藻弧菌的MIC分别为12.8 μg/mL、0.2 μg/mL、12.8 μg/mL、0.05 μg/mL、0.1 μg/mL、0.05 μg/mL、6.4 μg/mL、0.4 μg/mL、0.2 μg/mL、0.2 μg/mL、0.4 μg/mL; 对灿烂弧菌的MIC分别为1.6 μg/mL、0.2 μg/mL、25.6 μg/mL、0.1 μg/mL、0.1 μg/mL、0.05 μg/mL、0.8 μg/mL、0.8 μg/mL、0.4 μg/mL、0.4 μg/mL、0.8 μg/mL。
|
图 5 利用阿尔玛蓝为指示剂的快速药敏检测法对副溶血弧菌菌株VP-3的药敏检测结果 Fig.5 The result of antibiotic sensitivity of V.parahemolyticus strain VP-3 by rapid AST method using Alamar Blue as color indicator |
|
图 6 利用阿尔玛蓝为指示剂的快速药敏检测法对溶藻弧菌菌株VA-1的药敏检测结果 Fig.6 The result of antibiotic sensitivity of V.alginolyticus strain VA-1 by rapid AST method using Alamar Blue as color indicator |
|
图 7 利用阿尔玛蓝为指示剂的快速药敏检测法对灿烂弧菌菌株VS -1的药敏检测结果 Fig.7 The result of antibiotic sensitivity of V.splendidus strain VS -1 by rapid AST method using Alamar Blue as color indicator |
通过观察试管稀释法测定MIC的结果显示, 各试管的浊度需要在28℃培养24 h后才能趋于稳定, 具体记录结果如表 1~3所示(药物浓度设置与图 1所示一致), 以肉眼无法观察到明显浑浊试管中药物的最低浓度为MIC, 结果发现试管法所测定的检测结果与显色法检测结果完全吻合。
| 表 1 试管稀释法测定11种药物梯度稀释浓度对副溶血弧菌菌株VP-3的生长影响 Table 1 The antibiotic sensitivity of V.parahemolyticus strain VP-3 against 11 different antibiotics by tube dilution method |
| 表 2 试管稀释法测定11种药物梯度稀释浓度对溶藻弧菌菌株VA-1的生长影响 Table 2 The antibiotic sensitivity of V.alginolyticus strain VA-1 against 11 different antibiotics by tube dilution method |
| 表 3 试管稀释法测定11种药物梯度稀释浓度对灿烂弧菌菌株VS -1的生长影响 Table 3 The antibiotic sensitivity of V.splendidus strain VS -1 against 11 different antibiotics by tube dilution method |
通过在养殖现场对分离的致病菌进行快速药敏检测, 可及时准确指导药物使用, 对疾病的防控具有重要的现实意义。传统的纸片扩散法(K-B法, 定性测定)及稀释法(肉汤和琼脂, 定量测定)测定方法步骤繁琐、所需时间长, 检测人员需掌握相应的微生物学操作技术。而目前法国梅里埃ATB Expression及美国Biolog Vitek系列等自动细菌鉴定/药敏分析仪虽能够实现快速细菌鉴定及药敏分析的目的, 但是仪器及相关试剂价格昂贵, 且需要专业人员操作使用, 仅限于实验室使用, 难以在养殖一线推广应用。为实现养殖现场的快速药敏检测, 本研究以阿尔玛蓝染料作为颜色指示剂, 以海藻糖为包被保护剂, 制备弧菌快速药敏检测微孔板, 操作方法简便、能够在8 h以内通过观测药敏检测微孔板内测试孔的颜色差异变化, 实现对药物MIC值的直观判定, 且对3种弧菌药敏检测结果与试管稀释法保持一致, 说明本研究的快速药敏检测方法切实可行。
3.2 药敏快速检测培养基的选择Mueller-Hinton(MH)培养基是美国国家临床实验室标准委员会采用的需氧菌及兼性厌氧菌药敏试验标准培养基, 其营养成分好, 绝大多数致病菌在MH培养基中生长良好, 且对各种抗生素的抑制成分含量低, 用于药物敏感试验重复性比其他培养基好, 因此将MH肉汤培养基作为药敏检测基础培养基[15]。为实现细菌快速生长以缩短药敏检测过程, 依据海水致病菌的生长需求, 以MH培养基配方为基础, 对其进行改良。通过实验发现改良后的MH1和MH2增菌效果均优于MH0。由于鱼肉蛋白胨有商品化的产品获得比较容易, 因此将MH2作为药敏快速检测方法的增菌培养基; 同时, 为避免添加鱼肉蛋白胨对药敏检测结果的干扰, 仍以MH0作为药敏检测基础培养基。
3.3 药敏检测指示剂的选择为实现对药敏结果的直观判读, 本研究选用阿尔玛蓝作为氧化/还原指示染料, 该染料对细胞安全、无毒, 广泛应用于细胞增殖代谢、药物细胞毒性作用的体外测定以及病原微生物的快速检测与鉴定等研究[16-18]。基于氧化/还原反应原理, 当细菌生长增殖时, 由于细菌细胞内生化反应产生的还原力可将阿尔玛蓝染料发生还原, 从而使其由无荧光的靛青蓝转变成有荧光的粉红色。阿尔玛蓝反应的最终产物不需要添加特殊溶剂溶解, 操作步骤简便, 不会产生因溶解不充分导致的检测误差; 灵敏度高、变色反应快、凭肉眼极易分辨颜色变化, 特别适于细菌生长快速检测, 而且对细菌毒性小, 可实时监测细菌的增殖动态, 使药敏检测更为简便和快捷。
3.4 药敏检测微孔板法的影响因素本研究将试管稀释法与基于颜色判定的快速药敏检测进行对比, 检测结果显示两种方法检测结果完全一致, 说明本研究建立的弧菌快速药敏检测方法准确可行。但是, 本研究仅在细菌接种后短时间(8 h)内进行药敏对比试验, 由于微孔板培养条件与试管培养条件存在一定差异, 尤其是溶氧效率, 是限制静止培养条件下好氧菌生长的重要影响因素[19]。一般在高比面积的培养模式下外界向培养基内溶解氧气的效率越高, 越利于细菌的快速增殖, 因而随着培养时间的延长, 不同培养模式下的药敏检测结果也有可能存在一定差异[20]。
另外, 药敏检测接种浓度的选择对于快速药敏检测结果的准确性和实用性十分重要, 接菌浓度过高, 细菌即使受到药物作用增殖受到抑制, 高浓度细菌在经过一段时间的生理代谢活动后产生的还原力也能使阿尔玛蓝指示剂发生颜色变化, 从而使检测结果失真; 如果接菌浓度过低又将会大大延长药敏检测的时间跨度, 使快速药敏检测失去意义。本研究经过初筛选定1×105 CFU/mL的菌液接种浓度, 对比试管稀释法结果, 很好地保证结果的准确、可靠。但是不同种弧菌的生长、代谢特性会存在一定差异, 本研究建立的药敏快速检测方法虽然证实其可应用于副溶血弧菌、溶藻弧菌及灿烂弧菌, 然而其是否适用于其他不同种弧菌还有待进一步验证。在实际应用中, 在参考本研究方法测得的药物MIC值基础上, 还应该综合考虑不同养殖动物的体重及其对不同药物的代谢动力学规律进行科学合理给药。
4 结论随着水产病原弧菌耐药性日益加重的现状, 建立可应用于水产养殖现场使用的快速药敏检测技术, 以科学、合理、及时地筛选、使用抗菌药物达到有效治疗的目的, 对于弧菌病的防控具有重要的现实意义[21]。本研究构建了弧菌的快速药敏检测方法并开展3种弧菌药敏的对比检测, 结果显示其准确可行, 该结果将为今后开发简便、快捷、敏感、高效的水产病原细菌药敏检测产品提供基础资料和参考。
| [1] |
TORANZO A E, MAGARIÑOS B, ROMALDE J L. A review of the main bacterial fish diseases in mariculture systems[J]. Aquaculture, 2005, 246(1/2/3/4): 37-61. |
| [2] |
曾令兵. 我国水产养殖动物病害的现状及发展方向[J]. 科学养鱼, 2010(3): 1-3. ZENG L B. Present status and prospects of aquaculture animal disease prevention in China[J]. Scientific Fish Farming, 2010(3): 1-3. |
| [3] |
吴淑勤, 王亚军. 我国水产养殖病害控制技术现状与发展趋势[J]. 中国水产, 2010(8): 9-10. WU S Q, WANG Y J. Present situation and development of disease control technology of aquatic animals in China[J]. China Fisheries, 2010(8): 9-10. DOI:10.3969/j.issn.1002-6681.2010.08.003 |
| [4] |
潘晓艺, 沈锦玉, 尹文林, 等. 水生动物的弧菌病及其致病机理[J]. 大连海洋大学学报, 2006, 21(3): 272-277. PAN X Y, SHEN J Y, YIN W L, et al. Vibriosis and their mechanisms in aquatic anmials[J]. Journal of Dalian Fisheries University, 2006, 21(3): 272-277. DOI:10.3969/j.issn.1000-9957.2006.03.016 |
| [5] |
WANG W. Bacterial diseases of crabs:A review[J]. Journal of Invertebrate Pathology, 2011, 106(1): 18-26. DOI:10.1016/j.jip.2010.09.018 |
| [6] |
胡超群, 陶保华. 综述:对虾弧菌病及其免疫预防的研究进展[J]. 热带海洋学报, 2000, 19(3): 84-94. HU C Q, TAO B H. Penaeid shrimp vibriosis and immune prevention:A review[J]. Tropic Oceanology, 2000, 19(3): 84-94. DOI:10.3969/j.issn.1009-5470.2000.03.013 |
| [7] |
PLAZA N, CASTILLO D, PÉREZ-REYTOR D, et al. Bacteriophages in the control of pathogenic vibrios[J]. Electronic Journal of Biotechnology, 2018, 31: 24-33. DOI:10.1016/j.ejbt.2017.10.012 |
| [8] |
TRAVERS M A, MILLER K B, ROQUE A, et al. Bacterial diseases in marine bivalves[J]. Journal of Invertebrate Pathology, 2015, 131: 11-31. DOI:10.1016/j.jip.2015.07.010 |
| [9] |
ELBASHIR S, PARVEEN S, SCHWARZ J, et al. Seafood pathogens and information on antimicrobial resistance:A review[J]. Food Microbiology, 2018, 70: 85-93. DOI:10.1016/j.fm.2017.09.011 |
| [10] |
ELMAHDI S, DASILVA L V, PARVEEN S. Antibiotic resistance of Vibrio parahaemolyticus and Vibrio vulnificus in various countries:A review[J]. Food Microbiology, 2016, 57: 128-134. DOI:10.1016/j.fm.2016.02.008 |
| [11] |
胡梦华.海水养殖源弧菌耐药性调查与致病性弧菌毒力基因检测[D].上海: 上海海洋大学, 2015. HU M H.Investigation of antimicrobial resistance of mariculture source vibrio and detection of virulence genes of pathogenic vibrio[D].Shanghai: Shanghai Ocean University, 2015. |
| [12] |
LIU X, STEELE J C, MENG X Z. Usage, residue, and human health risk of antibiotics in Chinese aquaculture:A review[J]. Environmental Pollution, 2017, 223: 161-169. DOI:10.1016/j.envpol.2017.01.003 |
| [13] |
SMITH P. Breakpoints for disc diffusion susceptibility testing of bacteria associated with fish diseases:A review of current practice[J]. Aquaculture, 2006, 261: 1113-1121. DOI:10.1016/j.aquaculture.2006.05.027 |
| [14] |
WIEGAND I, HILPERT K, HANCOCK R E W. Agar and broth dilution methods to determine the minimal inhibitory concentration (MIC) of antimicrobial substances[J]. Pharmacology and toxicology, 2008, 3(2): 163-175. DOI:10.3923/jpt.2008.163.167 |
| [15] |
Clinical and Laboratory Standards Institute.Methods for broth dilution susceptibility testing of bacteria isolated from aquatic animals, 2nd edition: VET04-A2[S/OL].[2014-09-25].https://clsi.org/standards/products/veterinary-medicine/documents/vet04/.
|
| [16] |
MARTIN A, PORTAELS F, PALOMINO J C. Colorimetric redox-indicator methods for the rapid detection of multidrug resistance in Mycobacterium tuberculosis:A systematic review and meta-analysis[J]. Journal of Antimicrobial Chemotherapy, 2006, 59(2): 175-183. |
| [17] |
O'BRIEN J, WILSON I, ORTON T, et al. Investigation of the Alamar Blue (resazurin) fluorescent dye for the assessment of mammalian cell cytotoxicity[J]. European Journal of Biochemistry, 2000, 267: 5421-5426. DOI:10.1046/j.1432-1327.2000.01606.x |
| [18] |
HAMID R, ROTSHTEYN Y, RABADI L, et al. Comparison of alamar blue and MTT assays for high through-put screening[J]. Toxicology in Vitro, 2004, 18(5): 703-710. DOI:10.1016/j.tiv.2004.03.012 |
| [19] |
CHEN C H, LU Y, SIN M L Y, et al. Antimicrobial susceptibility testing using high surface-to-volume ratio microchannels[J]. Analytical Chemistry, 2010, 82(3): 1012-1019. DOI:10.1021/ac9022764 |
| [20] |
刁菁, 杨秀生, 叶海斌, 等. 一种水产迟钝爱德华氏菌快速药敏检测方法的研究[J]. 水产科学, 2014, 33(1): 22-28. DIAO J, YANG X S, YE H B, et al. A rapid sensitive detection method of pathogen Edwardsiella tarda[J]. Fisheries Science, 2014, 33(1): 22-28. |
| [21] |
王静波, 曹欢, 徐立蒲, 等. 药敏试验技术在水产养殖动物细菌性疾病防治中的应用现状及展望[J]. 中国水产, 2011(5): 81-82. WANG J B, CAO H, XU L P, et al. Application and prospect of drug sensitivity test in prevention and treatment of bacterial diseases in aquaculture animals[J]. China Fisheries, 2011(5): 81-82. DOI:10.3969/j.issn.1002-6681.2011.05.036 |
 2018, Vol. 34
2018, Vol. 34 


