2. 乳山市水产技术推广站, 山东乳山 264500;
3. 山东华春渔业有限公司 山东东营 257200
2. Extension Station of Fishery Technology of Rushan City, Rushan, Shandong, 264500, China;
3. Shandong Huachun Fishery Corporation, Dongying, Shandong, 257200, China
刺参Apostichopus japonicus Selenka极高的营养价值和保健作用逐步得到世界的认同,因此刺参也越来越受消费者的喜爱。近年来,刺参增养殖规模不断扩大,养殖方式多样化,其中池塘养殖是目前我国刺参养殖的主要模式[1]。但是,池塘养殖易受水温、盐度等多种外界环境因素影响[2],其中养殖水pH是关键因子之一[3-4]。与此同时,在池塘刺参养殖中还普遍存在底质老化、池底粪便有害物质大量积累与氨化分解等问题;另外,养殖池塘易受近岸海水的影响,尤其是近年来近海浒苔等大型藻类连续暴发[5]、腐烂,加之时常受到集中强降雨、酸雨、海水酸化等影响,池塘养殖水pH呈现周期性或临时性波动,不同程度地影响着刺参摄食与生长。目前,有关养殖水pH对刺参生理影响的研究资料较少[6-7],多集中在慢性胁迫对刺参影响的实验研究,而pH节律性变动对刺参生长和消化的影响相关研究尚未见报道。本实验基于不同pH处理时间下刺参生长、摄食与消化酶活性的变化,以探明pH节律性变动与刺参生长、消化的关系,为刺参健康养殖和养殖水环境的调控提供基础数据与技术支撑。
1 材料与方法 1.1 材料实验用刺参为青岛国家海洋科研中心山东省海洋生物研究院鳌山基地选育的健康苗种,选取体表正常、活力强、摄食良好的苗种暂养在0.2 m3的玻璃钢槽中,平均体重为(20.32±0.15) g。养殖海水为经沉淀沙滤的自然海水,盐度(31.4±0.2)‰,水温14.6-17.3℃,溶解氧DO≥5.6 mg/L,24 h连续微量充气,每天全量换水1次。
1.2 方法 1.2.1 实验设计实验刺参饲养在25 L的塑料整理箱中,每个箱中放置刺参10头,每个实验组各设3个平行。以自然海水(pH=8.1±0.3)为对照,根据韩莎等[7]研究,实验设定pH 7.3(A)、pH 8.9(B)两个实验组,在这两组pH条件下进行5种处理,每日早上8:00通过换水调节在该pH条件下分别处理1 h (A1、B1)、3 h (A2、B2)、6 h (A3、B3)、9 h (A4、B4)、12 h(A5、B5),再次换水使pH恢复正常,每天为1个实验周期。每日16:00投喂饲料l次,共持续30 d。各实验组使用1 mol/L的盐酸和1 mol/L的氢氧化钠调节养殖水pH,在换水前调节校正至实验设计所需pH且稳定后方可用于实验。采用哈纳HI98185多参数水质分析仪测定并及时校正水中pH,变化幅度为±0.05个单位。
1.2.2 刺参生长指标测定实验开始前1 d停止投喂,称量刺参初始体重W0(g),实验30 d结束前同样停止投喂1 d后称其体重最终值Wt(g)。称重时,先将刺参取出,吸干体表水分后称量。t为实验持续的时间(d)。观测并记录刺参吐脏、存活情况。N0为刺参实验个体数,Nt为刺参存活个体数,Ne为刺参排脏个体数,F为饲料总摄入量(g)。各项指标统计、计算方法采用以下公式:
| $ 特定生长率\left( {{\rm{Specific\;Growth\;Rate, SGR, }}\% } \right) = \left( {\ln {W_t} - \ln {W_0}} \right)/t \times 100; $ |
| $ 摄食率\left( {{\rm{Feeding\;Rate, FR, \% }}} \right) = 2F/\left[ {t\left( {{W_t} + {W_0}} \right)} \right] \times 100; $ |
| $ 食物转化率\left( {{\rm{Food\;Conversion\;Ratio, FCR, }}\% } \right) = \left( {{W_t} - {W_0}} \right)/F \times 100 $ |
实验结束后,将刺参捞出待其排净体内海水,用灭菌纱布擦干体表水分放入玻璃培养皿中,沿腹部剪开,取出消化道,剔除呼吸树,用超纯水冲洗干净,在-80℃超低温冰箱中保存。实验时取肠组织置于玻璃匀浆器中,加入10倍体积预冷的超纯水,在冰浴条件下匀浆20 min,在高速冷冻离心机中(0-4℃,1 000 r/min)离心30 min,所得上清液置于冰箱保存待测。
消化酶指标——蛋白酶和淀粉酶均采用南京建成生物工程研究所研制的试剂盒测定。蛋白酶活力测定采用钼酸铵法,每毫克组织蛋白在37℃条件下每分钟分解蛋白生成1 μg氨基酸相当于1个酶活力单位(U)。淀粉酶(AMS)含量测定采用比浊法,组织中每毫克蛋白在37℃与底物作用30 min,水解10 mg淀粉定义为1个淀粉酶活力单位(U)。酶液中蛋白质含量的测定按南京建成生物工程研究所生产的BCA蛋白浓度测定试剂盒上的说明进行。
1.2.4 数据分析处理实验数据以平均值±标准差(x±SD)表示,用SPSS 18.0及Excel软件进行数据分析统计,以P < 0.05作为显著性差异的标志。
2 结果与分析 2.1 pH处理时间对刺参生长和摄食的影响如表 1所示,A组刺参终末体重和SGR随pH处理时间的增加呈现先升高后降低的变化趋势,峰值出现在pH处理时间为6 h时,终末体重为26.45 g,SGR为0.88%/d,除A2和A3组显著高于对照组外(P < 0.05),其余各组与对照组无显著差异(P>0.05);当pH处理时间超过6 h时,刺参终末体重和SGR逐渐下降且低于对照组,但差异不显著。B组刺参终末体重和SGR随pH处理时间的增加而逐渐下降,当pH处理时间超过3 h时,刺参终末体重和SGR显著低于对照组(P < 0.05),B5组刺参终末体重和SGR最低,分别为22.87 g、0.39%/d。
| 组别 Group |
处理时间 Time (h) |
初始体重 Initial body weight (g) |
终末体重 Final body weight (g) |
特定生长率 Specific growth rate (%/d) |
摄食率 Feeding rate (%) |
食物转化率 Food conversion efficiency (%) |
| 对照CK | 0 | 20.32±0.15a | 24.56±0.17a | 0.63±0.06a | 1.75±0.06a | 36.08±0.20a |
| A1 | 1 | 20.32±0.15a | 25.32±0.13ab | 0.73±0.09ab | 1.89±0.11ab | 38.49±0.25ab |
| A2 | 3 | 20.32±0.15a | 25.73±0.18b | 0.79±0.06b | 2.01±0.10b | 38.95±0.19b |
| A3 | 6 | 20.32±0.15a | 26.45±0.16b | 0.88±0.07b | 2.19±0.08b | 39.85±0.15b |
| A4 | 9 | 20.32±0.15a | 24.26±0.19a | 0.59±0.08a | 1.59±0.08a | 36.92±0.17a |
| A5 | 12 | 20.32±0.15a | 23.84±0.15a | 0.53±0.07a | 1.53±0.12a | 34.68±0.16a |
| B1 | 1 | 20.32±0.15a | 24.86±0.13a | 0.67±0.05a | 1.86±0.09a | 38.06±0.18a |
| B2 | 3 | 20.32±0.15a | 24.68±0.19a | 0.65±0.10a | 1.77±0.07a | 38.31±0.16a |
| B3 | 6 | 20.32±0.15a | 23.42±0.14c | 0.47±0.11c | 1.48±0.09c | 32.02±0.19c |
| B4 | 9 | 20.32±0.15a | 23.25±0.15c | 0.45±0.09c | 1.42±0.03c | 31.58±0.21c |
| B5 | 12 | 20.32±0.15a | 22.87±0.16c | 0.39±0.07c | 1.35±0.06c | 29.11±0.23c |
| 注:同列中不同字母组间表示差异显著(P < 0.05) Note:Values in the same column with different letter superscripts are significantly different (P < 0.05) |
||||||
A组刺参FR、FCR随pH处理时间的增加呈现先升高后降低的变化趋势,除A2和A3组显著高于对照组(P < 0.05),其余各组与对照组无显著差异(P>0.05),其中以A3组最高,FR为2.19%,FCR为39.85%,当pH处理时间超过6 h时,刺参个体FR、FCR低于对照组,但差异不显著;B组刺参FR、FCR随pH处理时间的增加而逐渐下降,当pH处理时间超过3 h时,刺参FR和FCR逐渐下降且显著低于对照组(P < 0.05)。
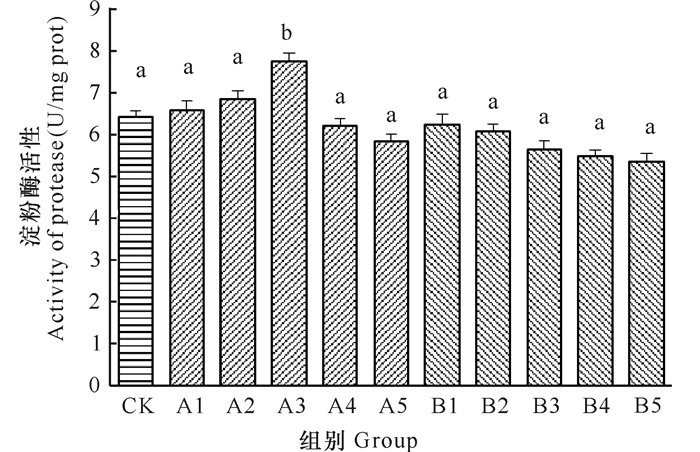
2.2 pH处理时间对刺参消化酶活性的影响 2.2.1 pH处理时间对刺参蛋白酶活性的影响由图 1可以看出,至实验结束时,A组刺参蛋白酶活性随着pH处理时间的增加呈现先升高后降低的变化趋势。当pH处理时间在1-6 h时,A组刺参蛋白酶活性随着pH处理时间的增加逐渐升高,在处理时间6 h时达到最高,为7.75 U/mg prot,显著高于对照组(P < 0.05),而其余各组与对照组差异不显著。B组刺参蛋白酶活性随着pH处理时间的增加呈现逐渐低于对照组的变化规律,以pH处理时间12 h时最低,为5.36 U/mg prot,各处理组与对照组差异不显著(P>0.05)。
|
| 图中不同字母表示差异显著(P < 0.05) Different letters on the graph mean siginificant differences (P < 0.05) 图 1 不同pH处理时间对刺参蛋白酶活性的影响 Fig.1 Effect of different pH treatment time on protease activity of A.japonicus Selenka |
2.2.2 pH处理时间对刺参淀粉酶活性的影响
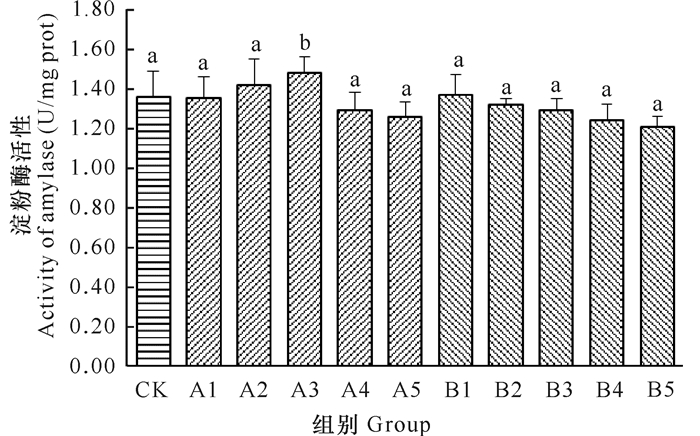
由图 2可以看出,至实验结束时,A组刺参淀粉酶活性随着pH处理时间的增加呈现先升高后降低的变化趋势。当pH处理时间在1-6 h时,A组刺参淀粉酶活性随着pH处理时间的增加逐渐升高,在处理时间6 h时达到最高,为1.48 U/mg prot,显著高于对照组(P < 0.05),而其余各组与对照组差异不显著。B组刺参淀粉酶活性随着pH处理时间的增加呈现逐渐低于对照组的变化规律,以pH处理时间12 h时最低,为1.79 U/mg prot,各处理组与对照组差异不显著(P>0.05)。
|
| 图中不同字母表示差异显著(P < 0.05) Different letters on the graph mean siginificant differences (P < 0.05) 图 2 不同pH处理时间对刺参淀粉酶活性的影响 Fig.2 Effect of different duration pH treatment time on amylase activity of A.japonicus Selenka |
3 讨论 3.1 pH处理时间对刺参生长的影响
研究表明,环境因子在适宜范围内变动,对水生生物的生长影响不大,但如果超过适宜范围,就会产生抑制作用[8-9]。通常情况下,自然海水pH为7.8-8.5,水质的变化时常会导致水体pH在4-10内波动变化[6]。韩莎等[7]研究认为通常情况下,当养殖水pH为7.5-8.7时, 刺参均可正常活动、摄食与生长,未表现出异常状况。而本实验选择的两个pH梯度均超出该范围,实验结果发现,在养殖水pH为7.3时,随着pH处理时间的增加,刺参SGR和摄食率呈现先升高后降低的变化趋势;但相对于酸性方向的变化来说,碱性方向变化对刺参的抑制作用或产生的不利影响更为明显。pH变化对刺参来说是一种应激,笔者认为应激的效果取决于应激的程度和时间,而不是单纯产生不利的影响[10]。本实验中pH向酸性或者碱性方向的变化属于小幅度应激,每天不超过6 h的刺激,对刺参的应激刺激尚处于唤醒阶段随即恢复正常,因此对刺参的摄食和生长有一定的积极作用,这一点与郑振华等[11]对凡纳滨对虾的研究结果一致。而当每日超过6 h的pH处理会使刺参进入持续的应激状态,在抵御刺激中消耗大量的能量,因此用于生长的能量大幅度减少。随着应激时间的增加,刺参机体的代谢发生紊乱,SGR下降,从而影响刺参的摄食与生长。
3.2 pH处理时间对刺参消化酶活性的影响水产动物的生长发育离不开对食物的消化吸收,而该过程的实现需要多种酶,尤其是消化酶。因此,消化酶活性的研究一直是水产动物消化生理的重要研究内容[12],众多学者对消化酶的影响因素相继开展大量的实验研究工作[13-15],认为温度和pH是影响消化酶活力的最重要因素[16]。刺参作为棘皮动物,其体腔内环境与水环境密切相关,水体pH的变化与刺参肠道消化酶活性密切相关,且直接影响着刺参消化酶活性的高低。
蛋白酶和淀粉酶是刺参肠道的主要消化酶。刺参能够摄取沉积食物中的营养成分并合成自身的蛋白质,主要靠蛋白酶发挥作用,其酶活力最高,其次是淀粉酶[17]。消化酶必须在一定的pH条件下才能表现出高活力[18],消化酶活力的高低是刺参消化吸收能力的决定性因素[19]。付雪艳[20]认为刺参蛋白酶活性最高时的水环境pH为7.0-9.0,而姜令绪等[19]认为刺参中肠蛋白酶在pH为7.0-8.6时、淀粉酶在pH为6.6-7.4时其对应的酶活性较高且相对稳定。本实验研究发现,在养殖水pH=7.3时,随着pH处理时间的增加消化酶活力呈现先升高后降低的变化,当处理时间为6 h时,刺参蛋白酶和淀粉酶活力最高;而在养殖水pH=8.9时,蛋白酶和淀粉酶活性随着pH处理时间的增加逐渐下降,该结果表明实验水体pH在未超出蛋白酶和淀粉酶最适pH范围时,消化酶活性的高低与pH处理时间关系密切。短时间的pH变动尚属在刺参正常调节范围内,机体能够创造出适合消化酶发挥活性的pH环境,有利于蛋白质和淀粉的消化,因此在一定程度上提高食物转化率,促进生长;而如果长时间处于pH变动的水环境中,刺参对饲料的摄食和消化利用受到影响,进而不同程度地降低刺参的食物转化率,导致生长减缓。
4 结论水生生物生活在一个节律变动的环境下。pH作为应激因子,对同一pH处理也会随着不同处理时间的变化发生性质上的改变,对水生生物产生有益或有害的作用效果。因此,在刺参养殖中,应充分考虑养殖水体的pH变化幅度或者变化时间,尽量减少或者减缓pH变化的幅度和时间,从而减轻对刺参的应激反应,以保证刺参的充分摄食和快速生长,提高养殖效率。
| [1] |
李成林, 宋爱环, 胡炜, 等. 山东省刺参养殖产业现状分析与可持续发展对策[J]. 渔业科学进展, 2010, 31(4): 126-133. DOI:10.3969/j.issn.1000-7075.2010.04.018 |
| [2] |
迟爽, 曾勇, 赵振军, 等. 刺参养殖池塘的水质变化[J]. 济南大学学报:自然科学版, 2013, 27(3): 239-244. |
| [3] |
许友卿, 张仁珍, 丁兆坤. pH对鱼类繁育及生长发育的影响[J]. 水产科学, 2014, 33(2): 113-136. |
| [4] |
李文祥, 谢骏, 宋锐, 等. 水体pH胁迫对异育银鲫皮质醇激素和非特异性免疫的影响[J]. 水生生物学报, 2011, 35(2): 256-261. |
| [5] |
李成林, 胡炜. 我国刺参产业发展状况、趋势与对策建议[J]. 中国海洋经济, 2017(1): 3-20. |
| [6] |
ZHAO W, LIANG M, ZHANG P. Effect of yeast polysaccharide on the immune function of juvenile sea cucumber, Apostichopus japonicus Selenka under pH stress[J]. Aquaculture International, 2010, 18(5): 777-786. DOI:10.1007/s10499-009-9300-4 |
| [7] |
韩莎, 胡炜, 李成林, 等. pH胁迫对刺参存活、生长及抗氧化酶活性的影响[J]. 渔业科学进展, 2018, 39(5): 91-98. |
| [8] |
张林娟, 潘鲁青, 栾治华. pH变化对日本囊对虾仔虾离子转运酶活力和存活、生长的影响[J]. 水产学报, 2008, 32(5): 758-764. |
| [9] |
赵斌, 胡炜, 李成林, 等. 低盐环境对3种规格刺参(Apostichopus japonicus)幼参生长与消化酶活力的影[J]. 渔业科学进展, 2015, 36(1): 91-96. |
| [10] |
RYTER S W, KIM H P, HOETZEL A, et al. Mechanisms of cell death in oxidative stress[J]. Antioxidants & Redox Signaling, 2007, 9(1): 49-89. |
| [11] |
郑振华, 董双林, 田相利. pH不同处理时间的周期性变动对凡纳滨对虾生长的影响[J]. 中国海洋大学学报, 2008, 38(1): 45-51. |
| [12] |
田宏杰, 庄平, 高露姣. 生态因子对鱼类消化酶活力影响的研究进展[J]. 海洋渔业, 2006, 28(2): 158-162. DOI:10.3969/j.issn.1004-2490.2006.02.013 |
| [13] |
任庆印, 潘鲁青. 刺参消化酶性质与活性分布的研究[J]. 海洋湖沼通报, 2013(2): 51-56. |
| [14] |
周玮, 田甲申, 黄俊鹏, 等. 不同生长阶段仿刺参肠道内含物及消化酶活性的变化[J]. 大连海洋大学学报, 2010, 25(5): 460-464. DOI:10.3969/j.issn.1000-9957.2010.05.016 |
| [15] |
孙佳敏.刺参摄食行为和消化生理的实验研究[D].青岛: 中国海洋大学, 2015.
|
| [16] |
王吉桥, 唐黎, 许重, 等. 温度、pH和金属离子对仿刺参蛋白酶活力影响的研究[J]. 海洋科学, 2007, 31(11): 14-18, 85. DOI:10.3969/j.issn.1000-3096.2007.11.004 |
| [17] |
王吉桥, 唐黎, 许重, 等. 仿刺参消化道的组织学及其4种消化酶活力的周年变化[J]. 水产科学, 2007, 26(9): 481-484. DOI:10.3969/j.issn.1003-1111.2007.09.001 |
| [18] |
姚雪梅, 王珺, 贝荣丙, 等. 不同pH对糙海参消化酶活性的影响[J]. 海南大学学报:自然科学版, 2006, 24(4): 389-394. |
| [19] |
姜令绪, 杨宁, 李建, 等. 温度和pH对刺参(Apostichopus japonicus)消化酶活力的影响[J]. 海洋与湖沼, 2007, 38(5): 476-480. DOI:10.3321/j.issn:0029-814x.2007.05.013 |
| [20] |
付雪艳.海参(Stichopus japonicus)消化蛋白酶的初步研究[D].青岛: 中国海洋大学, 2004.
|



