2. 广西科学院, 广西壮族自治区渔业重大疫病防控与高效健康养殖产业技术工程研究中心, 广西海洋天然产物与组合生物合成化学重点实验室, 广西南宁 530007;
3. 河南师范大学生命科学学院, 河南新乡 453007
2. Guangxi Key Laboratory of Marine Natural Products and Combinatorial Biosynthesis Chemistry, Guangxi Engineering Research Center for Fishery Major Diseases Control and Efficient Healthy Breeding Industrial Technology, Guangxi Academy of Sciences, Nanning, Guangxi, 530007, China;
3. College of Life Science, Henan Normal University, Xinxiang, Henan, 453007, China
石斑鱼(Epinephelus sp.)味道鲜美、营养丰富、高蛋白低脂肪,不饱和脂肪酸含量丰富,经济价值极高,属于名贵的海水养殖品种[1, 2]。2019年全国石斑鱼养殖总量高达1.83×105 t,约占总海水养殖鱼类的11.4%,是我国重要的海水养殖鱼类[3]。作为水产养殖大国,近年来水产疾病接连暴发给水产养殖业带来巨大损失,仅2019年全国因水产病害所导致的损失就超过200亿元[3]。随着石斑鱼人工鱼苗育苗技术的不断成熟, 养殖技术和养殖条件的逐步完善,我国石斑鱼养殖行业进入了快速发展阶段,相关病害也随之频繁暴发,严重危害石斑鱼养殖产业的健康持续发展[4]。
石斑鱼虹彩病毒(Singapore Groupe Riridovirus, SGIV)为正二十面体,直径为154-176 nm,传染性强,石斑鱼幼苗易患此病,患病后短时间内大量死亡[5, 6]。水产病害暴发后,抗生素类药物治疗是最常用的方法,该法短期效果明显,但长期使用将使养殖品质下降,养殖环境恶化,进而限制了石斑鱼养殖产业的健康发展[7]。此外,长期使用抗生素致使细菌耐药性增强及抗生素残留,不仅危害人体健康,还使得生态环境遭到不可逆的破坏。
水产疾病多发生在水中,具有发现慢、传播快、致死率高的特点,因此“以防为主,防治结合”的理念被大多数养殖企业所认可。目前,水产疫病防治的主要手段是使用抗生素类药物,但近年来滥用抗生素引发了一系列食品安全和生态环境问题,因此研发水产动物疫苗成为破解抗生素安全问题的重要突破点之一,通过对石斑鱼进行腹腔注射SGIV灭活疫苗,可使石斑鱼幼苗的存活率达到90%以上[8, 9]。疫苗防控是对健康石斑鱼在患病前进行疾病的免疫预防,却难以对患病鱼进行有效治疗,其次水产灭活疫苗仍具有一定风险,且具有操作复杂、成本较高等缺点[10]。中草药中含有黄酮类、生物碱、有机酸等多种生物活性成分,具有抑菌抗炎抗毒的作用,同时具有增强机体免疫力、促进生长的功效[10-12],且中草药在自然环境中能够自动降解,不影响生态环境。有报道证实,紫花地丁[13]、广西莪术[14]、金银花[15]、八角茴香[16]、槲皮素[17]、黄连[18]、败酱草[19]等多种药用植物水提物对水生病毒具有显著的抗病毒效果。中草药在病害暴发的前期预防及后期治疗均能发挥作用,所以研究开发绿色高效的抗病中草药制剂前景广阔,也是生态化高质量水产养殖的重要研究方向。
秦皮为木犀科白蜡树的干燥枝或皮,秦皮乙素(Esculetin, EC)是其主要活性成分之一,具有抗菌、抗炎、抗肿瘤、抗氧化等活性作用。杨天鸣等[20]对秦皮提取物进行了体外抗菌实验,发现秦皮具有一定的抗菌作用。Watanabe等[21]研究证实,秦皮乙素可有效治疗小鼠大肠杆菌病。段慧琴等[22]利用体外培养的肠黏膜微血管内皮细胞,证实秦皮乙素通过2种途径发挥抗炎作用:一是通过降低NO分泌,使血管收缩血流增加,从而加速毒素清除,保护组织器官;二是抑制可溶性细胞间黏附分子的分泌,通过调节白细胞来调节炎症反应,减轻炎症反应对组织器官的损伤。龚永欢等[23]通过使用DPPH法评价12种中草药及5个复方的体外抗氧化活性,发现秦皮、白头翁、黄连及黄柏对DPPH清除作用较好,能有效地减少机体自由基氧化损伤。Chu等[24]研究表明,秦皮乙素通过加速细胞色素C向细胞质迁移,激活半胱氨酸蛋白水解酶原诱导白血病细胞凋亡;Wu等[25]研究表明秦皮乙素能够抑制由Fe2+/抗坏血酸盐引起的过氧化作用。另外,Zhu等[26]研究发现秦皮乙素通过下调c-myc、cyclinD1和NF-κB的表达,诱导肺癌细胞凋亡或细胞周期停滞,进而抑制肺癌细胞的增殖。乐韵等[27]研究发现秦皮乙素可通过下调HIF-1α表达与干性相关蛋白,抑制三阴性乳腺癌细胞在缺氧微环境下增殖。上述研究均是从细胞或生物体的角度探究了秦皮乙素的作用机制,本研究拟从病毒的角度切入,探究秦皮及其活性成分秦皮乙素对石斑鱼虹彩病毒的抑制效果以及抗病毒机制,为秦皮及其有效成分秦皮乙素对石斑鱼虹彩病毒的防治提供理论依据,为开发新型、高效、安全的抗病毒渔用药物提供新的研究思路。
1 材料与方法 1.1 细胞、病毒、核酸适配体荧光分子探针体外实验所用到的细胞系为实验室之前建立并保存下来的石斑鱼脾脏组织细胞系(Grouper Spleen Cells, GS);所用石斑鱼虹彩病毒株SGIV-Gx分离自广西人工养殖的珍珠龙胆石斑鱼[2];羟基荧光素(6-Carboxy-Fluorescein, FAM) 标记的核酸适配体LYGV1荧光分子探针(FAM-LYGV1)[28]由上海生工生物工程有限公司合成。
1.2 秦皮水提物及秦皮乙素的制备秦皮(购自广西南宁一心大药房,北京同仁堂2020年产)粉碎制成粉末,称取25 g秦皮粉末浸泡在500 mL水中,4℃孵育过夜,次日将500 mL秦皮粉末浸泡液置锅中煎煮、定容至100 mL,得到初始浓度为250 mg/mL的秦皮水提物(Cortex Fraxini water extracts,CFE)母液。秦皮水提物母液经0.22 μm无菌滤膜过滤后,-20℃冰箱保存备用。秦皮的主要活性化合物成分秦皮乙素(购自成都瑞芬思生物科技有限公司)溶解于二甲硫亚砜(DMSO)中,至初始浓度为100 mg/mL。
1.3 细胞安全工作浓度的确定实验分为3组:对照组、秦皮水提物组、秦皮乙素组。其中:秦皮水提物组设置5个浓度,分别为0.25, 0.5, 1, 2, 4 mg/mL; 秦皮乙素组亦设5个浓度,分别为1, 5, 10, 50, 100 μg/mL。
将GS细胞转至96孔细胞培养板中,28℃培养18 h。对照组GS细胞不做任何处理,实验组细胞加入含不同浓度的秦皮水提物或秦皮乙素的细胞培养液进行培养,每组设置3个重复。用光学显微镜观察GS细胞24,48 h的细胞形态并拍照记录;48 h后吸除培养液并用PBS清洗一遍,每孔加入100 μL Cell Counting Kit-8(CCK-8)溶液,常温下避光孵育4 h后,使用酶标仪检测各组细胞在450 nm处的吸光度,记录数据代入如下公式,并计算各组细胞存活率。当细胞存活率超过80%时,结合光学显微镜观察结果,共同确定药物的安全工作浓度。
| $ C{\rm{(细胞存活率) = }}\frac{{O{D_0}}}{{O{D_1}}} \times 100{\rm{\% ,}} $ |
其中,OD0为实验组细胞在450 nm处的吸光度,OD1为对照组细胞在450 nm处的吸光度。
1.4 RT-qPCR技术检测基因表达情况GS细胞接至12孔细胞培养板中,28℃培养18 h后,将药物与病毒共同接入细胞中继续培养48 h,光学显微镜观察各组细胞并拍照记录。将各组样品收集至1.5 mL EP管,Trizol试剂盒提取样品总RNA,用HiFiScriptcDNASynthesis试剂盒将提取的RNA反转录成cDNA。以cDNA为模板,β-actin基因为内参基因,检测石斑鱼虹彩病毒主要衣壳蛋白(Major Capsid Protein,MCP)基因和囊膜蛋白VP19基因的表达情况,分析秦皮水提物(CFE)及其主要成分秦皮乙素(EC)的抗病毒效果。每组设3个重复。
1.5 基于核酸适配体LYGV1荧光分子探针的病毒检测将GS细胞转至12孔板中,实验分为5组——Control 1:正常培养的GS细胞;Control 2:细胞中仅加入SGIV;Test 1:细胞中同时接入安全工作浓度的药物(High concentration,H)与SGIV;Test 2:细胞中同时接入中浓度的药物(Medium concentration,M),即1/2安全工作浓度的药物与SGIV;Test 3:细胞中同时接入低浓度的药物(Light concentration,L),即1/4安全工作浓度的药物与SGIV。培养48 h后收集各组样品,加入FAM标记的LYGV1荧光分子探针(FAM-LYGV1),4℃孵育30 min后,用PBS缓冲液清洗2次,将细胞重新悬浮在400 μL PBS缓冲液中,使用流式细胞仪检测其(495/535 nm)荧光值,并分析。
1.6 统计分析采用GraphPad Prism7和Excel 2010软件对实验数据进行处理并制作图表。数据结果利用IBM SPSS Statistics 26版本统计分析软件进行单因素方差分析(ANOVA),用Duncan多重比较法比较各组数据之间的差异是否具有显著性,当P < 0.05时,定义差异显著具有统计学意义。每组计算3个独立实验的平均值。
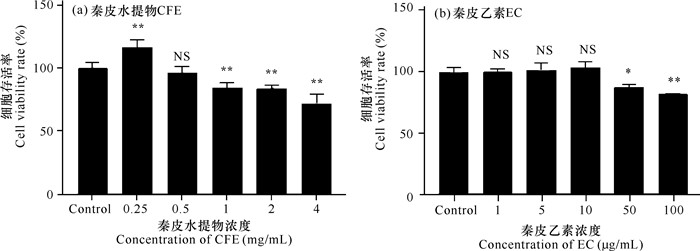
2 结果与分析 2.1 秦皮水提物和秦皮乙素的细胞安全工作浓度如图 1和图 2所示,对照组GS细胞形态正常;在细胞中加入1 mg/mL秦皮水提物和10 μg/mL秦皮乙素后,GS细胞并未出现明显的细胞病变现象。值得进一步探究的是,加入0.25 mg/mL秦皮水提物时,GS细胞的存活率显著提高,推测低浓度秦皮水提物可能会提高细胞活力或促进细胞增殖(图 3)。而加入高于1 mg/mL的秦皮水提物和高于10 μg/mL的秦皮乙素后,GS细胞出现变圆、皱缩、脱落等细胞病变现象。结合CCK-8检测细胞存活率结果,确定秦皮水提物安全工作浓度为ρCFE≤1 g/L,秦皮乙素安全工作浓度为ρEC≤0.01 g/L。
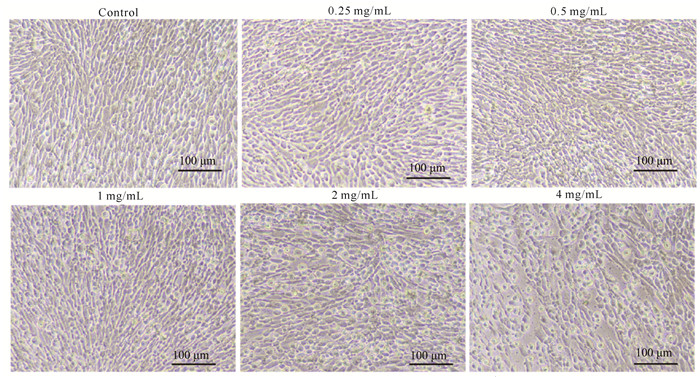
|
| 图 1 秦皮水提物安全浓度的确定(GS细胞,48 h) Fig.1 Determination of safe concentration of Cortex Fraxini water extract (GS cell, 48 h) |

|
| 图 2 秦皮乙素安全浓度的确定(GS细胞, 48 h) Fig.2 Determination of the safe concentration of Esculetin (GS cells, 48 h) |
|
| *P < 0.05,差异显著;**P < 0.01, 差异极显著; NS表示无显著性差异 *Indicates significant difference (P < 0.05), **indicates that the difference is extremely significant (P < 0.01), NS means no significant difference 图 3 CCK-8法确定细胞存活率 Fig.3 CCK-8 method to determine cell viability |
2.2 秦皮水提物及秦皮乙素的体外抗SGIV活性 2.2.1 光镜下抗SGIV效果分析
如图 4所示,与对照组(Control)相比,仅接入SGIV的GS细胞出现明显变圆、皱缩、脱落等细胞病变现象(Cytopathic Effects,CPEs);与SGIV组相比,实验组加入SGIV与安全浓度的CFE (1 mg/mL)、EC (10 μg/mL)后,细胞CPEs均显著降低,表明秦皮水提物及其活性成分秦皮乙素能够有效抑制石斑鱼虹彩病毒感染,且随着加入药物浓度的提升,其抑制石斑鱼虹彩病毒的效果越明显。

|
| 箭头所示为细胞病变效应 The arrows represent the cytopathic effects 图 4 光学显微镜下秦皮水提物和秦皮乙素对石斑鱼虹彩病毒的抗病毒效果 Fig.4 Analysis of the antiviral effects of Cortex Fraxini water extracts (CFE) and Esculetin under optical microscopy |
2.2.2 RT-qPCR检测抗SGIV活性分析
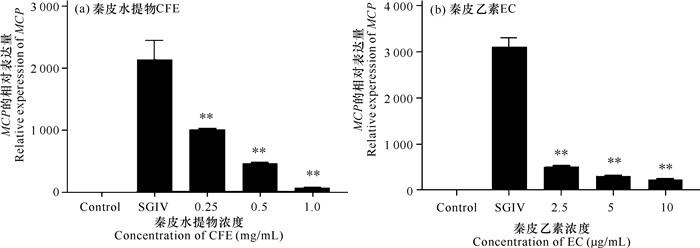
如图 5所示,与仅加入SGIV组相比,加入低于安全工作浓度的秦皮水提物(1,0.5,0.25 mg/mL)及秦皮乙素(2.5,5,10 μg/mL),病毒MCP的表达量显著降低,表明秦皮源化合物具有良好的抗病毒效果,且加入的秦皮水提物浓度与病毒的MCP表达量呈负相关,其中,高安全工作浓度时,秦皮水提物的抗病毒效果最佳。
|
| *P < 0.05,差异显著;**P < 0.01, 差异极显著 *Indicates significant difference (P < 0.05), **indicates that the difference is extremely significant (P < 0.01) 图 5 RT-qPCR分析秦皮水提物和秦皮乙素对石斑鱼虹彩病毒的抗病毒效果 Fig.5 Evaluation on the antiviral effects of Cortex Fraxini water extracts and Esculetin against SGIV infection by RT-qPCR |
2.2.3 基于核酸适配体LYGV1荧光分子探针的流式细胞分析
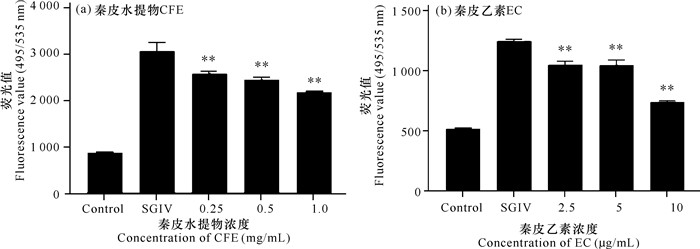
使用流式细胞仪分析各组细胞荧光值的变化,荧光值越低表明病毒感染的细胞越少。结果如图 6所示,仅接入SGIV的GS细胞荧光值远高于正常培养的GS细胞。实验组为同时加入SGIV和不同浓度的秦皮水提物(1, 0.5, 0.25 mg/mL)及秦皮乙素(2.5, 5, 10 μg/mL)细胞。与仅加入SGIV的对照组细胞相比,实验组细胞所检测到的荧光值显著降低,且随着秦皮水提物和秦皮乙素使用浓度的提高,流式细胞仪检测到的实验组细胞荧光值显著降低,表明秦皮水提物及其主要活性成分秦皮乙素具有显著抑制石斑鱼虹彩病毒感染细胞的效果。
|
| *P < 0.05,差异显著;**P < 0.01, 差异极显著 *Indicates significant difference (P < 0.05), **indicates that the difference is extremely significant (P < 0.01) 图 6 FAM-LYGV1分析秦皮水提物和秦皮乙素对石斑鱼虹彩病毒的抗病毒效果 Fig.6 Evaluation on the antiviral effects of Cortex Fraxini water extracts and Esculetin against SGIV infection by FAM-LYGV1 |
3 讨论
秦皮在我国分布广泛,始载于《神农本草经》,具有多种药理成分,是临床上常用的中草药材。香豆素类、裂环烯醚萜类及苯乙醇苷类是秦皮的主要药用成分,在抗菌、抗炎、抗氧化及抗肿瘤等方面均有良好效果。依据前人研究结果[29-36],秦皮及其提取物秦皮乙素能够通过调节细胞因子减轻炎症反应,降低组织损伤程度,亦可通过提高细胞抗氧化能力减少细胞内的自由基氧化[29-36]。秦皮中富含香豆素类化合物,香豆素类化合物能够通过调节白细胞介素-1β (IL-1β)、肿瘤坏死因子α (TNF-α)增强非特异性免疫反应,推测秦皮水提物及秦皮乙素能够通过调节非特异性免疫系统,抑制SGIV感染宿主细胞。前人研究多是从细胞的角度,探究秦皮及其活性成分对细胞或生物体的影响,而本研究从石斑鱼虹彩病毒的角度,探究秦皮及其主要活性成分秦皮乙素对石斑鱼虹彩病毒的抗病毒效果。细胞系作为实验动物的替代品,广泛应用于生物技术、致病机制、药物筛选等研究。本研究成果均建立在GS细胞系上。GS细胞来源于易感染石斑鱼虹彩病毒的褐点石斑鱼脾脏组织[37]。
为研究秦皮水提物及秦皮乙素对石斑鱼虹彩病毒是否存在抗病毒效果。首先确定秦皮水提物及秦皮乙素对GS细胞的安全工作浓度,根据CCK-8结果及光镜的观察结果,当秦皮水提物浓度高于1 mg/mL (ρCFE≥1 g/L)、秦皮乙素浓度高于10 μg/mL(ρEC≥0.01 g/L),GS细胞存活率显著下降,出现明显的病变现象。值得关注的是, 当秦皮水体物浓度为0.25 mg/mL时,实验组细胞存活率显著高于对照组细胞,推测可能是GS细胞在低浓度药物下无负荷,且秦皮水提物能加速清除自由基(ROS)提高细胞活力或促进细胞增殖[36]。综上,确定秦皮水提物及秦皮乙素的安全工作浓度分别为ρCFE≤1 g/L、ρEC≤0.01 g/L。
确定秦皮水提物及其活性成分秦皮乙素的安全工作浓度后,运用光学显微镜观察、RT-qPCR检测病毒结构蛋白MCP、VP19,以及基于LYGV1荧光分子探针(FAM-LYGV1)的流式细胞技术这3种方法,系统探究秦皮水提物及其主要活性成分秦皮乙素是否具有抑制石斑鱼虹彩病毒活性。实验结果表明,低浓度(0.25 mg/mL)、中浓度(5 mg/mL)、高浓度(1 mg/mL)的秦皮水提物及低浓度(2.5 μg/mL)、中浓度(5 μg/mL)、高浓度(10 μg/mL)的秦皮乙素都能有效抑制石斑鱼虹彩病毒感染宿主细胞,随着使用药物浓度或药物量的增加,抗病毒效果增强且差异显著,具有统计学意义。3种方法研究结果均显示,秦皮水提物及秦皮乙素具有较为显著的抗病毒效果,且抗病毒效果与药物量呈正相关。纯化的石斑鱼虹彩病毒(SGIV)颗粒具有3层膜(最外层脂蛋白囊膜、中间层蛋白质衣壳、最内层脂质膜),秦启伟等[6]对SGIV的基因组学研究发现SGIV最外层脂蛋白囊膜VP88基因起到黏附宿主细胞的作用,即VP19基因在病毒入侵阶段发挥重要作用。MCP是SGIV的晚期基因,能够调节细胞生长增殖,同时促进SGIV的复制[38]。如图 5所示,相较于仅接入SGIV的对照组细胞,实验组细胞中SGIV病毒的MCP表达量显著降低,推测秦皮水提物和秦皮乙素可能通过抑制MCP表达来抑制SGIV在宿主细胞内复制。秦启伟等[6]研究表明,VP19为SGIV病毒的囊膜蛋白,是SGIV的晚期转录本,加入VP19抗体对病毒入侵宿主细胞有显著的抑制作用,推测VP19在SGIV入侵宿主阶段发挥重要作用。本研究结果显示,与仅加入SGIV的对照组细胞相比,同时加入秦皮水提物和SGIV的实验组细胞中VP19基因的表达量显著降低,即秦皮水提物能够显著抑制SGIV的VP19基因表达。推测秦皮水提物通过对VP19表达的抑制,从而抑制SGIV继续扩散感染其他宿主细胞。
本研究创新使用核酸适配体荧光分子探针技术(LYGV1-AFMP)检测药物抗病毒效果。核酸适配体是一种高特异性、高亲和性、易于修饰的新型分子探针。本课题组之前以SGIV为研究对象,基于细胞-指数富集配基系统进化技术(Cell-SELEX),以SGIV感染的GS细胞为靶标,筛选出一系列ssDNA核酸适配体,该适配体能够精确检测宿主细胞是否被SGIV感染[39-41]。本研究中,LYGV1技术检测结果与光镜、RT-qPCR结果一致;与光镜结果相比,LYGV1-AFMP技术结果更精确;与RT-qPCR检测相比,LYGV1-AFMP技术检测操作简单,检测用时大大缩短。因此基于核酸适配体的AFMP技术是一种能快速、准确检测病毒感染情况且能够用于高通量、快速筛选药物的方法[42, 43]。下一步,我们将继续探究秦皮的重要活性成分抑制石斑鱼虹彩病毒的机制,旨在为开发绿色、高效、安全的抗病毒渔用中草药制剂提供数据支持和理论依据。
4 结论本研究确定了秦皮水提物及秦皮乙素的细胞安全工作浓度,并且在细胞上水平分析了秦皮水提物及秦皮乙素对SGIV的抗病毒作用,证明秦皮水提物及秦皮乙素对石斑鱼虹彩病毒具有良好的抗病毒效果。秦皮具有开发为高效的抗石斑鱼虹彩病毒渔用药物的潜力。
| [1] |
李鹏飞, 余庆, 覃仙玲, 等. 广西北部湾海水养殖业现状与病害防控技术体系研究展望[J]. 广西科学, 2018, 25(1): 15-25. |
| [2] |
XIAO H H, LIU M Z, LI S Q, et al. Isolation and characterization of a ranavirus associated with disease outbreaks in cultured hybrid grouper (♀ Tiger grouper Epinephelus fuscoguttatus×♂ Giant grouper E.lanceolatus) in Guangxi, China[J]. Journal of Aquatic Animal Health, 2019, 31(4): 364-370. DOI:10.1002/aah.10090 |
| [3] |
农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学. 2020中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2020.
|
| [4] |
王辉, 吴莎, 孙毅凡, 等. 桑叶提取物的抗病毒活性检测[J]. 蚕业科学, 2011, 37(5): 952-956. DOI:10.3969/j.issn.0257-4799.2011.05.027 |
| [5] |
QIN Q W, CHANG S F, NGOH-LIM G H, et al. Chaeacterization of a novel ranavirus isolated from grouper Epinephelus tauvina[J]. Diseases of Aquatic Organisms, 2003, 53(1): 1-9. |
| [6] |
秦启伟, 黄晓红. 石斑鱼虹彩病毒SGIV感染致病的细胞分子基础及免疫防控对策[J]. 华南农业大学学报, 2019, 40(5): 78-90. |
| [7] |
李鹏飞, 余庆, 罗永巨, 等. 广西水产疫病防控技术体系建设与水产养殖业高质化生态发展展望[J]. 广西科学院学报, 2019, 35(3): 161-165. |
| [8] |
OUYANG Z L, WANG P R, HUANG X H, et al. Immunogenicity and protective effects of inactivated Singapore grouper iridovirus (SGIV) vaccines in orange-spotted grouper, Epinephelus coioides[J]. Developmental and Comparative Immunology, 2012, 38(2): 254-261. DOI:10.1016/j.dci.2012.07.004 |
| [9] |
DAVIS H L, MCCLUSKIE M J. DNA vaccines for viral diseases[J]. Microbes and Infection, 1999, 1(1): 7-21. DOI:10.1016/S1286-4579(99)80009-4 |
| [10] |
WANG L Q, YANG R, YUAN B C, et al. The antiviral and antimicrobial activities of licorice, a widely-used Chinese herb[J]. Acta Pharmaceutica Sinica B, 2015, 5(4): 310-315. DOI:10.1016/j.apsb.2015.05.005 |
| [11] |
KWON S H, MA S X, HONG S I, et al. Lonicera japonica Thunb.extract inhibits lipopolysaccharide-stimulated inflammatory responses by suppressing NF-κ B signaling in BV-2 microglial cells[J]. Journal of Medicinal Food, 2015, 18(7): 762-775. DOI:10.1089/jmf.2014.3341 |
| [12] |
SHANG X F, PAN H, LI M X, et al. Lonicera japonica Thunb.: Ethnopharmacology, phytochemistry and pharmacology of an important traditional Chinese medicine[J]. Journal of Ethnopharmacology, 2011, 138(1): 1-21. DOI:10.1016/j.jep.2011.08.016 |
| [13] |
YU Q, LIU M Z, XIAO H H, et al. The inhibitory activities and antiviral mechanism of Viola philippica aqueous extracts against grouper iridovirus infection in vitro and in vivo[J]. Journal of Fish Diseases, 2019, 42(6): 859-868. DOI:10.1111/jfd.12987 |
| [14] |
LIU M Z, XIAO H H, ZHANG Q, et al. Antiviral abilities of Curcuma kwangsiensis ingredients against grouper iridoviral infection in vitro and in vivo[J]. Aquaculture Research, 2020, 51(1): 351-361. DOI:10.1111/are.14382 |
| [15] |
LIU M Z, YU Q, YI Y, et al. Antiviral activities of Lonicera japonica Thunb.components against grouper iridovirus in vitro and in vivo[J]. Aquaculture, 2020, 519: 734882. DOI:10.1016/j.aquaculture.2019.734882 |
| [16] |
LIU M Z, YU Q, XIAO H H, et al. Antiviral activity of Illicium verum Hook.f.extracts against grouper iridovirus infection[J]. Journal of Fish Diseases, 2020, 43(5): 531-540. DOI:10.1111/jfd.13146 |
| [17] |
LIU M Z, YU Q, XIAO H H, et al. The inhibitory activities and antiviral mechanism of medicinal plant ingredient quercetin against grouper iridovirus infection[J]. Frontiers in Microbiology, 2020, 11: 586331. DOI:10.3389/fmicb.2020.586331 |
| [18] |
刘明珠, 肖贺贺, 余庆, 等. 黄连水提物对卵形鲳鲹源溶藻弧菌的抑菌作用[J]. 广西科学院学报, 2019, 35(2): 119-123. |
| [19] |
肖贺贺, 刘明珠, 余庆, 等. 败酱草水提物对石斑鱼虹彩病毒的抗病毒作用[J]. 广西科学院学报, 2019, 35(3): 185-192. |
| [20] |
杨天鸣, 葛欣, 王晓妮. 秦皮抗菌作用研究[J]. 西北国防医学杂志, 2003, 24(5): 387-388. DOI:10.3969/j.issn.1007-8622.2003.05.033 |
| [21] |
WATANABE K, ITO A, SAITO T, et al. Esculetin suppresses proteoglycan metabolism by inhibiting the production of matrix metalloproteinases in rabbit chondrocytes[J]. European Journal of Pharmacology, 1999, 370(3): 297-305. DOI:10.1016/S0014-2999(99)00143-0 |
| [22] |
段慧琴, 张永东, 范开, 等. 七叶亭抗炎机理研究[J]. 中国兽医杂志, 2007, 43(9): 45-46. DOI:10.3969/j.issn.0529-6005.2007.09.023 |
| [23] |
龚永欢, 刘霞, 周海霞, 等. 中药及复方水提物对DPPH·和·OH的清除作用[J]. 湖北农业科学, 2013, 52(20): 4995-5000. |
| [24] |
CHU C Y, TSAI Y Y, WANG C J, et al. Induction of apoptosis by esculetin in human leukemia cells[J]. European Journal of Pharmacology, 2001, 416(1/2): 25-32. |
| [25] |
WU C R, HUANG M Y, LIN Y T, et al. Antioxidant properties of Cortex Fraxini and its simple coumarins[J]. Food Chemistry, 2007, 104(4): 1464-1471. DOI:10.1016/j.foodchem.2007.02.023 |
| [26] |
ZHU X Y, GU J P, QIAN H X. Esculetin attenuates the growth of lung cancer by down regulating Wnt targeted genes and suppressing NF-κB[J]. Archivos de Bronconeumología, 2018, 54(3): 128-133. |
| [27] |
乐韵, 张夏炎, 李凯. 秦皮乙素通过HIF-1α调控乏氧微环境中三阴性乳腺癌细胞干性[J]. 中国新药与临床杂志, 2020, 39(9): 558-562. |
| [28] |
余庆, 刘明珠, 肖贺贺, 等. 特异性检测珍珠龙胆石斑鱼虹彩病毒病的核酸适配体的筛选与鉴定[J]. 分析化学, 2020, 48(5): 650-661. |
| [29] |
王向荣, 方热军, 李四元, 等. 四种中草药体外抑菌活性及最优组方研究[J]. 中国饲料, 2008(1): 31-33. |
| [30] |
翁闪凡, 刘娜, 张晓琳, 等. 秦皮甲素对实验性溃疡性结肠炎大鼠肠黏膜细胞因子的影响[J]. 广州中医药大学学报, 2014, 31(6): 940-943, 1030. |
| [31] |
程琼. 秦皮甲素对氧化应激的缓解作用及其机制的初步研究[D]. 广州: 广东药科大学, 2020.
|
| [32] |
姚红月, 刘春娜, 刘新宇. 秦皮甲素对高糖诱导肾小球系膜细胞的保护作用与相关炎症机制研究[J]. 重庆医学, 2020, 49(23): 3871-3875. |
| [33] |
刘丽梅, 王瑞海, 陈琳, 等. 不同基原秦皮、香豆素单体抗菌作用对比研究[J]. 中国中医药信息杂志, 2009, 16(5): 39-42. |
| [34] |
杨庆, 翁小刚, 聂淑琴, 等. 不同基原秦皮、香豆素单体以及不同指纹区样品对内毒素刺激单核-巨噬细胞株分泌炎症因子的影响[J]. 中国实验方剂学杂志, 2010, 16(13): 127-131. |
| [35] |
段慧琴, 张永东, 范开, 等. 七叶亭抗炎机理研究[J]. 中国兽医杂志, 2007, 43(9): 45-46. |
| [36] |
聂安政, 林志健, 张冰. 秦皮化学成分和药理作用研究进展[J]. 中草药, 2016, 47(18): 3332-3341. |
| [37] |
QIN Q W, WU T H, JIA T L, et al. Development and characterization of a new tropical marine fish cell line from grouper, Epinephelus coioides susceptible to iridovirus and nodavirus[J]. Journal of Virological Methods, 2006, 131(1): 58-64. |
| [38] |
肖贺贺, 徐凤巧, 刘明珠, 等. 石斑鱼虹彩病毒主要衣壳蛋白的表达及其生物学功能分析[J]. 南方农业学报, 2021, 52(3): 806-814. |
| [39] |
余庆, 刘明珠, 肖贺贺, 等. 基于核酸适配体Q5的石斑鱼虹彩病毒快速检测技术[J]. 广西科学院学报, 2019, 35(3): 193-199, 212. |
| [40] |
YU Q, LIU M Z, XIAO H H, et al. Aptamer Q5-based rapid detection technology for grouper iridovirus infection[J]. Journal of Guangxi Academy of Sciences, 2019, 35(3): 193-199, 212. |
| [41] |
李鹏飞, 余庆, 李菲, 等. 基于新型核酸适配体-荧光分子检测探针的石斑鱼虹彩病毒病快速诊断[J]. 广西科学, 2018, 25(1): 63-67. |
| [42] |
YU Q, LIU M Z, WEI S N, et al. Research progress and prospects for the use of aptamers in aquaculture biosecurity[J]. Aquaculture, 2021, 534: 736257. DOI:10.1016/J.AQUACULTURE.2020.736257 |
| [43] |
LIU M Z, XIAO H H, WU S T, et al. Aptamer-based high-throughput screening model for medicinal plant drugs against SGIV[J]. Journal of Fish Diseases, 2020, 43(11): 1479-1482. |



