2. 广西科学院, 广西北部湾海洋研究中心, 广西海洋天然产物与组合生物合成化学重点实验室, 广西南宁 530007
2. Guangxi Key Laboratory of Marine Natural Products and Combinatorial Biosynthesis Chemistry, Guangxi Beibu Gulf Marine Research Center, Guangxi Academy of Sciences, Nanning, Guangxi, 530007, China
斜带石斑鱼(Epinephelus coioides)是我国南方主要的海水养殖鱼类,但是近年来虹彩病毒病、神经坏死病毒病、弧菌病频发,对该品种的养殖造成了严重的危害[1]。目前,石斑鱼的抗病免疫机理并不十分清楚,这不利于水产病害的防控及其药物研发。以往的研究表明,病原的感染能诱导动物细胞产生大量非折叠蛋白,引起内质网应激,进而激活宿主的免疫反应[2]。在这一过程中,蛋白质二硫键异构酶(Protein Disulfide Isomerase,PDI)在内质网中高表达,通过硫醇依赖性的滞留(Thiol-Mediated Retention,TMR)来产生混合的二硫键,在ERP44蛋白介导下使蛋白质处于还原状态。ERP44是一类参与TMR过程的主要分子伴侣[3],能与多种生物分子相互作用,例如免疫球蛋白M (IgM)、免疫球蛋白J链、免疫球蛋白K链[4],白介素12 (IL-12)[5],脂联素(Adiponectin)[6],甲酰基产生酶/硫酸酯酶修饰因子1(FGE/Sumf1)[7],Ero1α-β[8, 9],Ⅰ型肌醇1, 4, 5-三磷酸受体(Inositol 1, 4, 5-trisphosphate receptors 1,IPR3R1)[10],ER-高尔基中间体蛋白53 (ERGIC-53)[11]和硫氧还原蛋白4 (Peroxiredoxin 4,Prx4)[12]等。在ERP44的介导下,蛋白质在内质网中发挥停留、分子聚合、蛋白分泌或折叠[13]、钙离子控制、细胞信号传导、维持氧化还原稳态以及载体蛋白等作用[14-17],进而引起细胞的免疫应答。目前,已有学者报道不同宿主中ERP44的生理功能及其作用机理。Tian等[18]研究发现ERP44与鼻咽癌的进展有关,其能与ATP柠檬酸裂解酶发生相互作用,调控上皮细胞-间充质转化来促进鼻咽癌细胞恶性表型的形成。Liyanage等[19]研究发现海马ERP44基因在细菌、脂多糖刺激后表达上调,表明ERP44参与宿主的抗感染免疫。但是,其他鱼类如石斑鱼的ERP44是否具有类似的功能尚不清楚。
为了解ERP44基因在石斑鱼抗感染免疫中的作用,本研究根据斜带石斑鱼转录数据克隆了Ec-ERP44基因,进行生物信息学分析,并分析了Ec-ERP44在健康鱼体中的组织分布及其在脂多糖(Lipopolysaccharide, LPS)、聚肌胞苷酸(Polyinosinic-polycytidylic acid, Poly I: C)刺激后的表达变化,探讨该基因及其介导的内质网应激调控,以期为石斑鱼的抗感染免疫机制研究及其病害防控策略提供参考。
1 材料与方法 1.1 材料斜带石斑鱼购于广东湛江市霞山水产品市场,并在实验前两周将其暂养于实验室的循环系统中。实验所用的石斑鱼要求鱼体表无损伤,正常摄食,活动性良好。脂多糖(LPS) 购自上海碧云天生物技术有限公司;聚肌胞苷酸(Poly I: C)购自Apexbio公司;TransZol Up Plus RNA Kit、实时荧光定量试剂盒(TransStart Green qPCR SuperMix)购自北京全式金生物技术有限公司;PrimeSTAR HS DNA高保真聚合酶、大肠杆菌DH5α、pMD-18T载体均购于Takara公司。本研究中所使用到的引物序列见表 1,均由生工生物工程(上海)股份有限公司合成。
| 引物Primer | 碱基序列(5′-3′) Nucleotide base sequence (5′-3′) | 作用Function |
| Ec-ERP44-F | CCGCTCGAGCTATGAAACTGTTAGCAATATCTCCCTCT | 基因克隆Gene cloning |
| Ec-EEP44-R | CGCGGATCCCAGCTCGTCGCGGTCCC | 基因克隆Gene cloning |
| Ec-ERP44-RT-F | TACCTCGGCTCACTCACC | 荧光定量PCRReal-time fluorescent quantitative PCR |
| Ec-ERP44-RT-R | CAGGAAGTTTATAGACCCTTT | 荧光定量PCRReal-time fluorescent quantitative PCR |
| 18S-RT-F | ATTGACGGAAGGGCACCACCAG | 内参Internal reference |
| 18S-RT-R | TCGCTCCACCAACTAAGAACGG | 内参Internal reference |
1.2 方法 1.2.1 Ec-ERP44基因的克隆以及载体的构建
依据从斜带石斑鱼转录文库中[20]筛选获得Ec-ERP44基因的开放阅读框(Open Reading Frame, ORF)序列设计特异性引物(表 1),并按照Primer STAR HS DNA高保真聚合酶说明书进行PCR扩增。PCR产物通过琼脂凝胶电泳检测后进行纯化,随后与pMD-18T质粒连接并转化至大肠杆菌DH5α感受态细胞。培养12 h后挑取克隆子,并通过菌液PCR鉴定出阳性克隆,送生工生物工程(上海)股份有限公司进行测序。
1.2.2 总RNA提取和cDNA模板的制备利用TransZol Up Plus RNA Kit试剂盒从斜带石斑鱼中提取外周血淋巴细胞、脾脏、皮、肝脏、心、头肾、肌肉、鳃和脑等9种组织的总RNA,用1%的琼脂糖凝胶电泳检测其完整性,并用Bio.Analyzer 2100生物分析仪来检测总RNA浓度,最后参照说明书进行反转录,获得cDNA模板,储存于-80℃备用。
1.2.3 Ec-ERP44的生物信息学分析对Ec-ERP44基因进行生物信息分析,所使用的生物信息学分析工具及其用途见表 2。
| 分析软件/数据库Analytical software/databases | 用途Use |
| NCBI (ORF Finder) | 查找Ec-ERP44基因开放阅读框及氨基酸序列Searching the open reading frame and amino acid sequence of Ec-ERP44 gene |
| TMHMM Server v.2.0 | 预测ERP44的跨膜结构域Predicating the transmembrane domain of ERP44 |
| ExPASy | 分析ERP44的理论等电点、分子量以及亲水性参数Analyzing the theoretical isoelectric point, molecular weight and hydrophilic parameters of ERP44 |
| NCBI (Protein Blast) | 搜索与ERP44同源性较高的蛋白质序列Searching the protein sequences with high homology to ERP44 |
| Clustal X, MEGA 6.0 | 多序列比对, 构建进化树Multiple sequence alignment,constructing phylogenetic trees |
1.2.4 免疫刺激后斜带石斑鱼Ec-ERP44基因的表达特征分析
将采集的斜带石斑鱼随机分为3组(30尾/组),两组为实验组,一组为对照组。其中,两个实验组分别注射脂多糖(Lipopolysaccharide, LPS, 10 μg/mL)和聚肌胞苷酸(Polyinosinic-polycytidylic acid, Poly I: C, 1 μg/mL),注射剂量均为0.1 mL/尾;对照组注射等量PBS缓冲液。在注射后的0,4,8,12,24,48 h,分别从实验组和对照组中随机采集5尾鱼的脾脏,提取总RNA,制备cDNA,存于-80℃冰箱备用。
将18S作为内参基因(引物见表 1),并用引物Ec-ERP44- RT-F和Ec-ERP44- RT-R(表 1)进行实时定量PCR反应。反应体系为10 μL,包含cDNA模板0.5 μL,上、下游引物(10 μmol/L)各0.5 μL,双蒸水3.5 μL,2×SYBR Green Mix (Roche) 5 μL。每个样品设置5个复孔,反应程序设为95℃,10 s;(95℃,5 s;58℃,15 s;72℃,20 s)×33次。实验结果用2-ΔΔCT法计算,用SPSS 20进行统计学分析。
2 结果与分析 2.1 Ec-ERP44的ORF序列分析Ec-ERP44基因的ORF序列为1 233 bp(图 1),编码410个氨基酸。通过分析,预测Ec-ERP44分子质量为46.84 kDa,等电点(Theoretical pI)为5.36,亲水性平均系数为-0.364,预测其为亲水性蛋白。

|
| 阴影部分指硫氧还蛋白结构域,ATG为起始密码子,TGA* 为终止密码子 The shaded part refers to the thioredoxin domain, where ATG is the start codon and TGA* is the stop codon 图 1 Ec-ERP44基因的ORF及其编码的氨基酸序列 Fig.1 The ORF sequence and encoded amino acid sequence of Ec-ERP44 |
2.2 ERP44蛋白的同源性以及进化树分析
利用Clustal X软件对斜带石斑鱼(Epinephelus coioides)的Ec-ERP44和黄金鲈(Perca flavescens)、大黄鱼(Larimichthys crocea)、尼罗罗非鱼(Oreochromis niloticus)、牙鲆(Paralichthys olivaceus)、斑马拟丽鱼(Maylandia zebra)、青鳉(Oryzias latipes)、斑马鱼(Danio rerio)、热带爪蟾(Xenopus tropicalis)、红原鸡(Gallus gallus)、人类(Homo sapiens)等物种的ERP44进行氨基酸序列比对(图 2),结果显示斜带石斑鱼的Ec-ERP44氨基酸序列与上述物种的高度相似,推测Ec-ERP44基因可能具有协助蛋白折叠、转运以及调控氧化还原反应等生物学功能。

|
| 保守的半胱氨酸用箭头标出,保守的基序用虚线方框标记 The conservative cysteine is indicated with arrowhead, the conserve motifs are marked with dotted box 图 2 不同物种来源的ERP44氨基酸序列比对 Fig.2 Comparison of the amino acid sequence of ERP44 proteins from different species |
基于邻元法(Neighbor-Joining, N-J),利用MEGA 6.0软件构建斜带石斑鱼Ec-ERP44的进化树,结果如图 3。进化树分为两支,其中,斜带石斑鱼Ec-ERP44与鱼类ERP44蛋白聚为一支,并与黄金鲈ERP44蛋白分类地位最接近。
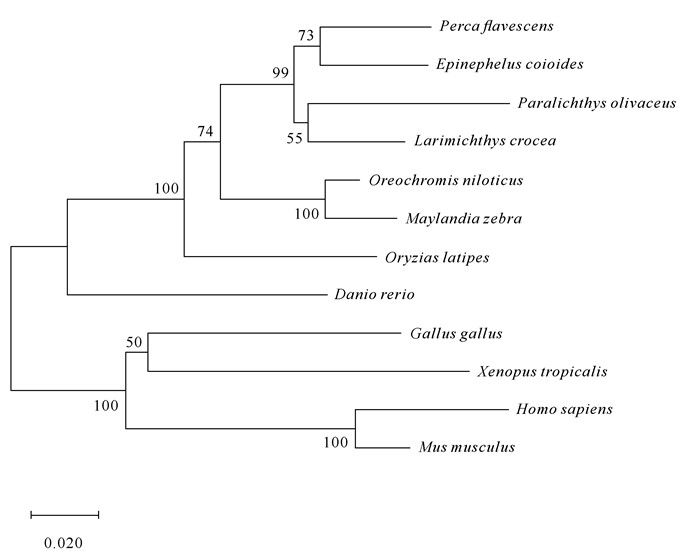
|
| 图 3 基于N-J法构建斜带石斑鱼Ec-ERP44系统进化树 Fig.3 Constructing the phylogenetic tree of E.coioides Ec-ERP44 based on Neighbor-Joining method |
2.3 Ec-ERP44基因组织表达分析
使用荧光定量PCR检测健康斜带石斑鱼的外周血淋巴细胞、脾脏、皮、肝脏、心、头肾、肌肉、鳃和脑等组织中的Ec-ERP44基因表达量,结果如图 4。Ec-ERP44基因在所有检测的组织中均有表达,其中,在脑中的表达量最高,接下来是鳃、头肾、肌肉、心,在外周血淋巴组织中的表达量最低。

|
| PBL: 外周血淋巴细胞;Sp: 脾;Sk: 皮;L: 肝脏;H: 心;M: 肌肉;HK: 头肾;G: 鳃;B: 脑 PBL: Peripheral blood lymphocyte; Sp: Spleen; Sk: Skin; L: Liver; H: Heart; M: Muscle; HK: Head kidney; G: Gill; B: Brain 图 4 Ec-ERP44基因在不同组织中的表达情况 Fig.4 Expression of Ec-ERP44 gene in different tissues |
2.4 Ec-ERP44基因在LPS和Poly I: C刺激后的表达变化
由于鱼类的脾脏是主要的免疫器官,其在鱼类抗感染免疫中发挥着重要作用,因此研究进一步检测了免疫刺激后脾脏中Ec-ERP44基因的表达变化。如图 5所示,在LPS刺激后,脾脏中Ec-ERP44基因在刺激后的表达量显著上调(P < 0.05)并在4 h达到峰值,随后逐渐回复到0 h的表达水平;而在PolyI: C刺激后,脾脏中Ec-ERP44基因的表达量在4 h时显著上调(P < 0.05),在12 h时达到峰值,并在48 h时恢复到0 h的表达水平。
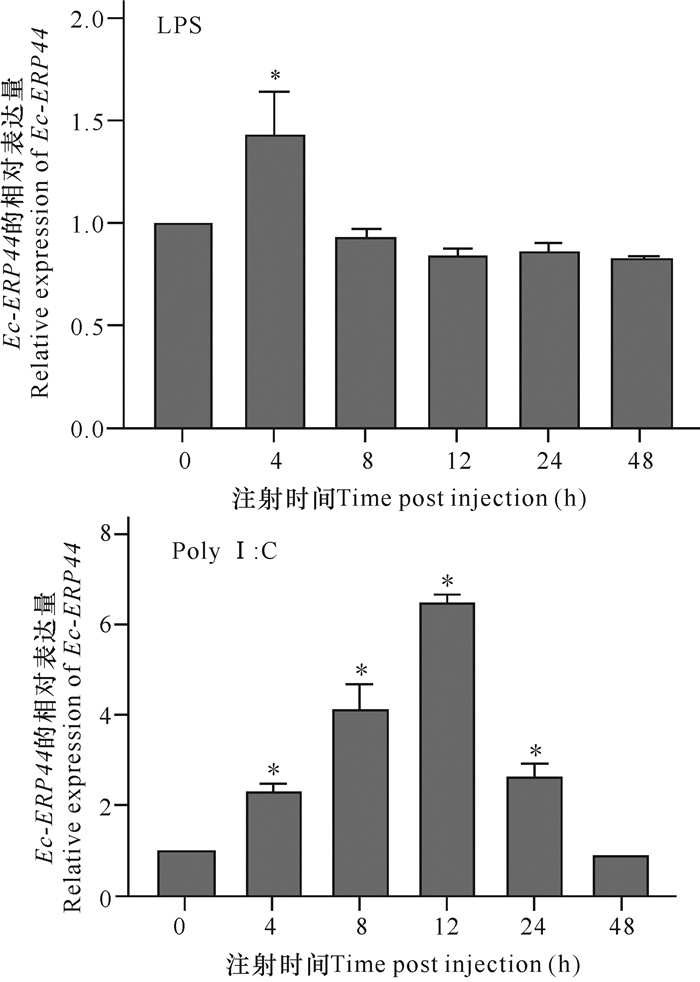
|
| *P<0.05表示差异显著 *P < 0.05 indicates statistically significant 图 5 脂多糖(LPS)和聚肌胞苷酸(Poly I: C)刺激后脾脏中Ec-ERP44基因的表达变化 Fig.5 Expression profiles of Ec-ERP44 in spleen after LPS and Poly I: C stimulation |
3 讨论
在本课题组前期的研究工作中,已构建了斜带石斑鱼转录组文库[20]。本研究基于文库中的ERP44基因序列设计引物,成功克隆了斜带石斑鱼的Ec-ERP44基因。生物信息学分析显示Ec-ERP44基因的ORF编码410个氨基酸,其所编码的蛋白含有ERP44蛋白家族典型的硫氧还蛋白结构与保守的CRFS催化基序,其中二硫键异构酶PDI结构域有助于维持ERP44蛋白的结构,CRFS结构域与该蛋白调节氧化应激的功能息息相关[21]。而ERP44蛋白C端的RDEL保守基序则能帮助ERP44定位在内质网腔内[7]。此外,Ec-ERP44基因还含有硫醇硫氧还蛋白家族中高度保守的CXXC基序,该基序中的半胱氨酸在维持蛋白质二硫键异构酶的活性中发挥着重要的作用[22]。氨基酸序列比对表明, Ec-ERP44与其他物种的ERP44高度相似,因此可以推断出Ec-ERP44与已经报道的ERP44蛋白具有相似的生物学功能。
在健康石斑鱼体内,Ec-ERP44基因在脑和鳃的表达量较高,这与Liyanage等[19]的研究结果类似。Ec-ERP44基因在脑中的高表达可能是由于其所编码蛋白能与葡萄糖调节蛋白78(Glucose-regulated protein 78,GRP78)发生相互作用,从而调控Ⅰ型肌醇1, 4, 5-三磷酸受体(Inositol 1, 4, 5-trisphosphate receptors 1,IP3R1)介导的内质网应激途径引起神经细胞死亡[23]。鳃分泌粘液中含有的免疫球蛋白能阻止水体中病原的侵染[24],且ERP44参与了免疫球蛋白单体转化为多聚体的过程[25],因此Ec-ERP44基因在鳃中的高表达可能与鳃中黏液分泌有关。在LPS以及Poly I: C的刺激后,石斑鱼脾脏中Ec-ERP44基因表达上调,与海马ERP44基因的研究结果[19]一致,表明该基因可能参加了宿主的抗病免疫。细胞在受到LPS以及Poly I: C刺激后产生内质网应激,进而能引起未折叠蛋白反应(UPR),以激活下游的NF-κB转录调控因子,从而调控炎症因子的表达。但是,当细胞发生过度的内质网应激时,内质网功能就会受损;在肌醇需要酶1(IRE1)、激活转录因子6(ATF6)以及蛋白激酶R样内质网激酶(PERK)信号的作用下,细胞启动由内质网应激所介导的凋亡途径,从而导致机体发生病变[26]。因此,推测Ec-ERP44基因可能通过调控细胞凋亡与免疫因子的表达来影响鱼体的抗感染免疫,这个假设将在下一步的研究中进行验证。
4 结论本研究对Ec-ERP44基因进行克隆与生物信息学分析,结果表明Ec-ERP44蛋白含有二硫键异构酶(PDI)家族保守的硫氧还蛋白结构域及特征性的半胱氨酸。Ec-ERP44基因在所有检测组织中均有表达,其中在脑与鳃中的表达量较高,且在LPS和Poly I: C刺激后,脾脏中Ec-ERP44基因表达上调。本研究结果为进一步了解ERP44基因在免疫反应中的作用奠定了基础,同时也为探究内质网应激途径在鱼类抗感染免疫中的作用提供了参考。
| [1] |
WEI J, LI C, OU J, et al. The roles of grouper TANK in innate immune defense against iridovirus and nodavirus infections[J]. Fish and Shellfish Immunology, 2020, 104: 506-516. DOI:10.1016/j.fsi.2020.06.017 |
| [2] |
HETZ C, ZHANG K, KAUFMAN R J. Mechanisms, regulation and functions of the unfolded protein response[J]. Nature Reviews Molecular Cell Biology, 2020, 21(8): 421-438. DOI:10.1038/s41580-020-0250-z |
| [3] |
CORTINI M, SITIA R. From antibodies to adiponectin: Role of ERp44 in sizing and timing protein secretion[J]. Diabetes, Obesity and Metabolism, 2010, 12(Supp 12): 39-47. |
| [4] |
ANELLI T, ALESSIO M, BACHI A, et al. Thiol-mediated protein retention in the endoplasmic reticulum: The role of ERp44[J]. The EMBO Journal, 2003, 22(19): 5015-5022. DOI:10.1093/emboj/cdg491 |
| [5] |
ALLOZA I, BAXTER A, CHEN Q, et al. Celecoxib inhibits interleukin-12 alphabeta and beta2 folding and secretion by a novel COX2-independent mechanism involving chaperones of the endoplasmic reticulum[J]. Molecular Pharmacology, 2006, 69(5): 1579-1587. DOI:10.1124/mol.105.020669 |
| [6] |
QIANG L, WANG H, FARMER S R. Adiponectin secretion is regulated by SIRT1 and the endoplasmic reticulum oxidoreductase Ero1-L alpha[J]. Molecular and Cellular Biology, 2007, 27(13): 4698-4707. DOI:10.1128/MCB.02279-06 |
| [7] |
FRALDI A, ZITO E, ANNUNZIATA F, et al. Multistep, sequential control of the trafficking and function of the multiple sulfatase deficiency gene product, SUMF1 by PDI, ERGIC-53 and ERp44[J]. Human Molecular Genetics, 2008, 17(17): 2610-2621. DOI:10.1093/hmg/ddn161 |
| [8] |
ANELLI T, ALESSIO M, MEZGHRANI A, et al. ERp44, a novel endoplasmic reticulum folding assistant of the thioredoxin family[J]. The EMBO Journal, 2002, 21(4): 835-844. DOI:10.1093/emboj/21.4.835 |
| [9] |
OTSU M, BERTOLI G, FAGIOLI C, et al. Dynamic retention of Ero1alpha and Ero1beta in the endoplasmic reticulum by interactions with PDI and ERp44[J]. Antioxidants and Redox Signaling, 2006, 8(3/4): 274-282. |
| [10] |
HIGO T, HATTORI M, NAKAMURA T, et al. Subtype-specific and ER lumenal environment-dependent regulation of inositol 1, 4, 5-trisphosphate receptor type 1 by ERp44[J]. Cell, 2005, 120(1): 85-98. DOI:10.1016/j.cell.2004.11.048 |
| [11] |
ANELLI T, CEPPI S, BERGAMELLI L, et al. Sequential steps and checkpoints in the early exocytic compartment during secretory IgM biogenesis[J]. The EMBO Journal, 2007, 26(19): 4177-4188. DOI:10.1038/sj.emboj.7601844 |
| [12] |
KAKIHANA T, ARAKI K, VAVASSORI S, et al. Dynamic regulation of Ero1α and peroxiredoxin 4 localization in the secretory pathway[J]. Journal of Biological Chemistry, 2013, 288(41): 29586-29594. DOI:10.1074/jbc.M113.467845 |
| [13] |
HEBERT D N, MOLINARI M. In and out of the ER: Protein folding, quality control, degradation, and related human diseases[J]. Physiological Reviews, 2007, 87(4): 1377-1408. DOI:10.1152/physrev.00050.2006 |
| [14] |
CSALA M, MARGITTAI É, BÁNHEGYI G. Redox control of endoplasmic reticulum function[J]. Antioxidants and Redox Signaling, 2010, 13(1): 77-109. DOI:10.1089/ars.2009.2529 |
| [15] |
TEMPIO T, ANELLI T. The pivotal role of ERp44 in patrolling protein secretion[J]. J Cell Sci, 2020, 133(21): jcs240366. DOI:10.1242/jcs.240366 |
| [16] |
NYIRIMIGABO E, JIN M, YANG Z, et al. The role of ERp44 in glucose and lipid metabolism[J]. Archives of Biochemistry and Biophysics, 2019, 671: 175-184. DOI:10.1016/j.abb.2019.06.011 |
| [17] |
ANELLI T, SANNINO S, SITIA R. Proteostasis and "redoxtasis" in the secretory pathway: Tales of tails from ERp44 and immunoglobulins[J]. Free Radic Biol Med, 2015, 83: 323-330. DOI:10.1016/j.freeradbiomed.2015.02.020 |
| [18] |
TIAN H, SHI S, YOU B, et al. ER resident protein 44 promotes malignant phenotype in nasopharyngeal carcinoma through the interaction with ATP citrate lyase[J]. Journal of Translational Medicine, 2021, 19(1): 77. DOI:10.1186/s12967-020-02694-1 |
| [19] |
LIYANAGE D S, OMEKA W K M, L E E J. Molecular characterization, host defense mechanisms, and functional analysis of ERp44 from big-belly seahorse: A novel member of the teleost thioredoxin family present in the endoplasmic reticulum[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2019, 232: 31-41. DOI:10.1016/j.cbpb.2019.02.006 |
| [20] |
张海艳, 鲁义善, 汪志文, 等. β-葡聚糖刺激下的斜带石斑鱼(Epinephelus coioides)转录组分析[J]. 基因组学与应用生物学, 2018, 37(1): 219-228. |
| [21] |
FREEDMAN R B, KLAPPA P, RUDDOCK L W. Protein disulfide isomerases exploit synergy between catalytic and specific binding domains[J]. EMBO Reports, 2002, 3(2): 136-140. DOI:10.1093/embo-reports/kvf035 |
| [22] |
NØRGAARD P, WINTHER J R. Mutation of yeast Eug1p CXXS active sites to CXXC results in a dramatic increase in protein disulphide isomerase activity[J]. The Biochemical Journal, 2001, 358(Pt 1): 269-274. |
| [23] |
HIGO T, HAMADA K, HISATSUNE C, et al. Mechanism of ER stress-induced brain damage by IP(3) receptor[J]. Neuron, 2010, 68(5): 865-878. DOI:10.1016/j.neuron.2010.11.010 |
| [24] |
PRESS C M, EVENSENØ. The morphology of the immune system in teleost fishes[J]. Fish and Shellfish Immunology, 1999, 9(4): 309-318. DOI:10.1006/fsim.1998.0181 |
| [25] |
FRA A M, FAGIOLI C, FINAZZI D, et al. Quality control of ER synthesized proteins: An exposed thiol group as a three-way switch mediating assembly, retention and degradation[J]. The EMBO Journal, 1993, 12(12): 4755-4761. DOI:10.1002/j.1460-2075.1993.tb06164.x |
| [26] |
范敏, 郑文兰. 内质网应激介导滋养细胞凋亡信号通路的研究进展[J]. 贵阳中医学院学报, 2019, 41(3): 87-90. |



