有孔团水虱(Sphaeroma terebrans Bate, 1866)隶属于节肢动物门(Arthropoda)甲壳动物亚门(Crustacea)软甲纲(Malacostraca)等足目(Isopoda)团水虱科(Sphaeromatidae)团水虱属(Sphaeroma)[1]。近年来,广西北海市小冠沙、垌尾和海南东寨港等地相继出现了团水虱暴发致使红树林大规模死亡的现象,危害严重[2, 3]。经调查发现,危害广西红树林的种类主要为有孔团水虱[4]。当前,团水虱生物学特征的相关研究已有报道[5, 6],其繁殖生物学的研究也略有涉及,主要是基于宏观现象观察得出的结论[5, 7, 8]。李秀峰[5]研究海南东寨港有孔团水虱的抱卵率、繁殖群体组成、繁殖力等宏观数据,得出东寨港有孔团水虱全年都可以繁殖的结论,这一结论与Thiel[7]研究美国佛罗里达红树林区有孔团水虱的结论一致。然而,从微观生物学的角度,通过观察团水虱的卵子发生,进行其繁殖特性的研究尚未见报道。本文采用组织切片技术,探究广西红树林区有孔团水虱的卵子发生过程,并结合幼虫的观察结果,探讨其繁殖期时间,以期为团水虱的防控、消杀和保护红树林生态系统提供科学依据。
1 材料与方法 1.1 材料有孔团水虱,取自广西北海小冠沙红树林(21°24′51.35″N,109°10′18.28″E)的白骨壤枯死树干,随机选取并截断树干,收集其内的有孔团水虱。采样时间:2017年9月-2018年8月。2017年9月-2018年3月,约每半个月采集样品1次;2018年4-8月,约每个月采集样品1次,共采集到15批次的有孔团水虱样品。采集样品的同时,记录当天的采样地上是否存在该物种幼虫。
样品带回实验室,每批次分别随机选取个体完整的成体100只,置于广口瓶中,Bouin's固定液固定7 d,无水乙醇浸泡洗涤3次,然后保存于无水乙醇中待用。
1.2 方法从每批有孔团水虱样品中随机挑选雌性成体4个,参考芮菊生等[9]的方法,经脱水、透明、石蜡包埋后,徕卡RM2235切片机切片(厚度6 μm),苏木精-伊红(H-E)染色,中性树胶封片。组织切片在Olympus BX51生物显微镜下观察并照相。
2 结果与分析 2.1 卵子发生根据组织切片观察结果,将有孔团水虱的卵子发生划分为4个时期:卵原细胞、无卵黄卵母细胞、卵黄发生卵母细胞和成熟期卵母细胞。
2.1.1 卵原细胞(Oogonium, OG)卵原细胞呈卵圆形或不规则形,体积小,长径10-17 μm,短径8-14 μm。细胞核多呈卵圆形或不规则形,一般位于细胞的中央,长径4-9 μm,短径3-9 μm;核占据细胞的绝大部分;核质比较大。细胞质稀薄而少(图 1a)。
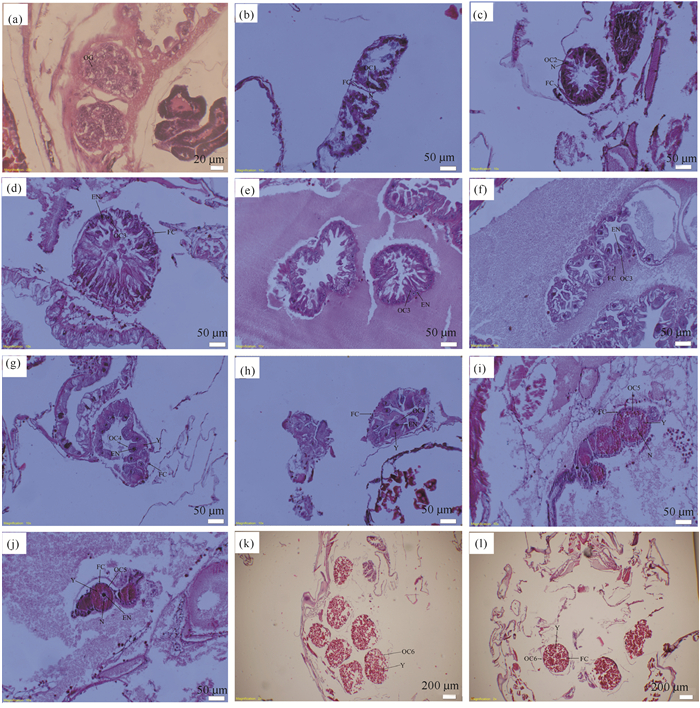
|
| a、OG: 卵原细胞; b、OC1:前期无卵黄卵母细胞; c、OC2:中期无卵黄卵母细胞; d、e、f、OC3:后期无卵黄卵母细胞; g、h、OC4:卵黄开始沉积时相的卵母细胞; i、j、OC5:卵黄充满时相的卵母细胞; k、l、OC6:成熟期卵母细胞; EN:核仁; FC:滤泡细胞; N:细胞核; Y:卵黄颗粒 a, OG: Oogonium; b, OC1:Prophase of alecithic oocyte; c, OC2:Metaphase of alecithic oocyte; d, e, f, OC3:Anaphase of alecithic oocyte; g, h, OC4:Oocyte at the beginning of yolk deposition; i, j, OC5:Oocyte filled with yolk; k, l, OC6:Mature oocyte; EN: Nuleolus; FC: Follicle cell; N: Cell nucleus; Y: Yolk 图 1 广西红树林区有孔团水虱卵子发生的组织学 Fig.1 Histology of oocyte(embryos) of Sphaeroma terebrans in Guangxi mangrove area |
2.1.2 无卵黄卵母细胞(Alecithic oocyte)
根据细胞的大小和形状、细胞核与核仁的形态等,将本时期分为前期、中期和后期3个亚期。
2.1.2.1 前期无卵黄卵母细胞(OC1)卵母细胞形状不规则,体积增大约1倍,长径15-32 μm,短径12-26 μm。细胞核呈圆形或椭圆形,位于细胞的一侧,长径10-17 μm,短径7-15 μm,其最显著的变化就是体积膨大。此时期的细胞核为生发泡,细胞的核质比在各时期卵细胞中最大。细胞质少量增长,嗜碱性增强。卵母细胞周边出现稀疏的椭圆形滤泡细胞(图 1b)。
2.1.2.2 中期无卵黄卵母细胞(OC2)卵母细胞形状不规则,多接近长条状,体积明显增大,长径28-43 μm,短径8-25 μm。细胞核椭圆形、圆形或不规则,体积变小,位于卵母细胞靠近卵巢壁的部位,长径11-22 μm,短径6-13 μm。细胞质明显增多,呈嗜碱性。滤泡细胞零星分布,体积略有增大,形状不规则(图 1c)。
2.1.2.3 后期无卵黄卵母细胞(OC3)卵母细胞由近长条形逐渐膨大变成近椭圆形、圆形或不规则形,长径32-66 μm,短径8-28 μm。细胞核长径12-21 μm,短径8-13 μm。当细胞处于初始的近长条形时,细胞核呈圆形或椭圆形,位置靠近卵巢壁的细胞基部,核质比大大降低。核仁清晰可见,位于细胞核的中央或一侧,呈卵圆形,嗜碱性较强。核内染色质减少,核质染色变浅,嗜碱性减弱。核膜清晰可见。细胞质嗜碱性减弱(图 1d、图 1e)。
当细胞逐渐膨大,细胞核逐渐向细胞另一端接近,有些细胞的核与核仁的形状变得不规则,部分细胞的核仁开始解体消失,细胞核染色变浅,嗜碱性减弱,部分细胞的核膜开始变模糊。细胞质嗜碱性减弱。颗粒状滤泡细胞呈不规则,排列仍较为稀疏(图 1f)。
2.1.3 卵黄发生卵母细胞(Vitellogenic oocyte)根据卵黄物质的积累量情况,本文将其分为2个亚期——卵黄开始沉积时相的卵母细胞和卵黄充满时相的卵母细胞。
2.1.3.1 卵黄开始沉积时相的卵母细胞(OC4)卵母细胞体积有所增长但程度不大,长径40-62 μm,短径23-44 μm。此期细胞核和核仁的特点较后期无卵黄卵母细胞(OC3)变化不明显,核的长径19-30 μm,短径12-21 μm。细胞质增多,嗜酸性增强。该时期靠近卵巢壁附近的细胞,其边缘开始有少量卵黄颗粒沉积,嗜酸性,呈淡粉红色。滤泡细胞增多并逐渐排列紧密(图 1g、图 1h)。
2.1.3.2 卵黄充满时相的卵母细胞(OC5)卵母细胞形状不规则,多为近圆形或椭圆形,体积显著增大,长径54-163 μm,短径42-158 μm。细胞核呈圆形或不规则形,偏位,核膜模糊,嗜碱性减弱,染色变浅,有的细胞没有观察到细胞核或其核仁的存在。细胞质中充满大量的卵黄颗粒且几乎占据整个细胞质,嗜酸性显著增强,染色变深。滤泡细胞呈圆形、椭圆形或形状不规则,数量多,排列紧密并完全包围每个卵母细胞并形成单层滤泡腔,且与卵母细胞的卵周隙极小(图 1i、图 1j)。
2.1.4 成熟期卵母细胞(Mature oocytes,OC6)卵母细胞呈圆形、椭圆形或形状不规则,体积相比前一时期的卵母细胞显著增大数倍,长径376-573 μm,短径317-462 μm。没有发现细胞核存在。卵黄颗粒大量增加,几乎占据整个细胞质,嗜酸性增强,呈深红色。滤泡细胞大量消失(图 1k、图 1l)。
2.2 有孔团水虱体内不同时期卵子的周年变化及其繁殖期表 1为经过组织切片观察后得出的有孔团水虱体内卵子的周年变化情况。由表 1可见,只有5只个体体内仅含某一个时期的卵子或胚胎,其余个体均含2个或2个以上时期的卵子或胚胎,表明有孔团水虱卵细胞是分批成熟的。除了2月和3月的2次采样外,其余月份的有孔团水虱个体体内都存在成熟期卵母细胞或胚胎。
| 采样日期 Sampling date |
个体编号 Individual number |
卵母细胞(胚胎)时期Stages of oocyte (embryos) | |||||||
| OG | OC1 | OC2 | OC3 | OC4 | OC5 | OC6 | EM | ||
| 2017-09-20 | 1-2 | + | + | ||||||
| 1-3 | + | + | |||||||
| 1-4 | + | + | + | ||||||
| 2017-10-10 | 2-1 | + | + | ||||||
| 2-2 | + | ||||||||
| 2017-10-27 | 3-1 | + | + | + | |||||
| 3-2 | + | + | + | ||||||
| 3-4 | + | + | + | ||||||
| 2017-11-16 | 4-1 | + | + | ||||||
| 4-2 | + | + | |||||||
| 4-3 | + | ||||||||
| 4-4 | + | + | + | ||||||
| 2017-12-08 | 5-2 | + | + | + | |||||
| 5-4 | + | + | + | ||||||
| 2017-12-30 | 6-1 | + | + | + | + | + | + | + | |
| 6-2 | + | + | + | + | |||||
| 6-3 | + | + | + | ||||||
| 6-4 | + | + | + | ||||||
| 2018-01-18 | 7-1 | + | + | ||||||
| 7-3 | + | + | + | + | |||||
| 7-4 | + | ||||||||
| 2018-02-07 | 8-1 | + | + | + | + | ||||
| 8-2 | + | + | + | ||||||
| 8-3 | + | + | + | ||||||
| 8-4 | + | + | + | + | |||||
| 2018-02-27 | 9-1 | + | + | + | |||||
| 9-2 | + | + | + | ||||||
| 9-3 | + | + | + | + | + | ||||
| 9-4 | + | + | + | ||||||
| 2018-03-18 | 10-1 | + | + | + | |||||
| 10-2 | + | + | + | ||||||
| 10-3 | + | + | + | + | |||||
| 10-4 | + | + | + | ||||||
| 2018-04-10 | 11-1 | + | + | + | + | ||||
| 11-2 | + | + | + | + | |||||
| 11-3 | + | + | + | ||||||
| 11-4 | + | + | + | + | + | ||||
| 2018-05-13 | 12-1 | + | |||||||
| 12-4 | + | + | + | ||||||
| 2018-06-15 | 13-1 | + | + | + | + | ||||
| 13-2 | + | + | + | ||||||
| 13-3 | + | + | + | ||||||
| 13-4 | + | + | + | ||||||
| 2018-07-17 | 14-1 | + | + | + | |||||
| 14-2 | + | + | + | + | |||||
| 2018-08-19 | 15-1 | + | + | + | + | + | + | ||
| 15-3 | + | ||||||||
| 15-4 | + | + | |||||||
| 注:+表示该个体体内存在该时期的卵母细胞或胚胎; OG:卵原细胞; OC1:前期无卵黄卵母细胞; OC2:中期无卵黄卵母细胞; OC3:后期无卵黄卵母细胞; OC4:卵黄开始沉积时相的卵母细胞; OC5:卵黄充满时相的卵母细胞; OC6:成熟期卵母细胞; EM:胚胎 Note: +indicates the presence of oocytes or embryos from that period in the body of the individual;OG:Oogonium;OC1:Prophase of alecithic oocyte;OC2:Metaphase of alecithic oocyte;OC3:Anaphase of alecithic oocyte;OC4:Oocyte at the beginning of yolk deposition;OC5:Oocyte filled with yolk;OC6:Mature oocyte;EM:Embryos |
|||||||||
2018年2月27日、3月18日和4月10日的3次采样中,采样地树干上未发现有孔团水虱的幼虫,其他采样时期均发现有孔团水虱幼虫的存在——每个洞穴中的幼虫数量少则几只,多则有30多只,且幼虫群的旁边会伴有1只成年雌性有孔团水虱(图 2)。
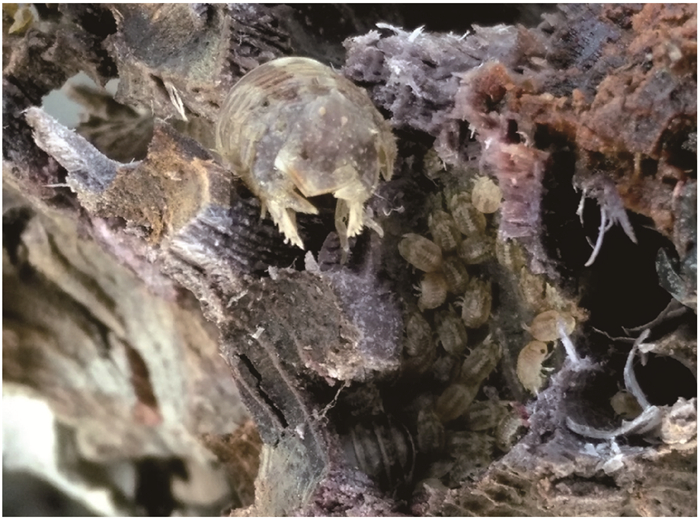
|
| 图 2 广西红树林区有孔团水虱的幼体 Fig.2 Larvae of Sphaeroma terebrans in Guangxi mangrove area |
结合有孔团水虱体内卵子的周年变化情况以及幼体存在的情况,基本可以判断:广西红树林区有孔团水虱的繁殖期为每年的4月至次年的1月。
3 讨论 3.1 卵子发生分期依据与方法目前,划分甲壳动物卵子发生过程的方法会因不同的分期依据而不同,主要有2种划分方法:一种方法的分期依据是卵细胞的大小、卵细胞的核质比等。卵细胞被分为卵原细胞、小生长期的初级卵母细胞、大生长期的初级卵母细胞以及成熟期的卵母细胞等阶段[10-12]。另外一种方法的分期依据为卵黄物质的起源和形成变化情况等。卵细胞被分为卵原细胞、内源性与外源性卵黄合成期的卵母细胞以及成熟期的卵母细胞等阶段[13-16]。本研究采用第一种划分方法。
在有孔团水虱的卵子发生过程中,其卵细胞的形态、大小、细胞核、细胞质以及卵黄合成等情况都发生了明显的变化。卵母细胞的形态由初始的卵圆形逐渐变成条状或片状等不规则形状,随着体积继续增大, 其形状又慢慢接近圆形,最终成熟的卵母细胞一般为圆形或者椭圆形。核质比初始时较大,当核质比进一步增大到最大值时,又逐渐减小,随着卵母细胞不断趋于成熟,有的卵母细胞的细胞核未被发现,直至卵母细胞成熟时,所有卵母细胞的细胞核都未能被发现。卵黄颗粒的逐渐积累使得细胞体积不断变大,其由靠近卵巢壁一端的位置开始由少而多地沉积,直至最终几乎充满整个卵母细胞。滤泡细胞由无变有,由稀疏分布变为紧密包围每个卵母细胞。综合上述过程的变化情况,本研究将有孔团水虱的卵子发生划分为卵原细胞、无卵黄卵母细胞、卵黄发生卵母细胞和成熟期卵母细胞4个阶段。
3.2 成熟卵母细胞的界定成熟卵母细胞的界定对于判断其能否进行受精和胚胎的发育,进而判定该物种是否进入繁殖期有重要意义。界定不同甲壳动物成熟卵母细胞的依据也各有不同:东方扁虾(Thenus orientalis)成熟卵细胞的判断依据是髓样小体出现于卵黄内,以及卵壳的形成等[13];凡纳滨对虾(Litopenaeus vannamei)和长毛对虾(Penaeus penicillatus)则是以卵母细胞的周边位置出现皮质棒且细胞核消失作为卵母细胞成熟的标志[17, 18];锯缘青蟹(Scylla serrata)的细胞核将要消失是其卵母细胞成熟的标志[19];中国龙虾(Panulirus stimpsoni)成熟卵母细胞的标志则是卵黄颗粒几乎充满整个细胞,核消失,次级卵膜和卵黄膜出现[12]。本研究中,有孔团水虱卵母细胞成熟标志是未见细胞核,卵黄颗粒几乎充满整个细胞,卵母细胞体积达到最大值,这与中国龙虾、中华锯齿米虾(Neocaridina denticulata sinensis)、日本新糠虾(Neomysis japonica)、武湖日本沼虾(Macrobrachium nipponensis)等[10, 12, 20, 21]的成熟卵母细胞有相似之处。
3.3 有孔团水虱的繁殖期本研究结果显示,除2月和3月2次采样的有孔团水虱个体外,其余月份的个体体内都存在成熟期卵母细胞或胚胎。此外,除2018年2月27日、3月18日和4月10日的3次采样中没有在采样地树干上发现有孔团水虱的幼虫外,其他采样时期中均发现幼虫,故有孔团水虱的繁殖期为每年的4月至次年的1月。该结论与文献[2, 7]报道的有孔团水虱全年均可繁殖的结论不一致。并且该结论与李秀锋[5]的有孔团水虱的繁殖力程度在3月最大的结论相悖。这可能是各个研究的团水虱其分布地点不同造成的,不同地方其环境因子不同,故有孔团水虱的繁殖习性也可能出现差异。有研究发现,温度是影响有孔团水虱繁殖习性的主要因素[7, 22],栖息地不同温度差异比较大时,团水虱的繁殖期就会有所不同。海南东寨港常年平均温度比广西北海高,这可能是东寨港有孔团水虱全年都可以繁殖的原因。这种因栖息地温度的差异对甲壳动物广布种繁殖期的影响是很常见的现象。此外,有孔团水虱的繁殖习性还可能受到海水盐度等其他环境因子的影响[7],这方面影响机制还有待进一步研究。根据广西北海红树林区有孔团水虱2-3月不能繁殖的特性,在开展团水虱防控时,建议在每年的2-3月对红树林区的有孔团水虱采取消杀措施,这样才能大量扑灭有孔团水虱成体,防止有孔团水虱再次进入繁殖期而大量暴发。
4 结论本次调查表明,广西北海市小冠沙红树林区有孔团水虱雌性体内全年存在着各时期的卵母细胞或胚胎;2-3月无成熟期卵母细胞或胚胎出现。结果显示,有孔团水虱的繁殖期为每年的4月至次年的1月。该结论可为广西北海市小冠沙红树林区有孔团水虱的防治与消杀提供参考。
| [1] |
于海燕. 中国扇肢亚目(甲壳动物: 等足目)的系统分类学研究[D]. 青岛: 中国科学院研究生院(海洋研究所), 2002.
|
| [2] |
范航清, 刘文爱, 钟才荣, 等. 中国红树林蛀木团水虱危害分析研究[J]. 广西科学, 2014, 21(2): 140-146, 152. |
| [3] |
林华文, 林卫海. 团水虱对东寨港红树林的危害及防治对策[J]. 热带林业, 2013, 41(4): 35-36. DOI:10.3969/j.issn.1672-0938.2013.04.012 |
| [4] |
陈颖, 杨明柳, 高霆炜, 等. 广西团水虱的种类组成及其对红树林的生态效应初探[J]. 广西科学, 2019, 26(3): 315-323. |
| [5] |
李秀锋. 中国红树林团水虱生物学和行为学特性研究[D]. 广州: 中山大学, 2017.
|
| [6] |
杨玉楠, MYAT T, 刘晶, 等. 危害我国红树林的团水虱的生物学特征[J]. 应用海洋学学报, 2018, 37(2): 211-217. DOI:10.3969/J.ISSN.2095-4972.2018.02.008 |
| [7] |
THIEL M. Reproductive biology of a wood-boring isopod, Sphaeroma terebrans, with extended parental care[J]. Marine Biology, 1999, 135(2): 321-333. DOI:10.1007/s002270050630 |
| [8] |
MURATA Y, WADA K. Population and reproductive biology of an intertidal sandstone-boring isopod, Sphaeroma wadai Nunomura, 1994[J]. Journal of Natural History, 2002, 36(1): 25-35. DOI:10.1080/00222930110087401 |
| [9] |
芮菊生, 杜懋琴, 陈海明, 等. 组织切片技术[M]. 北京: 高等教育出版社, 1980.
|
| [10] |
范成功. 中华锯齿米虾性腺发育与生殖细胞发生[D]. 保定: 河北大学, 2007.
|
| [11] |
薛鲁征, 堵南山, 赖伟. 中华绒螯蟹(Eriocheir sinensis)雌性生殖系统的组织学研究[J]. 华东师范大学学报: 自然科学版, 1987(3): 88-97. |
| [12] |
颜素芬, 姜永华. 中国龙虾卵子发生及卵巢发育的组织学研究[J]. 海洋科学, 2009, 33(6): 12-17. |
| [13] |
朱冬发, 王桂忠, 李少菁. 东方扁虾卵子发生的超微结构[J]. 水生生物学报, 2006, 30(4): 439-445. DOI:10.3321/j.issn:1000-3207.2006.04.012 |
| [14] |
BOMIRSKI A, KLEK-KAWIИSKA E. Stimulation of oogenesis in the sand shrimp, Crangon crangon, by a human gonadotrophin[J]. General and Comparative Endocrinology, 1976, 30(3): 239-242. DOI:10.1016/0016-6480(76)90074-5 |
| [15] |
KANZAWA T, SAWADA M, KATO K, et al. Oogenesis and ovarian development cycle of the spiny lobster Panulirus japonicus (Decapoda: Palinuridae)[J]. Marine and Freshwater Research, 1997, 48(8): 875-888. DOI:10.1071/MF97170 |
| [16] |
颜素芬, 姜永华. 南美白对虾卵巢结构及发育的组织学研究[J]. 海洋湖沼通报, 2004(2): 52-58. DOI:10.3969/j.issn.1003-6482.2004.02.008 |
| [17] |
姜永华, 颜素芬. 南美白对虾卵子发生的组织学[J]. 动物学杂志, 2004, 39(4): 59-62. DOI:10.3969/j.issn.0250-3263.2004.04.013 |
| [18] |
洪水根, 林加涵, 陈细法, 等. 长毛对虾卵子发生的研究——Ⅰ.卵子发生过程[J]. 海洋与湖沼, 1988, 19(4): 301-306, 401-403. |
| [19] |
上官步敏, 刘正琮, 李少菁. 锯缘青蟹卵巢发育的组织学观察[J]. 水产学报, 1991, 15(2): 96-101. |
| [20] |
杨筱珍, 王金峰, 杨丽娜, 等. 日本新糠虾(Neomysis japonica)卵巢发育与卵子发生[J]. 海洋与湖沼, 2009, 40(3): 338-346. DOI:10.3321/j.issn:0029-814X.2009.03.014 |
| [21] |
何绪刚, 张训蒲, 龚世园, 等. 武湖日本沼虾卵巢发育研究[J]. 华中农业大学学报, 2002, 21(2): 148-151. |
| [22] |
BRUSCA R C. Guide to the marine isopod crustaceans of the Caribbean[J]. The Quarterly Review of Biology, 1989, 66(1): 98-99. |



