海草床由大面积的连片海草植物组成,它与珊瑚礁、红树林共同构成了三大典型海洋生态系统[1]。海草床通常位于近海、河口、海湾和潟湖沿岸浅水区域,其全球分布面积仅约占海洋的0.05%,但却贡献了海洋1%的净初级生产力,具有极高的生态服务价值[2]。结构复杂的海草床既是大量海洋水生动物的重要育幼场所[3, 4],又是近岸鱼类、小型腹足类、多毛类和头足类等的良好产卵场所[5, 6]。两栖类和海洋无脊椎动物通常将卵粒包被在凝胶状基质或革质卵囊中,形成卵块,可以降低早期发育风险[7-10]。潮间带海洋生物对产卵基质(Oviposition substrate)的选择影响卵块的发育,大量腹足动物将其凝胶状的卵块或者具卵囊的卵块附着于海草叶片上,例如葡萄螺(Haminoea vesicula)[11]。Dassow和Strathmann[12]发现,与贝壳和绿藻叶片相比,鳗草(Zostera marina)叶片上葡萄螺的黏性卵块数量最高,并且在室外实验发现卵块数量和成体产卵数量均随着人造鳗草的增加而增加。同时,鳗草显著影响其叶片附着卵块的发育率、孵出的幼体大小和附着卵块受细菌污染的程度[11]。
广西北部湾海草床主要分布在北海铁山港与防城港珍珠湾[13]。日本鳗草是我国分布范围最广的海草种类,是中国南方最主要的海草种类之一,也是广西珍珠湾的优势海草种类[13-15]。目前我国海草床的产卵场功能研究较少,针对广西珍珠湾海草床产卵育幼方面的研究仍是空白[16]。
本研究通过采集广西珍珠湾海域日本鳗草叶片附着卵块(本研究中“卵块”是指单个包含多个卵粒的凝胶状或革质卵囊),分析海草床叶片附着卵块的季节变化和分布特征,同时探究日本鳗草总植株密度、地上生物量、平均叶长、单株叶面积等海草群落结构指标对卵块分布的影响,以期明确叶片附着卵块与珍珠湾日本鳗草群落结构的关系,为该海域海草床的保护提供科学依据。
1 材料与方法 1.1 样品采集与处理广西防城港珍珠湾位于北部湾海域,呈漏斗状,面积94.2 km2。该海湾全年平均气温22.5℃,年均降雨量为2 220.5 mm,集中于夏季(6-8月),是广西沿海降雨量较丰富的地区[17]。
日本鳗草是我国分布范围最广、生长纬度跨度最大的海草种类,也是广西珍珠湾的优势海草种类,生长在珍珠湾红树林外的广阔潮间带[14, 15]。2019年12月(冬季)、2020年5月(春季)和7月(夏季),在珍珠湾日本鳗草(Zostera japonica)海草床面积较大的斑块内,随机均匀设置9个固定采样点(各采样点间隔20 m),每个点采集25 cm×25 cm的所有海草(图 1)。2020年9月后实验区日本鳗草群落地上部分衰退消失,故未进行秋季海草叶片附着卵块采集。
|
| 图 1 研究地点位置 Fig.1 Location of the study site |
将海草组织与附着卵块的叶片带回实验室后,用镊子把卵块从叶片上小心地剥离,分放到冻存管中,用5%的甲醛溶液固定[18]。剥离海草叶片附着卵块时,以其株高的二分之一处为分界点,分别对叶片上部和叶片下部附着的卵块数量进行计数。同时以游标卡尺测量海草株高、叶鞘长度、叶长、叶宽(精度为0.01 mm),并将海草组织分地上、地下部分分别置于恒温干燥箱(101-1-BS型)中,以60℃烘至恒重,以电子天平(BSM220.4型)称重[13],最后计算海草群落的结构指标,包括单株叶面积(LAS)、株高(SH)、平均叶长(ALL)、总植株密度(TSD)、最大叶长值(MLL)、平均叶宽(ALW)、最大叶宽(MLW)、地下生物量(BGB)、总生物量(TB)。
1.2 海草叶片附着卵块的鉴定目前对小型腹足类繁殖生物学的研究较少[19, 20],因此,在鉴定叶片附着卵的过程中,我们一方面参考已有文献对卵块形态的描述[21-23],另一方面将海草床内腹足类带回实验室进行培育,比较其在室内海草叶片上所产卵块的形态与野外采集卵块的形态,进而辅助鉴定叶片附着卵块的种类。具体做法如下:在实验区及其周围采集典型腹足类亲体,将海草叶片及腹足类带回实验室,按种类区分把腹足类分放至透明亚克力孵化盒中。培育水温和采样海区水温保持一致,盐度约30,pH值约8.0。每个孵化盒内放入适量日本鳗草叶片,每7 d换水一次,换水后饲喂小球藻粉[24]。每天观察腹足类产卵情况,并对比研究区采集带回卵块的形态特征,鉴定卵块的种类。
1.3 数据处理与分析通过PRIMER6.0软件对日本鳗草叶片附着卵块的季节变化进行多元变量统计分析,以相似性分析检验(ANOSIM)比较附着卵块的季节和分布位置差异,以相似性百分比分析(SIMPER)对分布差异起重要作用的卵块种类。采用上述方法,分析海草群落结构的季节差异,并确定导致海草群落结构差异的主要指标[25]。
在RStudio 1.4.1717集成编程环境下利用R 4.0.3软件中自带stats包的princomp函数,对海草群落结构指标标准化后生成的相关系数矩阵做主成分分析(PCA)。先将前两个主成分因子作为自变量进行线性回归分析,再将主成分回归模型中的主成分因子变量还原为原始变量,分析叶片附着卵块与海草群落结构的关系[26, 27]。结果用平均值±标准误差表示,显著性水平设置为P < 0.05。使用Origin 2018与Excel 2007软件对图表进行绘制。
2 结果与分析 2.1 海草群落结构的季节变化动态总植株密度和地上生物量(干重)的季节变化趋势相似,冬季总植株密度低至(1 145±93) shoots/m2,同时地上生物量干重低至(2.79±0.21) g/m2。调查期间地下生物量干重呈增长趋势,夏季达最大值(27.45±3.68) g/m2(图 2a),同时地上/地下生物量比值最低至(0.76±0.13)。调查期间,仅春季的地上生物量大于地下生物量,其比值为(1.44±0.14)。类似于总植株密度和地上生物量的变化趋势,株高与单株叶面积均呈现先增大后减小的变化趋势。春季的株高和单株叶面积分别达最高值(155.21±5.83) mm和(490.96±25.15) mm2(图 2b)。平均叶长变化趋势与单株叶面积相似,春季高达(90.81±3.54) mm;而平均叶宽在春季和夏季无明显差异,分别为(1.59±0.03) mm和(1.64±0.02) mm(图 2c)。
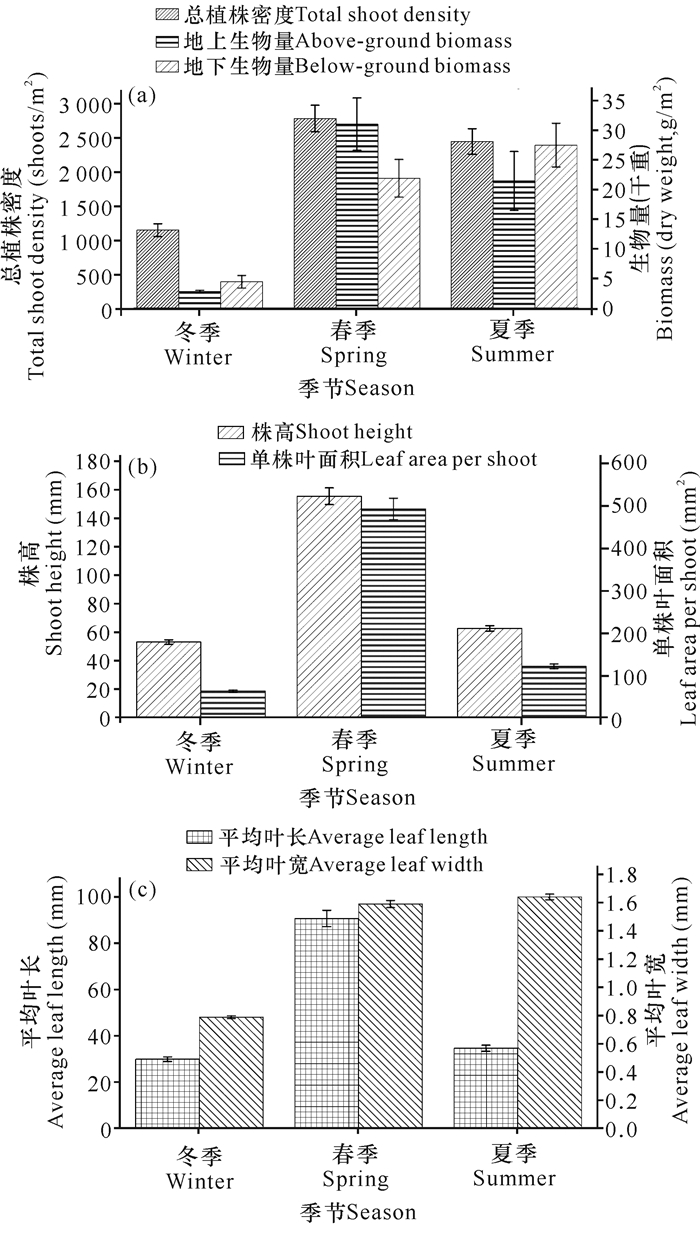
|
| 图 2 广西珍珠湾日本鳗草群落时间动态 Fig.2 Temporal dynamics of Zostera japonica community in Pearl Bay of Guangxi |
2.2 海草群落结构的季节变化分析
ANOSIM分析表明,不同季节的日本鳗草群落结构特征差异极显著(R=0.840,P=0.001)。其中,冬季和春季海草群落结构差异最大(R=0.095 9,P=0.001),冬季和夏季差异次之(R=0.868,P=0.001),春季和夏季差异最小(R=0.704,P=0.001)。
SIMPER分析显示,冬季和春季海草群落之间差异性主要由单株叶面积、株高、平均叶长、总植株密度和最大叶长引起,累积贡献率为50.09%。冬季和夏季的差异主要由平均叶宽、最大叶宽、地下生物量、总生物量和总植株密度造成,累积贡献率为76.20%。春季和夏季的差异主要来源于单株叶片数、最大叶长、平均叶长、株高和单株叶面积,其累积贡献率为68.12%(表 1)。
| 组名称 Group name |
指标 Index |
贡献率 Contribution rate (%) |
累计贡献率 Cumulative contribution rate (%) |
| 冬季/春季 Winter/Spring |
LAS | 10.64 | 10.64 |
| SH | 10.20 | 20.84 | |
| ALL | 9.96 | 30.80 | |
| TSD | 9.74 | 40.54 | |
| MLL | 9.56 | 50.10 | |
| 冬季/夏季 Winter/Summer |
ALW | 18.31 | 18.31 |
| MLW | 18.04 | 36.35 | |
| BGB | 16.07 | 52.42 | |
| TB | 12.31 | 64.73 | |
| TSD | 11.47 | 76.20 | |
| 春季/夏季 Spring/Summer |
NLS | 17.38 | 17.38 |
| MLL | 13.94 | 31.32 | |
| ALL | 12.50 | 43.82 | |
| SH | 12.37 | 56.19 | |
| LAS | 11.93 | 68.12 | |
| 注:表中列出贡献率排前5的指标(累计贡献率高于50%)。LAS:单株叶面积;SH:株高;ALL:平均叶长;TSD:总植株密度;MLL:最大叶长;ALW:平均叶宽;MLW:最大叶宽;BGB:地下生物量;TB:总生物量;NLS: 单株叶片数 Note:The top 5 indicators of contribution rate (cumulative contribution rate higher than 50%) are listed in the table.LAS: Leaf area per shoot; SH: Shoot height; ALL: Average leaf length; TSD: Total shoot density; MLL: Maximum leaf length; ALW: Average leaf width; MLW: Maximum leaf width; BGB: Underground biomass; TB: Total biomass; NLS: Number of leaves per shoot |
|||
2.3 海草叶片附着卵块的组成及其季节变化
本研究的调查站位设置在大片连续的海草斑块中央,但是从日本鳗草叶片仅采集到奥莱彩螺(Clithon oualaniensis)和秀丽织纹螺(Nassarius festivus)的卵块,均为小型腹足类的卵块(图 3)。此外,调查期间的邻近裸滩区域也未见卵块分布,同时该区周围缺少其他类型的附着基(海藻和牡蛎壳等),现有的非海草基质上也未发现附着卵块。

|
| 图 3 广西珍珠日本鳗草叶片附着卵块分布(卵块用红色圆圈标出) Fig.3 Distribution of leaf-attached egg masses of Zostera japonica in Pearl Bay, Guangxi (the egg masses are marked by red circles) |
在冬季(2019年12月)时,秀丽织纹螺卵块有最高的密度(1 026 ind./m2),春季密度(191 ind./m2)大幅下降,夏季密度与春季相同;冬季未采集到奥莱彩螺卵块,但春季密度(209 ind./m2)上升,夏季密度(268 ind./m2)上升放缓。在春季和夏季,叶片同一部位附着的奥莱彩螺卵块密度约是秀丽织纹螺卵块密度的2-6倍(图 4)。
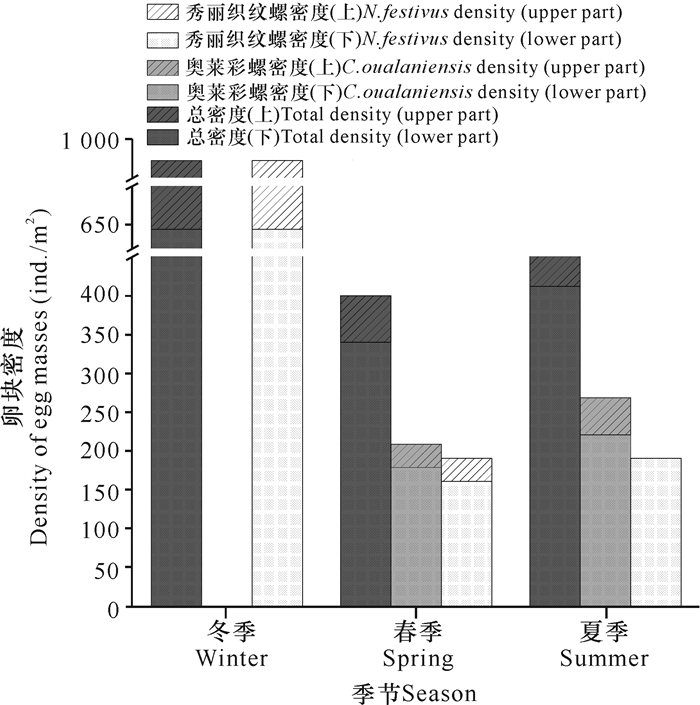
|
| 图 4 日本鳗草叶片不同部位附着卵块密度的季节变化 Fig.4 Seasonal variation of the density of the attached egg masses on different positions of Zostera japonica leaves |
ANOSIM分析表明,日本鳗草叶片附着卵块分布的季节差异极显著(R=0.239,P=0.001)。双尾显著性检验显示,冬季和春季(R=0.261,P=0.003)以及冬季和夏季(R=0.454,P=0.001)叶片附着卵块的分布差异极显著。叶片上部和下部的附着卵块的分布差异也极显著(R=0.305,P=0.001)。
SIMPER分析显示,秀丽织纹螺的卵块引起冬季和春季、冬季和夏季的叶片附着卵块呈现出分布差异性,贡献率分别为21.81%和15.87%。而奥莱彩螺的卵块是引起海草叶片上部和下部附着卵块呈现分布差异性的主要原因,贡献率为75.69%。
2.4 附着卵块与海草群落结构的关系通过对海草群落结构指标的主成分分析发现,第一主成分因子的贡献率达65.75%(表 2)。建立奥莱彩螺卵块密度与两个主成分因子的回归方程,结果显示方程与回归系数均不显著,因此奥莱彩螺卵块密度与海草群落结构指标无明显相关关系。进一步建立秀丽织纹螺卵块密度与两个主成分因子的回归方程,结果显示两个主成分因子回归系数均非常显著(P < 0.05)(表 3),秀丽织纹螺卵块密度与两个主成分显著相关。同时单株叶面积、地上生物量以及平均叶长等指标对主成分Comp.1影响较大(表 2),并与秀丽织纹螺卵块密度密切相关。将主成分Comp.1和Comp.2还原为原始变量后所得回归方程如下:
| $ \begin{array}{*{35}{l}} \ \ \ \ y=1482.653-0.176{{X}_{\text{TSD }}}-7.025{{X}_{\text{AGB }}}+ \\ 93.935{{X}_{\text{A }:\text{ B }}}+0.680{{X}_{\text{ALL}}}-462.095{{X}_{\text{ALW }}}+ \\ 0.018{{X}_{\text{LAS }}}, \\ \end{array} $ |
| 主成分因子 Principal component factors |
总植株密度 Total shoot density |
地上生物量 Above-ground biomass |
地上/地下生物量比值 Ratio of above and below ground biomass |
平均叶长 Average leaf length |
平均叶宽 Average leaf width |
单株叶面积 Leaf area per shoot |
特征值 Character-istic value |
贡献率 Contribution rate (%) |
累计贡献率 Accumulative contribution rate (%) |
| Comp.1 | 0.41 | 0.46 | 0.32 | 0.43 | 0.38 | 0.43 | 1.99 | 65.75 | 65.75 |
| Comp.2 | 0.35 | 0.17 | -0.45 | -0.40 | 0.62 | -0.33 | 0.92 | 14.19 | 79.94 |
| 估计值 Estimate value |
标准误差 Std.error |
t值 t value |
P值 P value |
|
| 截距 Intercept |
475.23 | 72.74 | 6.53 | 9.33×10-7*** |
| 主成分因子1 Comp.1 |
-160.22 | 36.62 | -4.38 | 2.04×10-4*** |
| 主成分因子2 Comp.2 |
-222.60 | 78.84 | -2.82 | 9.41×10-3** |
| 注:**代表P < 0.01,***代表P < 0.001 Note:** means P < 0.01, and *** means P < 0.001 |
||||
其中,y为秀丽织纹螺卵块密度(ind./m2),XTSD为总植株密度(shoots/m2),XAGB为地上生物量(dry weight g/m2),XA∶B为地上生物量与地下生物量比值,XALL为平均叶长(mm),XALW为平均叶宽(mm),XLAS为单株叶面积(mm2)。
3 讨论海草叶片是鱼类和无脊椎动物的重要产卵基和食物来源,对渔业生产力有积极影响,但海草叶片直接作为产卵基的直接证据并不多见[16]。不同的海草种类的叶片形态差异较大[28],不同海洋物种可能会将卵块附着在不同的海草叶上[16]。Jiang等[16]在海南岛黎安岗泰来草叶鞘和广东省流沙湾卵叶喜盐草(Halophila ovalis)叶片上分别发现金环宝螺(Monetaria annulus)和三线紫胸鱼(Stethojulis trilineata)的卵。本研究调查期间,在防城港珍珠湾日本鳗草叶片上仅发现秀丽织纹螺和奥莱彩螺的卵块。广西沿海滩涂频繁的渔业活动如挖螺、电虾等,使得海草床面临着较高的人类活动干扰[28],这将导致产卵基可用性的降低。苏治南等[29]研究发现,短期内高压水枪作业和连片集中式的人工挖掘对海草床和大型底栖动物群落具有较大的负面生态影响,不仅改变了海草床大型底栖动物的群落结构,也降低了大型底栖动物的多样性。频繁的渔业活动可能影响鱼类和无脊椎动物将海草叶片作为附着基进行产卵,导致研究区不管是产卵动物的种类或数量都较低。
当有竞争者或捕食者存在时,会引起其他海洋动物的行为响应。秀丽织纹螺生活在潮间带,以双壳类和鱼类等动物尸体为食,凭借其敏感的腹足和触角,具有较强的竞争能力。奥莱彩螺与秀丽织纹螺附着卵块的分布差异,表明这两种腹足类之间可能存在竞争或捕食行为[30, 31],这类似于鱼类的生境选择行为。Schofield[3]研究丑侏虾虎鱼(Microgobius gulosus)和壮体虾虎鱼(Gobiosoma robustum)的生境选择。当这两种虾虎鱼单独存在时,都倾向于选择结构复杂的海草微生境;当两种虾虎鱼同时存在时,由于相互竞争,丑侏虾虎鱼会选择裸沙微生境,壮体虾虎鱼由于有竞争优势则留在其偏好的海草生境;当将捕食者限制在一个笼子里并放置在海草微生境的中心,发现60%的壮体虾虎鱼和67%的丑侏虾虎鱼会选择留在裸沙微生境。这些研究表明,鱼类选择海草还是裸沙,可能只是为了躲避附近的捕食者。因此,海草床及其附近生境动物群落结构及其季节变化,可能会影响某些动物对海草床的利用,进而影响海草叶片附着卵的分布。
密集或复杂的植物群落结构有利于生物的栖息。研究发现在切萨皮克湾海草床中的蓝蟹(Callinectes sapidus)密度随着鳗草植株密度的增加而增加[32]。然而,动物的觅食能力和存活率等并非总是与栖息地结构复杂性呈正相关关系[33]。例如在加利福尼亚,研究人员通过束缚实验研究发现,加利福尼亚的红蟹(Cancer productus)幼体存活率与鳗草植株密度呈正相关关系,但与鳗草覆盖面积以及生物量呈负相关关系[34]。本研究结果表明,秀丽织纹螺卵块密度与日本鳗草植株密度、地上生物量呈负相关关系,但与单株叶面积、平均叶长呈正相关关系。这可能是因为植株密度过高会阻碍繁殖个体的移动,进而影响它们可移动的产卵范围[33]。
调查期间,日本鳗草叶片上部和下部的附着卵块分布存在显著差异,两种腹足类都倾向于将卵块产在植株叶片的下半部分。这与Jiang等[16]在海南岛黎安港发现金环宝螺(Monetaria annulus)将卵块产在泰来草(Thalassia hemprichii)叶鞘上的结果类似。潮间带环境因子的变化可能会影响卵块内胚胎的发育和后代的存活,尤其是紫外线或者极端的盐度、温度都会影响卵块内胚胎发育[8]。雌性可能倾向于选择捕食风险低,不易受暴露胁迫的产卵地点,从而保证卵块在适宜小生境中发育[7]。此外,研究区的海草处于潮间带生境,退潮时(尤其是夏季)海草植株和附生生物易受到干燥和高温的影响[15],分布于叶片下部的卵块由于受到海草叶片的遮蔽以及更接近湿润的地质,比叶片上部的卵块受到干燥和高温的影响相对更小[16]。
4 结论海草床的产卵场和育幼场功能,对于维持近海物种的多样性至关重要。本研究表明,广西珍珠湾日本鳗草叶片附着卵块的密度具有明显的季节变化,冬季卵块密度显著高于春季和夏季,并且日本鳗草叶片下部的附着卵块密度显著高于上部。同时,海草群落结构影响了叶片附着卵的分布格局。但是,调查期间珍珠湾日本鳗草海草床产卵动物种类较单一,数量较少的原因仍有待进一步研究。
| [1] |
CHEN C F, LAU V K, CHANG N B, et al. Multi-temporal change detection of seagrass beds using integrated Landsat TM/ETM+/OLI imageries in Cam Ranh Bay, Vietnam[J]. Ecological Informatics, 2016, 35: 43-54. DOI:10.1016/j.ecoinf.2016.07.005 |
| [2] |
WAYCOTT M, DUARTE C M, CARRUTHERS T J B, et al. Accelerating loss of seagrasses across the globe threatens coastal ecosystems[J]. Proceedings of the National Academy of Sciences, 106(30): 12377-12381.
|
| [3] |
SCHOFIELD P J. Habitat selection of two gobies (Microgobius gulosus, Gobiosoma robustum): Influence of structural complexity, competitive interactions, and presence of a predator[J]. Journal of Experimental Marine Biology and Ecology, 2003, 288(1): 125-137. DOI:10.1016/S0022-0981(03)00004-2 |
| [4] |
李文涛, 张秀梅. 海草场的生态功能[J]. 中国海洋大学学报: 自然科学版, 2009, 39(5): 933-939. |
| [5] |
JONES C M. Can we predict the future: Juvenile finfish and their seagrass nurseries in the Chesapeake Bay[J]. ICES Journal of Marine Science, 2014, 71(3): 681-688. DOI:10.1093/icesjms/fst142 |
| [6] |
STUNZ W G, MINELLO T J, LEVIN P S. Growth of newly settled red drum Sciaenops ocellatus in different estuarine habitat types[J]. Marine Ecology Progress Series, 2002, 238: 227-236. DOI:10.3354/meps238227 |
| [7] |
ALLEN R M. Oviposition site influences dispersal potential in a marine bubble snail[J]. Marine Biology Research, 2014, 10(5): 515-522. DOI:10.1080/17451000.2013.831177 |
| [8] |
PRZESLAWSKI R. A review of the effects of environmental stress on embryonic development within intertidal gastropod egg masses[J]. Molluscan Research, 2004, 24(1): 43-63. DOI:10.1071/MR04001 |
| [9] |
PEYTON K A, HANISAK M D, LIN J. Marine algal symbionts benefit benthic invertebrate embryos deposited in gelatinous egg masses[J]. Journal of Experimental Marine Biology and Ecology, 2004, 307(2): 139-164. DOI:10.1016/j.jembe.2004.01.022 |
| [10] |
傅敏, 魏利平. 海产软体动物繁殖生态的研究[J]. 国外水产, 1985(3): 1-5. |
| [11] |
FERNANDES D A O, PODOLSKY R D. Developmental consequences of association with a photosynthetic substrate for encapsulated embryos of an intertidal gastropod[J]. Journal of Experimental Marine Biology and Ecology, 2011, 407(2): 370-376. DOI:10.1016/j.jembe.2011.07.033 |
| [12] |
DASSOW Y, STRATHMANN R R. Full of eggs and no place to lay them: Hidden cost of benthic development[J]. Marine Ecology Progress, 2005, 294: 23-34. DOI:10.3354/meps294023 |
| [13] |
邱广龙, 范航清, 周浩郎, 等. 基于SeagrassNet的广西北部湾海草床生态监测[J]. 湿地科学与管理, 2013, 9(1): 60-64. DOI:10.3969/j.issn.1673-3290.2013.01.17 |
| [14] |
郑凤英, 邱广龙, 范航清, 等. 中国海草的多样性、分布及保护[J]. 生物多样性, 2013, 21(5): 517-526. |
| [15] |
范航清, 邱广龙, 石雅君, 等. 中国亚热带海草生理生态学研究[M]. 北京: 科学出版社, 2011.
|
| [16] |
JIANG Z J, HUANG D, FANG Y, et al. Home for marine species: Seagrass leaves as vital spawning grounds and food source[J]. Frontiers in Marine Science, 2020, 7: 194. DOI:10.3389/fmars.2020.00194 |
| [17] |
邱广龙, 范航清, 李宗善, 等. 濒危海草贝克喜盐草的种群动态及土壤种子库——以广西珍珠湾为例[J]. 生态学报, 2013, 33(19): 6163-6172. |
| [18] |
KASUGAI T, IKEDA Y. Description of the egg mass of the pygmy cuttlefish, Idiosepius paradoxus (Cephalopoda: Idiosepiidae), with special reference to its multiple gelatinous layers[J]. Veliger -Berkeley, 2003, 46(2): 105-110. |
| [19] |
刘静. 山东省荣成天鹅湖大叶藻间小型腹足类生物调查及分子学研究[D]. 青岛: 青岛大学, 2013.
|
| [20] |
刘庆, 徐兴华, 陈燕妮. 腹足纲贝类繁殖与发育的研究进展[J]. 生命科学仪器, 2008, 6(4): 14-16. DOI:10.3969/j.issn.1671-7929.2008.04.004 |
| [21] |
梁书东. 纵肋织纹螺(Nassarius variciferus)性腺发育相关基因的筛选及胚胎发育研究[D]. 沈阳: 沈阳农业大学, 2019.
|
| [22] |
CHAN K, MORTON B. The reproductive biology of Nassarius festivus(Powys, 1835) (Gastropoda: Nassariidae) in relation to seasonal changes in temperature and salinity in subtropical Hong Kong[J]. Aquatic Ecology, 2005, 39(2): 213-228. DOI:10.1007/s10452-004-6144-x |
| [23] |
FONG C W, LEE S Y, WU R S S. The effects of epiphytic algae and their grazers on the intertidal seagrass Zostera japonica[J]. Aquatic Botany, 2000, 67(4): 251-261. DOI:10.1016/S0304-3770(00)00101-7 |
| [24] |
陈彦. 波部东风螺早期发育阶段的形态观察与摄食生态研究[D]. 厦门: 厦门大学, 2003.
|
| [25] |
许昊, 吴宏玥, 王占军, 等. 立地条件对宁夏中部干旱风沙区柠条生物量分配格局的影响[J]. 北京林业大学学报, 2020, 42(12): 91-100. DOI:10.12171/j.1000-1522.20200162 |
| [26] |
胡亮亮, 王素华, 王丽侠, 等. 绿豆种质资源苗期耐盐性鉴定及耐盐种质筛选[J]. 作物学报, 2021. DOI:10.3724/sp.J.1006.2022.04283 |
| [27] |
赵嘉宝. 吐鲁番市葡萄产量主要影响因子分析及预测[D]. 阿拉尔市: 塔里木大学, 2020.
|
| [28] |
范航清, 彭胜, 石雅君, 等. 广西北部湾沿海海草资源与研究状况[J]. 广西科学, 2007, 14(3): 289-295. |
| [29] |
苏治南, 邱广龙, 范航清, 等. 人为物理干扰对海草群落及大型底栖动物的生态影响[J]. 广西科学, 2017, 24(5): 474-482. |
| [30] |
MORTON B, YUEN W Y. The feeding behaviour and competition for carrion between two sympatric scavengers on a sandy shore in Hong Kong: The gastropod, Nassarius festivus (Powys) and the hermit crab, Diogenes edwardsii (De Haan)[J]. Journal of Experimental Marine Biology and Ecology, 2000, 246(1): 1-29. DOI:10.1016/S0022-0981(99)00170-7 |
| [31] |
罗璇. 中国沿海典型区域织纹螺毒性及毒素成分研究[D]. 北京: 中国科学院海洋研究所, 2008.
|
| [32] |
HOVEL K A, LIPCIUS R N. Effects of seagrass habitat fragmentation on juvenile blue crab survival and abundance[J]. Journal of Experimental Marine Biology and Ecology, 2002, 271(1): 75-98. DOI:10.1016/S0022-0981(02)00043-6 |
| [33] |
ROOKER J R, HOLT G J, HOLT S A. Vulnerability of newly settled red drum (Sciaenops ocellatus) to predatory fish: Is early-life survival enhanced by seagrass meadows?[J]. Marine Biology, 1998, 131(1): 145-151. DOI:10.1007/s002270050305 |
| [34] |
HOVEL K A. Habitat fragmentation in marine landscapes: Relative effects of habitat cover and configuration on juvenile crab survival in California and North Carolina seagrass beds[J]. Biological Conservation, 2003, 110(3): 401-412. DOI:10.1016/S0006-3207(02)00234-3 |



