2. 桂林医学院药学院, 广西桂林 541199;
3. 百色学院农业与食品工程学院, 广西百色 533000
2. College of Pharmacy, Guilin Medical University, Guilin, Guangxi, 541199, China;
3. College of Agriculture and Food Engineering, Baise University, Baise, Guangxi, 533000, China
通脱木Tetrapanax papyrifer,又名通草、木通树、天麻子等[1],因其茎髓经干燥后呈白色而被称为“白通草”,经加工切成薄片后又被称为“通草纸”[2]。通脱木属常绿灌木或小乔木植物,主要生长在2 800 m以下向阳肥沃的土壤上,在我国主要分布于陕西、广东、广西、云南、四川、贵州、湖南、湖北、江西等地[3]。
随着生活水平的提高,人们越来越关注身体健康,对保健食品的需求也日益增长,因而通脱木药用价值的开发也越来越受到重视。目前通脱木的药用功能主要有清热解毒、利尿、益气、通乳等[4]。通脱木全身都是宝,其花、叶、果实含有丰富的三萜类化合物、三萜皂苷类化合物、甾类化合物和神经酰胺类等物质[5],对炎症、癌症、脂肪肝以及艾滋病等有一定的治疗作用[6-9]。此外,通脱木中还富含黄酮化合物。因分子结构特殊,黄酮化合物具有很多药用价值[10, 11],已被广泛应用于临床制药和保健食品等领域[12]。目前有不少文献报道了分心木、异叶梁王茶、黄花倒水莲、黄根等植物体内黄酮提取及其抗氧化活性研究[13-16],但未见相关的通脱木黄酮提取报道,且从通脱木中提取黄酮类化合物的工艺条件尚未明确。因此,探讨通脱木黄酮的提取工艺具有重要的研究意义。
本研究采用单因素试验方法分析提取时间、提取温度和乙醇浓度等因素对通脱木黄酮提取率的影响,再利用响应面法优化通脱木黄酮提取的最佳工艺条件,然后测定通脱木茎髓、叶中的黄酮含量,同时分析其体外抗氧化活性,比较通脱木茎髓、叶中黄酮含量的差异,为通脱木中黄酮的开发和利用提供数据参考。
1 材料与方法 1.1 材料 1.1.1 植物材料通脱木分别采自广西壮族自治区百色市乐业县拉雅(24°49′20″ N,106°16′59″ E)、拉雅二沟(24°55′33″ N,106°33′42″ E)和河池市南丹县峨嵋村(24°57′1.88″ N,107°29′48.30″ E) 3个地区。3个地区都属于中亚热带季风气候区,地处云贵高原向广西丘陵过渡的山原地带。每个地区选取不同年份(一年生、两年生、三年生)健壮树苗各10株。试验所使用的叶片、茎髓(茎中的白色髓)需烘干粉碎,过60目筛。
1.1.2 试剂芦丁标准品(批号:Y16M9S61523,上海源叶生物科技有限公司),蒸馏水,乙醇、亚硝酸钠、硝酸铝、氢氧化钠、Vc、1, 1-二苯基-2-三硝基苯肼(DPPH)、邻二氮菲、磷酸盐缓冲溶液(PBS)、硫酸亚铁、H2O2、氯化铁、铁氰化钾、磷酸盐缓冲液、三氯乙酸均为分析纯试剂,均购自桂林卓一生物有限公司。
1.1.3 试验仪器TU-1901型双光束紫外可见分光光度计(北京普析通用仪器有限责任公司),KQ-300E型超声波清洗机(昆山市超声仪器有限公司),HN-8型数显恒温水浴锅(上海力辰邦西仪器科技有限公司),电子分析天平[梅特勒-托利多仪器(上海)有限公司]。
1.2 方法 1.2.1 黄酮标准曲线的制作称量经真空干燥至恒重的芦丁标准品13.2 mg,用60%乙醇溶解并定容至25 mL容量瓶作为标准溶液(0.528 mg/mL)[14]。分别准确吸取0 mL,0.4 mL,0.8 mL,1.2 mL,1.6 mL,2.0 mL的芦丁标准品溶液置于25 mL的容量瓶内,分别加入2.0 mL,1.6 mL,0.8 mL,0.4 mL,0 mL的60%乙醇溶液,再加入5%亚硝酸钠溶液0.5 mL,混匀静置6 min;随后加入10%硝酸铝溶液0.5 mL,静置6 min;最后加入4%氢氧化钠溶液4.0 mL,用60%乙醇定容至刻度,摇匀后静置15 min;在510 nm的波长下测定吸光度,绘制回归曲线,回归方程为Y=12.029x+0.0095,R2=0.999 2,芦丁标准溶液在0-0.06 mg/mL时与吸光度呈现出良好的线性关系。
1.2.2 供试品溶液的配制按照通脱木粉末与乙醇的质量体积比1∶50,称取0.5 g样品通脱木粉末与20%乙醇混合,在70℃条件下水浴70 min。然后用功率300 W、频率40 kHz的超声波辅助提取,过滤溶液,再用20%乙醇定容至50 mL,即得供试品溶液。
1.2.3 通脱木黄酮提取工艺的优化试验① 单因素试验。
称取通脱木样品粉末0.5 g,进行黄酮提取工艺的单因素试验,分别考察温度(40℃、50℃、60℃、70℃、80℃)、溶剂(乙醇)浓度(20%、40%、60%、80%、100%)、料液比(样品∶乙醇,1∶30 g/mL,1∶40 g/mL,1∶50 g/mL,1∶60 g/mL,1∶70 g/mL)、超声提取时间(10 min、30 min、50 min、70 min、90 min)对通脱木黄酮提取效果的影响。设置通脱木黄酮提取的基本条件:提取温度60℃、溶剂(乙醇)浓度60%(V∶V)、料液比1∶30(g/mL)、超声提取时间30 min、超声功率300 W、超声波频率40 kHz。优化当前影响因素时,以不同水平替代基本条件中相应因素的参数,其他因素的参数设置不变。待提取结束后,对浆液进行过滤,留取上清液,定容至50 mL,按照芦丁标准曲线的步骤进行加样,测定吸光度,按公式(1)[16]计算通脱木黄酮提取率。每个处理进行5个重复。
| $ \text { 黄酮提取率 }(\%)=\frac{C \times V}{M} \times 100 \% \text {, } $ | (1) |
式中, C为提取液中黄酮的含量,mg/mL;V为提取液的体积,mL;M为样品的粉末质量,mg。
② 响应面优化。
根据单因素试验结果,以提取温度、提取时间及料液比3个因素为考察因子,黄酮提取率(Y)为响应值,采用Design Expert 11软件的Box-Benhnken中心组合设计三因素三水平试验方案(表 1)[17-20],考察通脱木黄酮提取率。
| 水平 Levels |
因素Factors | ||
| A提取温度(℃) A Extraction temperature (℃) |
B料液比(g/mL) B Material-liquid ratio (g/mL) |
C提取时间(min) C Extraction time (min) |
|
| -1 | 60 | 1∶40 | 50 |
| 0 | 70 | 1∶50 | 70 |
| 1 | 80 | 1∶60 | 90 |
1.2.4 通脱木黄酮的体外抗氧化试验
① 通脱木黄酮对·OH的清除作用。
向试管内先加入1 mL 0.75 mol/L的邻二氮菲和2 mL pH值为7.45的磷酸盐缓冲液(PBS)、1 mL蒸馏水、1 mL 0.75 mol/L FeSO4溶液和1 mL 0.01% H2O2,搅拌均匀后置于37℃恒温水浴锅中水浴1 h。用蒸馏水作为参比,利用紫外分光光度计在536 nm处测定吸光度,记为Ap;用等体积的蒸馏水代替0.01% H2O2,测定在同波长下的吸光度,记为Ab;换等体积的样液替代蒸馏水,测其吸光度,记为As。每组试验设置3次平行。·OH清除率(%)按公式(2)[21]计算,用Vc作对照。
| $ \text { · } \mathrm{OH} \text { 清除率 }(\%)=\frac{A_{\mathrm{s}}-A_{\mathrm{p}}}{A_{\mathrm{b}}-A_{\mathrm{p}}} \times 100 \% \text { 。} $ | (2) |
② 通脱木黄酮对DPPH·的清除作用。
取不同产地的黄酮粗提液分别与0.1 mmol/L的DPPH·溶液进行等体积混合,放置30 min后用无水乙醇作为参比,利用紫外分光光度计在517 nm处测定吸光度A1。使用同样方法测定不同产地的黄酮粗提液与无水乙醇等体积混合液的吸光度A2,DPPH·溶液与无水乙醇等体积混合液的吸光度Ad,每组试验设置3次平行。根据公式(3)[22]计算样液对DPPH·的清除率(%),用Vc作对照。
| $ \mathrm{DPPH} \cdot 清除率 (\%)=\frac{A_{\mathrm{d}}-\left(A_{1}-A_{2}\right)}{A_{\mathrm{d}}} \times 100 \% 。$ | (3) |
③ 通脱木黄酮对O2-·的清除作用。
将5 mL 0.05 mol/L pH值为8.2的Tris-HCl缓冲液放置于25℃水浴锅中预热20 min,然后分别加入1 mL不同产地的黄酮粗提取液、0.5 mL 25 mmol/L浓度的邻苯三酚,混匀后置于25℃水浴锅中准确反应4 min,最后加入2滴8 mol/L HCl终止反应。以蒸馏水作参比,利用紫外分光光度计在299 nm处测定吸光度Ae。用等体积蒸馏水代替粗提液样品的吸光度为A0,用0.5 mL蒸馏水代替邻苯三酚溶液的吸光度为Ah。每组试验设置3次平行。根据公式(4)[23]计算O2-·的清除率,用Vc作对照。
| $ \mathrm{O}_{2}^{-} \cdot \text { 清除率 }(\%)=\frac{A_{0}-\left(A_{\mathrm{e}}-A_{\mathrm{h}}\right)}{A_{0}} \times 100 \% \text { 。} $ | (4) |
④ 通脱木黄酮总还原力的测定。
取1.0 mL的黄酮粗提液,加入2.5 mL 1%铁氰化钾溶液和2.5 mL 0.22 mol/L磷酸盐缓冲液,混匀后置于50℃水浴锅中反应30 min,迅速冷却并加入2.5 mL 10%三氯乙酸,在4 000 r/min的条件下离心10 min,取2.5 mL的上清液,加入2.5 mL蒸馏水和2.5 mL 0.1%三氯化铁溶液,混合后静置10 min,以蒸馏水作参比,利用紫外分光光度计测定其在700 nm处的吸光度。吸光值越高,还原力越大[23]。用Vc作对照。
1.2.5 数据分析应用Excel对试验数据进行统计预处理,然后用SPSS 17.0统计软件对相关数据进行统计分析。
2 结果与分析 2.1 单因素试验结果当提取温度为70℃时,通脱木黄酮的提取率达到最高值1.25%,但继续升高温度,黄酮提取率降低,这可能是由于温度过高导致杂质溶出,同时高温极易使黄酮结构发生改变,因此黄酮的提取率降低[图 1(a)]。随着乙醇浓度的提升,黄酮提取率变化不明显,表明乙醇浓度对黄酮提取率影响不大,因此以20%乙醇作为提取溶剂,同时不再将乙醇浓度作为下一步优化试验的影响因素[图 1(b)]。当料液比为1∶50 (g/mL)时,黄酮提取率达到最大,但继续提高料液比反而使提取率呈下降趋势,这可能是因为料液比过高时,溶剂(乙醇)吸收了较多的超声波能量,使通脱木粉末吸收的超声波能量减少,导致黄酮提取率降低[图 1(c)]。当提取时间为70 min时,黄酮提取率最高,但提取时间大于70 min时,黄酮提取率呈现下降趋势,这是因为超声波的空化效应和热效应破坏了黄酮结构,从而降低了黄酮提取率[图 1(d)]。
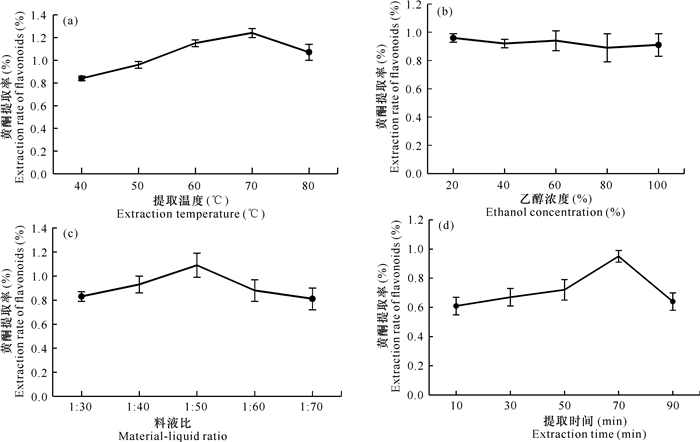
|
| 图 1 提取温度(a)、乙醇浓度(b)、料液比(c)和提取时间(d)对黄酮提取率的影响 Fig.1 Effect of extraction temperature (a), ethanol concentration (b), material-liquid ratio (c) and extraction time (d) on the extraction rate of flavonoids |
2.2 响应面试验结果与分析 2.2.1 响应面试验结果
表 2为17个试验组合的通脱木黄酮提取率结果。当提取温度为70℃、提取时间为70 min,料液比为1∶50 (g/mL)时,获得最大通脱木黄酮提取率为1.62%(试验13)。利用实验数据建立黄酮提取率的响应面最佳拟合模型,二次回归方程为
| 试验序号 Test serial number |
A提取温度(℃) A Extraction temperature (℃) |
B提取时间(min) B Extraction time (min) |
C料液比(g/mL) C Material-liquid ratio (g/mL) |
黄酮提取率(%) Extraction rate of fla-vonoids (%) |
| 1 | 70 | 50 | 1∶40 | 1.11 |
| 2 | 60 | 70 | 1∶40 | 1.23 |
| 3 | 70 | 90 | 1∶40 | 1.16 |
| 4 | 70 | 90 | 1∶60 | 1.14 |
| 5 | 60 | 50 | 1∶50 | 1.23 |
| 6 | 80 | 70 | 1∶60 | 1.33 |
| 7 | 70 | 70 | 1∶50 | 1.57 |
| 8 | 60 | 70 | 1∶60 | 1.24 |
| 9 | 80 | 70 | 1∶40 | 1.26 |
| 10 | 60 | 90 | 1∶50 | 1.20 |
| 11 | 80 | 90 | 1∶50 | 1.22 |
| 12 | 70 | 70 | 1∶50 | 1.57 |
| 13 | 70 | 70 | 1∶50 | 1.62 |
| 14 | 80 | 50 | 1∶50 | 1.29 |
| 15 | 70 | 70 | 1∶50 | 1.61 |
| 16 | 70 | 70 | 1∶50 | 1.61 |
| 17 | 70 | 50 | 1∶60 | 1.21 |
Y=1.56+0.00525A-0.002B+0.056C+0.076AB-0.019AC+0.12BC-0.24A2-0.14B2-0.082C2,
式中,Y为预测的通脱木黄酮提取率(%),A为提取温度(℃)、B为提取时间(min)、C为料液比(g/mL)。模型相关系数R2=0.965 7,校正的决定系数Adj R2=0.908 4,说明模型的预测值和实际值在试验中拟合度较好,试验结果可靠。方差分析表明(表 3),回归方程中F=130.76,P < 0.000 1,表明回归模型极显著;失拟误差P=0.654 3>0.05,表明回归模型能够显著拟合提取温度(A)、提取时间(B)、料液比(C)对通脱木黄酮率的影响。因此,本研究所建立的回归方程能对试验结果进行准确的预测分析。
| 方差来源 Source of variance |
平方和 Square source |
自由度 Freedom |
均方 Mean square |
F值 F value |
P值 P value |
显著性 Significant |
| 模型 Model |
0.53 | 9 | 0.059 | 130.76 | < 0.000 1 | ** |
| A | 4.950E-003 | 1 | 4.950E-003 | 10.89 | 0.013 1 | * |
| B | 1.711E-003 | 1 | 1.711E-003 | 3.77 | 0.093 5 | - |
| C | 3.042E-003 | 1 | 3.042E-003 | 6.70 | 0.036 1 | * |
| AB | 4.000E-004 | 1 | 4.000E-004 | 0.88 | 0.379 3 | - |
| AC | 1.056E-003 | 1 | 1.056E-003 | 2.32 | 0.171 2 | - |
| BC | 3.540E-003 | 1 | 3.540E-003 | 7.79 | 0.026 9 | * |
| A2 | 0.064 | 1 | 0.064 | 140.54 | < 0.000 1 | ** |
| B2 | 0.23 | 1 | 0.23 | 501.58 | < 0.000 1 | ** |
| C2 | 0.18 | 1 | 0.18 | 390.96 | < 0.000 1 | ** |
| 残差 Residual |
3.181E-003 | 7 | 4.544E-004 | |||
| 失拟误差 Mismatch error |
9.737E-004 | 3 | 3.246E-004 | 0.59 | 0.654 3 | - |
| 纯误差 Pure error |
2.207E-003 | 4 | 5.517E-004 | |||
| 总差 Total difference |
0.54 | 16 | ||||
| 注:*表示差异显著,P < 0.05;**表示差异极显著,P < 0.01;“-”表示差异不显著 Note: * indicates significant difference, P < 0.05;** indicates extremely significant difference, P < 0.01;"-" indicates that the difference is not significant |
||||||
2.2.2 响应面分析
通过对模型系数的分析可得各影响因素的主效应关系为提取温度(A)>料液比(C)>提取时间(B),表明提取温度对通脱木黄酮提取率的影响最大。该结论与宋越冬等[24]对荞麦叶黄酮的研究结论(超声时间>超声温度>乙醇体积分数)存在一定差异,这可能是不同材料之间的性质差异所致。
此外,交互项AB、AC、BC的P值分别为0.379 3, 0.171 2, 0.026 9,交互项AB、AC对提取率没有显著性影响(P>0.05),BC交互作用显著(P=0.026 9),表明BC交互作用对通脱木中黄酮的提取率会产生显著的影响。比较分析AB、AC、BC的交互作用,获得响应曲面及等高线(图 2)。在AB交互作用中[图 2(a)],固定B值,提取率随A值增加呈上升的趋势,当A接近70℃时,曲面达到顶点,有最大提取率;固定A值,提取率也随着B值增加而增大,当B接近70 min时达到最高。因此,在A接近70℃、B接近70 min的区域有最大提取率。在AC交互作用中[图 2(b)],固定A值,提取率随着C值的升高而增大,当C值超过1∶50时,提取率增加不明显;固定C值,提取率随A值的增加而增大,A值接近70℃时提取率最大。因此,在A接近70℃、C接近1∶50的区域,模型预测有最大黄酮提取率。在BC的交互作用中[图 2(c)],固定B值,提取率随C的增加而增大,当C值接近1∶50时有最大提取率;固定C值,提取率随B值的增加而增大,当B接近70 min时,提取率最大。因此,在B接近70 min、C接近1∶50的区域有最大提取率。进一步结合模型预测,可获得通脱木黄酮的最佳提取条件为乙醇浓度20%(单因素优化结果)、料液比1∶50.54 (g/mL)、提取温度71.06℃、提取时间69.26 min,预测的最佳黄酮提取率为1.60%,与实际值(试验13,提取率为1.62%)接近,进一步表明该预测模型的可靠性。但考虑到实际操作的简便性以及结合单因素试验分析的结果,本研究确定通脱木黄酮提取工艺条件为乙醇浓度20%、料液比1∶50 (g/mL)、提取温度70℃、提取时间70 min。
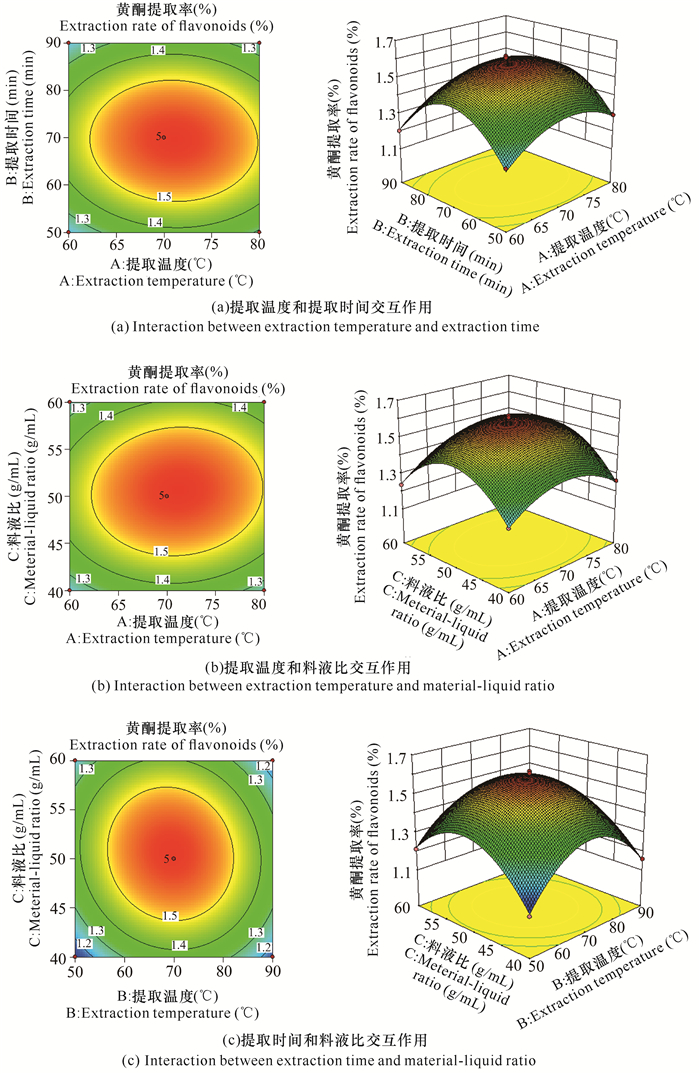
|
| 图 2 提取温度、提取时间、料液比3个因子的交互作用 Fig.2 Interaction of extraction temperature, extraction time and material-liquid ratio |
2.3 不同地区通脱木不同部位的黄酮含量比较
利用响应面优化后的提取工艺,分别对广西百色市乐业县拉雅(LY)、拉雅二沟(EG)和河池市南丹县峨嵋村(EM) 3个地区不同年份(一年生、两年生、三年生)的通脱木黄酮进行提取,并计算提取率,结果如表 4所示。不同地区的通脱木黄酮提取率有所差别,其中以广西百色市乐业县拉雅二沟山脉的通脱木黄酮较多,无论是叶子还是茎髓的提取率都比其他两个地区的高,表明拉雅二沟地区的生态环境比较适宜通脱木的生存。此外,所有地区茎髓中黄酮含量均高于其叶子的黄酮含量,且两年生的茎髓黄酮含量更高,这可能是由于物质运输在茎髓部位比叶片更易储存。这一结果对开发利用通脱木不同植株部位的黄酮有一定的指导意义。
| 地点 Areas |
茎髓黄酮提取率 Extraction rate of flavonoids from stem pith |
叶黄酮提取率 Extraction rate of flavonoids from leaves |
|||||
| 一年生 One-year old |
两年生 Two-year old |
三年生 Three-year old |
一年生 One-year old |
两年生 Two-year old |
三年生 Three-year old |
||
| 拉雅二沟EG | 1.410±0.031ab | 1.438±0.017a | 1.424±0.011ab | 1.29±0.044b | 1.375±0.007b | 1.312±0.022b | |
| 拉雅LY | 1.315±0.024bc | 1.355±0.014ac | 1.321±0.008bc | 1.216±0.025b | 1.234±0.034b | 1.223±0.011b | |
| 峨嵋EM | 1.348±0.004b | 1.391±0.027ab | 1.371±0.007b | 1.238±0.009a | 1.248±0.007a | 1.279±0.019a | |
| 注:字母a、b、c代表在P=0.05水平上差异显著 Note: Letters a, b and c represent significant differences at level of P=0.05 |
|||||||
2.4 不同地区通脱木茎髓中黄酮体外的抗氧化活性
如图 3所示,不同地区通脱木茎髓中黄酮对于·OH、DPPH·、O2-·的清除作用都比较明显。其中,拉雅二沟地区的通脱木黄酮对·OH、DPPH·、O2-·的消除率最高,分别为19.35%、63.21%、55.65%,总还原力达到对照(Vc)的50%以上,表明通脱木黄酮的体外抗氧化性较强。
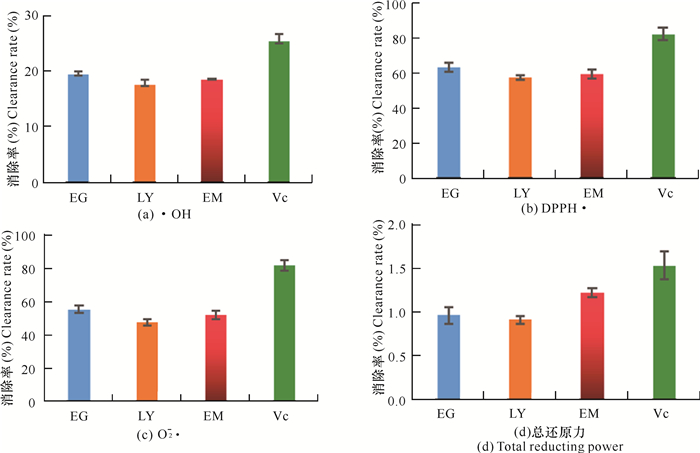
|
| EG表示拉雅二沟,LY表示拉雅,EM表示峨嵋 EG stands for Laya Ergou, LY stands for Laya, EM means Emei 图 3 不同地区通脱木茎髓中黄酮的还原力以及·OH、DPPH·、O2-·的清除率 Fig.3 Reducing power of flavonoids and the clearance rates of ·OH, DPPH·, O2-·in different areas of Tetrapanax papyrifer rhizome |
3 结论
本研究通过单因素试验和响应面试验获得的通脱木黄酮最佳提取工艺为乙醇浓度20%,料液比1∶50 (g/mL),提取温度70℃,提取时间70 min,此工艺下通脱木黄酮提取率可达1.62%。此外,通脱木黄酮的体外抗氧化性较强,其最佳药用部位为茎髓,且两年生的茎髓黄酮含量更高。
| [1] |
周天宇. 通脱木具有热带风情的耐寒植物[N]. 中国花卉报, 2020-07-16(W02).
|
| [2] |
胡献国. 一身是药通脱木[J]. 养生月刊, 2016, 37(10): 896. |
| [3] |
中植物志编辑委员会. 中国植物志: 第54卷[M]. 北京: 科学出版社, 1993.
|
| [4] |
孙菲菲, 韦霄, 邹蓉, 等. 药用植物通脱木的研究进展[J]. 广西科学, 2020, 27(4): 347-355. |
| [5] |
陈章义. 通脱木叶的四种新的三萜化合物[J]. 国外药学: 植物药分册, 1981(4): 28. |
| [6] |
于晶, 郝再彬, 苍晶, 等. 黄酮类化合物的活性研究进展[J]. 东北农业大学报, 2008, 39(12): 125-130. |
| [7] |
林国荣, 吴磊, 吴锦程. 枇杷叶总黄酮的富集及其生物活性的研究[J]. 食品科技, 2014, 39(11): 233-237. |
| [8] |
庞文悦, 王莲, 张荣泉. 山楂叶总黄酮生物活性研究近况进展[J]. 食品研究与开发, 2014, 35(13): 134-136. DOI:10.3969/j.issn.1005-6521.2014.13.037 |
| [9] |
宋成英, 黄俊懿, 封加福, 等. 对生物黄酮生物活性的综述[J]. 化学工程与装备, 2013(4): 128-130, 133. |
| [10] |
吴继洲. 天然药物化学[M]. 北京: 高等教育出版社, 2010.
|
| [11] |
吴玉兰. 金樱子总黄酮对氧化损伤HUVEC保护作用的研究[D]. 衡阳: 南华大学, 2012.
|
| [12] |
张彬, 李彩侠, 吴亚卿, 等. 黄酮类化合物的研究进展[J]. 食品与机械, 2005, 21(5): 70-73. DOI:10.3969/j.issn.1003-5788.2005.05.024 |
| [13] |
赵娟娟. 分心木黄酮超声-微波协同提取及抗氧化性研究[J]. 食品研究与开发, 2018, 39(18): 70-76. DOI:10.3969/j.issn.1005-6521.2018.18.013 |
| [14] |
唐健民, 朱成豪, 秦惠珍, 等. 神木天坑两种药茶同源植物叶总黄酮提取工艺及抗氧化活性研究[J]. 广西科学院学报, 2020, 36(1): 101-108. |
| [15] |
史艳财, 邹蓉, 韦记青, 等. 黄花倒水莲总黄酮提取工艺研究[J]. 北方园艺, 2014(12): 134-137. |
| [16] |
邹蓉, 蒋运生, 史艳财, 等. 黄根总黄酮提取工艺研究[J]. 山东农业大学学报(自然科学版), 2014(5): 651-655. DOI:10.3969/j.issn.1000-2324.2014.05.003 |
| [17] |
韩月, 李占君, 李梦媛, 等. 响应面优化油桦中三萜类化合物提取工艺[J]. 森林工程, 2021, 37(2): 79-85. DOI:10.3969/j.issn.1006-8023.2021.02.012 |
| [18] |
邓梦琴, 何夏怡, 何慕怡, 等. 响应面法优化菠萝蜜果皮黄酮提取工艺[J]. 食品工业科技, 2016, 37(5): 222-227. |
| [19] |
焦文静, 林洁荣, 叶健军, 等. 响应面分析法优化紫象草花青素提取工艺[J]. 黑龙江畜牧兽医, 2015(19): 11-15, 20, 294. |
| [20] |
许静雅, 苏小军, 李清明, 等. 响应面法优化淮山中总黄酮提取工艺的研究[J]. 中国酿造, 2016, 35(5): 115-118. |
| [21] |
蔡碧琼. 稻壳黄酮类化合物的提取、精制及抗氧化活性研究[D]. 福州: 福建师范大学, 2008.
|
| [22] |
朱会霞. 覆盆子黄酮抗氧化活性研究[J]. 现代食品科技, 2012, 28(10): 1302-1305. |
| [23] |
朱成豪, 唐健民, 韦霄, 等. 鳞尾木中总黄酮含量测定及抗氧化活性研究[J]. 食品研究与开发, 2019, 40(20): 168-175. |
| [24] |
宋越冬, 陈晓庆, 张毓敏, 等. 荞麦叶黄酮的提取工艺优化及其抗氧化性[J]. 食品工业科技, 2021, 42(7): 180-187. |



