2. 广西壮族自治区中国科学院广西植物研究所, 广西植物功能物质研究与利用重点实验室, 广西桂林 541006;
3. 广西雅长兰科植物国家级自然保护区管理中心, 广西百色 533209
2. Guangxi Key Laboratory of Functional Phytochemicals Research and Utilization, Guangxi Institute of Botany, Guangxi Zhuang Autonomous Region and Chinese Academy of Sciences, Guilin, Guangxi, 541006, China;
3. Guangxi Yachang Orchid National Nature Reserve Management Center, Baise, Guangxi, 533209, China
兜兰属植物的花朵呈兜状,独具特色,花色艳丽且花期持久[1],犹如精灵般存在,具有极高的观赏价值。近年来,兜兰在花卉市场上备受瞩目,越来越多的人因其独特的造型、较高的观赏价值将其列为高档花卉[2]。兜兰属植物种类较为丰富,据目前研究发现已有原生种96种,主要集中分布在中国西南部以及东南亚等地[3, 4]。我国国产兜兰大多分布于热带亚热带的高海拔(1 000 m以上)地区,在广西分布较多,一般生长于石山、疏灌丛中或林缘地带,喜温暖湿润环境,不喜阳光直射、光照强的地带,且兜兰要求排水良好的土壤,靠其根部疏水防止根部腐烂。我国兜兰属植物种类较多,约有18种,其中约有9种分布于广西,但因频繁采挖、交易等导致兜兰属植物居群逐渐缩小,成为国家以及国际稀有物种。兜兰属所有物种均被列入《濒危野生动植物种国际贸易公约》(CITES)[5]。2021年新颁布的《国家重点保护植物名录》中,除了带叶兜兰和硬叶兜兰被列为国家Ⅱ级保护植物外,其余兜兰属植物均被列为国家Ⅰ级保护植物。
我国境内分布的兜兰一般生长于石山缝隙[6, 7],由于近年来人类对森林的开采破坏了兜兰赖以生存的环境,导致兜兰植物居群缩小。为保护国家重点保护物种兜兰,研究其生存环境及生长状况具有重要意义。我国目前对兜兰的研究主要在遗传多样性[8]、种群结构[9]、居群分布[10]以及繁殖培育[11]等方面,对兜兰光合生物学特性的研究报道较少。本研究对3种原产地原生种兜兰植物进行光合参数的相关研究,测定其光响应曲线、CO2响应曲线以及叶绿素含量等相关参数,为兜兰植物引种栽培提供科学的方法,为大规模培育种植提供指导,从而实现兰科植物资源的可持续发展。
1 材料与方法 1.1 试验地概况试验场地位于广西雅长兰科植物国家级自然保护区科普园内。保护区地处桂西中亚热带季风气候区,年平均气温16.3℃,年平均日照数1 303.7-1 698.7 h,年平均降水量940.8-1 216.9 mm。总的来说,保护区常年气候温和,冬无严寒,夏无酷暑。带叶兜兰(Paphiopedilum hirsutissimum)、长瓣兜兰(P.dianthum)、硬叶兜兰(P.micranthum)为迁地保护的成年植株,种植于科普园后山,长势良好。
1.2 方法 1.2.1 光响应曲线的测定选取长势最佳的硬叶兜兰、带叶兜兰以及长瓣兜兰作为试验苗,每个物种测量3株重复,以兜兰的成熟叶片为试验材料,在晴朗天气的上午9:00-11:30,携带Li-6400便携式光合仪(LI-COR, USA)测定这3种兜兰属植物的光响应曲线数据。光响应曲线数据的测定采用内置红蓝光源,光合有效辐射(PAR)依次设置为1 600 μmol·m-2·s-1、1 400 μmol·m-2·s-1、1 200 μmol·m-2·s-1、1 000 μmol·m-2·s-1、800 μmol·m-2·s-1、600 μmol·m-2·s-1、400 μmol·m-2·s-1、200 μmol·m-2·s-1、150 μmol·m-2·s-1、100 μmol·m-2·s-1、80 μmol·m-2·s-1、60 μmol·m-2·s-1、40 μmol·m-2·s-1、20 μmol·m-2·s-1、0 μmol·m-2·s-1,其他环境测定条件控制为相对湿度65%、叶室温度25℃、叶室CO2浓度400 μmol·mol-1。采用非直角双曲线模型对净光合速率(Pn)与光照强度(以下简称“光强”)进行拟合,用Pn-PAR做出光响应曲线图,其计算公式[12]如下:
| $\begin{align} & \ \ \ \ \ \ \ \ \ {{P}_{\text{n}}}(I)= \\ & \frac{\alpha I+{{P}_{\max }}-\sqrt{{{\left( \alpha I+{{P}_{\max }} \right)}^{2}}-4\theta \alpha I{{P}_{\max }}}}{2\theta }-{{R}_{\text{d}}}, \\ \end{align}$ | (1) |
式中,Pn为净光合速率;I为光强(PAR);θ为曲线的曲率;α为植物光合作用对光响应曲线在I=0时的斜率,即光响应曲线的初始斜率,也称为初始量子效率;Pmax为最大净光合速率;Rd为暗呼吸速率。
1.2.2 CO2响应曲线的测定在晴朗天气的上午9:00-11:30,携带Li-6400便携式光合仪(LI-COR, USA)测定这3种兜兰属植物的CO2响应曲线数据。测定PAR设定为600 μmol·m-2·s-1,测定时叶室中CO2浓度设置顺序为50 μmol·mol-1、100 μmol·mol-1、150 μmol·mol-1、200 μmol·mol-1、300 μmol·mol-1、400 μmol·mol-1、600 μmol·mol-1、800 μmol·mol-1、1 000 μmol·mol-1、1 200 μmol·mol-1、1 400 μmol·mol-1、1 600 μmol·mol-1、2 000 μmol·mol-1,保证在每个CO2浓度下平衡时间不少于180 s,测得的数据采用M-M曲线模型拟合,用Pn-Ci做出CO2响应曲线图,其计算公式[13, 14]如下:
| ${{P}_{\text{n}}}\left( {{C}_{\text{i}}} \right)=\frac{{{P}_{\max }}{{C}_{\text{i}}}}{{{C}_{\text{i}}}+K}-{{R}_{\text{p}}}, $ | (2) |
式中,Pn为净光合速率,Ci为胞间CO2浓度,Pmax为潜在最大净光合速率,Rp为光呼吸速率,K为Michaelis-Menten常数。
1.2.3 叶绿素相对含量(SPAD值)的测定采用叶绿素含量测定仪(SPAD-502,Japan),选取生长状况较好的叶片,擦净灰尘,选取不同位置,每个位置重复测量5次。
1.3 数据处理和分析通过SPSS 25.0进行数据分析,采用邓肯检验在0.05水平上进行差异显著性分析,通过非直角双曲线模型拟合光响应曲线(Pn-PAR),计算表观量子效率(AQY)、最大净光合速率(Pmax)、暗呼吸速率(Rd);通过M-M曲线模型拟合CO2响应曲线(Pn-Ci)[7, 8],计算最大净光合速率(Pmax)、光呼吸速率(Rp)、初始羧化效率α。对200 μmol·m-2·s-1以下的光强采用线性回归分析计算得出的斜率即为表观量子效率(AQY),Pn=0即得光补偿点(LCP),Pn=Pmax即得光饱和点(LSP);同理对CO2响应曲线前4点坐标作线性回归分析计算得出的斜率即为羧化效率(CE),Pn=0即得CO2补偿点(CCP),Pn=Pmax即得CO2饱和点(CSP)。
2 结果与分析 2.1 3种兜兰净光合速率对光强的响应特征3种兜兰属植物叶片光响应曲线如图 1所示。3种兜兰变化趋势大致相似,当光强为0 μmol·m-2·s-1时,3种兜兰的Pn值均小于0,反映出其在无光强时的呼吸作用。当PAR在0-200 μmol·m-2·s-1时,净光合速率陡然上升,几乎呈线性增加变化趋势;当光强在200-800 μmol·m-2·s-1时,随着PAR的增加,净光合速率的增长速度逐渐减慢;当光强在1 000-1 800 μmol·m-2·s-1时,3种兜兰属植物的净光合速率基本稳定不变或少许升高。从图 1可以看出,硬叶兜兰净光合速率高于长瓣兜兰和带叶兜兰,带叶兜兰和长瓣兜兰净光合速率较为接近。
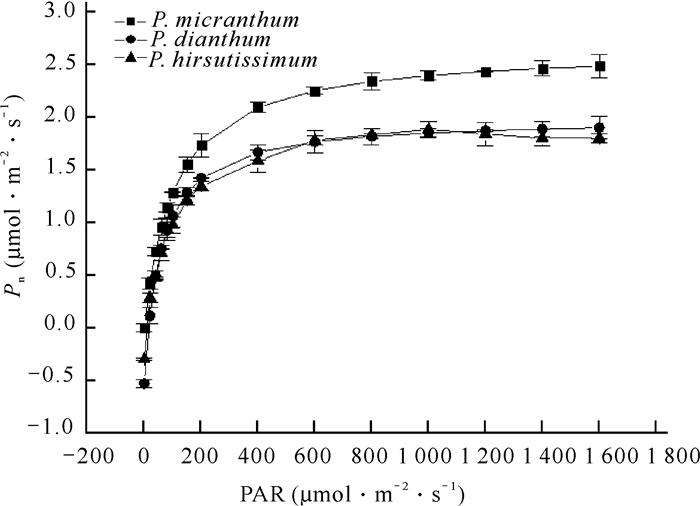
|
| 图 1 3种兜兰属植物叶片光响应曲线 Fig.1 Leaf photosynthesis-light response curve of 3 species of Paphiopedilum |
如表 1所示,3种兜兰属植物光响应特征参数中除了暗呼吸速率(Rd),硬叶兜兰的最大净光合速率(Pmax)、光补偿点(LCP)、光饱和点(LSP)以及表观量子效率(AQY)均为全组最高,且显著高于其余两种兜兰(P<0.05),暗呼吸速率(Rd)表现为长瓣兜兰(0.530 μmol·m-2·s-1)显著高于硬叶兜兰和带叶兜兰(分别为0.098 μmol·m-2·s-1和0.341 μmol·m-2·s-1),说明长瓣兜兰在光强较弱时或无光强时消耗的有机物量较大。以上结果表明3种兜兰光合生理特性虽略有差异,但均对弱光有较好的吸收,说明3种兜兰适合种植于较荫蔽的地方。
| 物种 Species |
最大净光合速率(μmol·m-2·s-1) Pmax(μmol·m-2·s-1) |
光补偿点(μmol·m-2·s-1) LCP(μmol·m-2·s-1) |
光饱和点(μmol·m-2·s-1) LSP(μmol·m-2·s-1) |
表观量子效率 AQY |
暗呼吸速率(μmol·m-2·s-1) Rd(μmol·m-2·s-1) |
| P.micranthum | 2.719±0.291a | 15.65±1.531a | 578.74±2.474a | 0.042±0.016a | 0.098±0.056c |
| P.dianthum | 2.015±0.147b | 10.34±1.423c | 481.25±1.034b | 0.032±0.023b | 0.530±0.021a |
| P.hirsutissimum | 1.836±0.039b | 12.79±0.419b | 467.72±3.148b | 0.027±0.009bc | 0.341±0.018b |
| Note: Different lowercase letters indicate significant difference at the 5% level | |||||
2.2 3种兜兰在不同光强下的光合参数分析
不同光强(PAR)与蒸腾速率(Tr)、胞间CO2浓度(Ci)、气孔导度(Gs)之间的关系如图 2所示。从图 2(a)可以看出,随着光强的增加,Tr虽有起伏但整体仍呈稳定上升的趋势,光照越强,Tr越大,且3种兜兰Tr较为接近,在光强为0-200 μmol·m-2·s-1时,3种兜兰的Tr均呈现上下波动不稳定的趋势;当PAR在800-1 600 μmol·m-2·s-1时,Tr表现为长瓣兜兰>带叶兜兰>硬叶兜兰。从图 2(b)可以看出,随着光强的增加,Ci整体呈现先下降后上升的趋势。在光强为100 μmol·m-2·s-1左右时,3种兜兰的Ci值迅速下降至最低,在光强为300-1 600 μmol·m-2·s-1时,Ci虽有升降但整体仍呈上升状态,3种兜兰的Ci变化趋势也大致相似,无明显差异。从图 2(c)可以看出,随着光强的增加,3种兜兰的Gs整体呈上升趋势,且3种兜兰趋势一致。在0-400 μmol·m-2·s-1光照条件下,Gs表现为带叶兜兰>长瓣兜兰>硬叶兜兰;在光强为700-1 400 μmol·m-2·s-1时,Gs大小为长瓣兜兰>带叶兜兰>硬叶兜兰。以上结果表明3种兜兰随着光强变化,响应特征参数变化趋势较为一致,无显著差异,表明3种兜兰对环境的适应性较为相似。
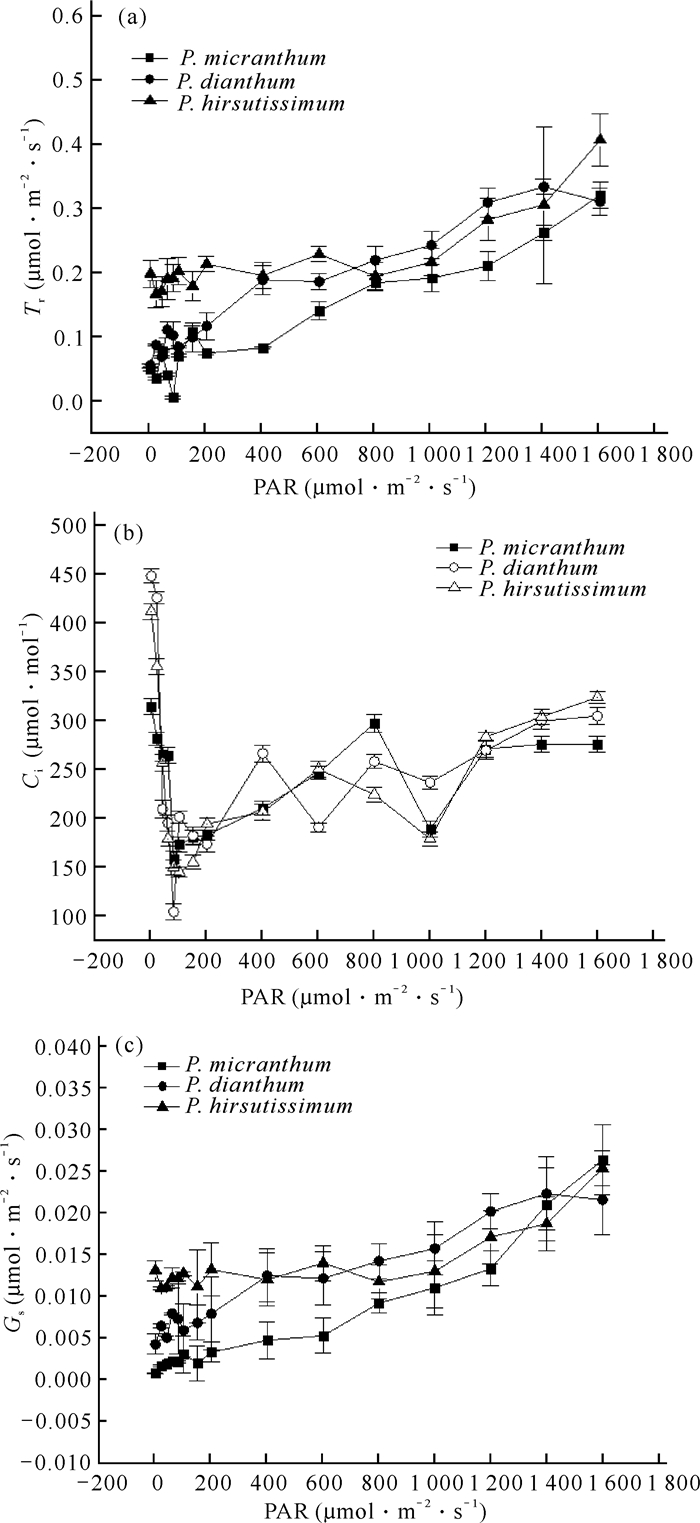
|
| 图 2 3种兜兰光响应曲线下PAR与Tr (a)、Ci (b)、Gs (c)之间的关系 Fig.2 Relationship between PAR and Tr (a), Ci (b), Gs (c) under the light response curves of the three Paphiopedilum species |
2.3 3种兜兰光合参数相关性分析
由表 2可知,硬叶兜兰中PAR与Gs、Pn、Tr呈显著正相关,Tr与Gs呈显著正相关;长瓣兜兰中PAR与Gs、Pn、Tr呈显著正相关,Tr与Pn、Gs呈显著正相关,Pn与Gs呈显著正相关;带叶兜兰中PAR与Gs、Pn、Tr呈显著正相关,Tr与Gs呈显著正相关,Pn与Ci呈显著负相关。3种兜兰属植物的光响应特征参数相关性较为类似,只有带叶兜兰的Pn与Ci呈显著负相关,与其余2种相比具有差异性。长瓣兜兰的Pn与Gs呈显著正相关,Yang等[15]与Zhang等[16]研究发现兜兰属中Pn与Gs呈显著正相关,且兜兰植物的光合能力较低, 与其叶片内部结构具有显著相关性;研究还发现光合能力的高低与其保卫细胞叶绿体和特有的气孔解剖结构有关。
| 物种 Species |
光强 PAR |
蒸腾速率 Tr |
净光合速率 Pn |
胞间CO2浓度 Ci |
气孔导度 Gs |
||
| P.micranthum | PAR | 1 | |||||
| Tr | 0.968** | 1 | |||||
| Pn | 0.833* | 0.769 | 1 | ||||
| Ci | 0.687 | 0.675 | 0.387 | 1 | |||
| Gs | 0.962** | 0.948** | 0.741 | 0.646 | 1 | ||
| P.dianthum | PAR | 1 | |||||
| Tr | 0.935** | 1 | |||||
| Pn | 0.809* | 0.812* | 1 | ||||
| Ci | 0.13 | 0.082 | -0.342 | 1 | |||
| Gs | 0.981** | 0.91** | 0.826* | 0.102 | 1 | ||
| P.hirsutissimum | PAR | 1 | |||||
| Tr | 0.865* | 1 | |||||
| Pn | 0.84* | 0.108 | 1 | ||||
| Ci | 0.234 | 0.341 | -0.881* | 1 | |||
| Gs | 0.823* | 0.996** | 0.057 | 0.385 | 1 | ||
| Note: **indicates extremely significant differences at the 0.9-1 level, *indicates significant differences at the 0.8-0.9 level | |||||||
2.4 3种兜兰净光合速率对CO2浓度的响应特征
3种兜兰属植物的净光合速率对CO2浓度响应曲线的变化趋势基本一致(图 3)。当Ci在50-200 μmol·mol-1时,Pn迅速上升,几乎呈线性增长趋势;当Ci达到500-1 000 μmol·mol-1时,Pn的增长速率依旧较快,但明显放缓;随着Ci增加至1 000-2 000 μmol·mol-1,净光合速率增长速度逐渐减缓,可以预估在Ci大于2 000 μmol·mol-1时,其光合速率会逐渐稳定。当Ci在600-2 000 μmol·mol-1时,硬叶兜兰的净光合速率最大,其次是带叶兜兰,长瓣兜兰净光合速率最小。硬叶兜兰的净光合速率之所以增加迅速,是因为其能充分利用CO2使自身达到最大光合速率,对物质进行充分累积,储存能量,对CO2的吸收效果优于带叶兜兰和长瓣兜兰。
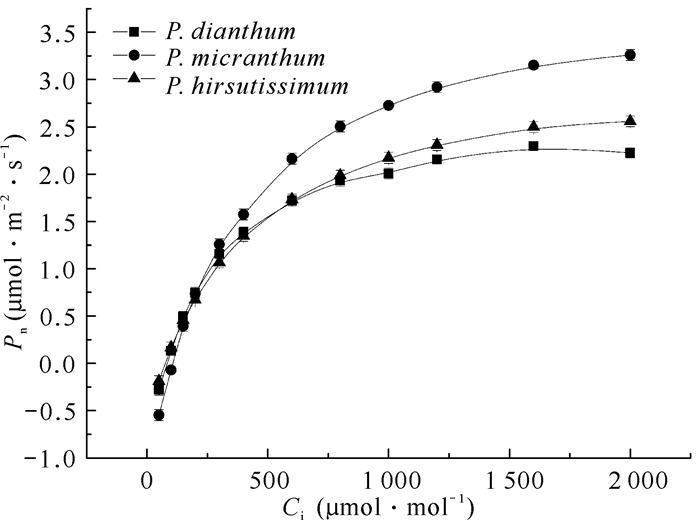
|
| 图 3 3种兜兰属植物叶片CO2响应曲线 Fig.3 Leaf CO2 response curve of three Paphiopedilum species |
如表 3所示,3种兜兰CO2响应参数中硬叶兜兰的最大净光合速率(Pmax)、CO2补偿点(CCP)、CO2饱和点(CSP)、羧化效率(CE)以及光呼吸速率(Rp)均为全组最高,且显著高于其余两种兜兰(P<0.05),说明硬叶兜兰对CO2利用能力较强,能充分进行光合作用,储存物质和能量,光合效果较好。长瓣兜兰和带叶兜兰的CO2响应参数均较为接近。3种兜兰的Rp值虽较为接近,但长瓣兜兰显著低于硬叶兜兰,说明长瓣兜兰在光下释放CO2的速率小,呼吸作用较弱,硬叶兜兰的光呼吸速率较大,呼吸作用较强,消耗物质较多。以上结果表明3种兜兰植物CO2响应参数较为相似,对CO2有较高的利用度,能显著提高植物光合能力,促进植物内部能量及物质的转化。
| 物种 Species |
最大净光合速率(μmol·m-2·s-1) Pmax(μmol·m-2·s-1) |
CO2补偿点(μmol·m-2·s-1) CCP(μmol·m-2·s-1) |
CO2饱和点(μmol·m-2·s-1) CSP(μmol·m-2·s-1) |
羧化效率(μmol·m-2·s-1) CE(μmol·m-2·s-1) |
光呼吸速率(μmol·m-2·s-1) Rp(μmol·m-2·s-1) |
| P.micranthum | 5.334±1.425a | 106.164±4.762a | 2 667.87±5.696a | 0.039±0.003 4a | 1.256±0.025a |
| P.dianthum | 3.718±0.138b | 84.014±2.878b | 1 749.36±2.643c | 0.023±0.001 2b | 0.925±0.005 2b |
| P.hirsutissimum | 3.887±1.574b | 79.865±3.342b | 2 484.42±4.893b | 0.017±0.001 8b | 1.026 9±0.074ab |
| Note: Different lowercase letters indicate a significant difference at the 5% level | |||||
2.5 3种兜兰SPAD值的比较
叶绿素是光合作用中最重要和最有效的色素,叶绿素的含量在一定程度上能反映植物同化物质的能力,即对光利用能力的强弱,其高低是光合作用强弱的一个重要指标。在3种兜兰中,硬叶兜兰叶绿素含量最高,长瓣兜兰次之,带叶兜兰最低(表 4),且硬叶兜兰和带叶兜兰间具有显著差异(P<0.05),这与其最大净光合速率的差异一致。叶绿素含量测定结果说明硬叶兜兰对光能的利用能力更强,带叶兜兰和长瓣兜兰的光合能力稍差。
| 物种 Species |
叶绿素含量 Chlorophyll content |
| P.micranthum | 58.13±1.426a |
| P.dianthum | 54.12±1.992ab |
| P.hirsutissimum | 51.88±2.138c |
| Note: Different lowercase letters indicate a significant difference at the 5% level | |
3 讨论
本研究中,通过光响应曲线可知不同光强下硬叶兜兰净光合速率(Pn)显著高于带叶兜兰和长瓣兜兰,低于常见的C3植物(10-25 μmol·m-2·s-1)[17],这与3种兜兰是阴生植物的结论一致,说明这3种兜兰适合培育于荫蔽的环境下。通过CO2响应曲线可以得出不同CO2浓度下的Pn值为硬叶兜兰>带叶兜兰>长瓣兜兰,且在CO2响应曲线下3种兜兰的Pn值均较光响应曲线下的Pn值显著提高,说明CO2能促进兜兰植物进行光合作用,可以适当增加空气中的CO2含量,促进植物物质积累,使其茁壮成长。
3种兜兰的光响应参数最大净光合速率(Pmax)、暗呼吸速率(Rd)、光饱和点(LSP)、光补偿点(LCP)以及表观量子效率(AQY)具有显著差异。当植物到达光饱和点后Pn值出现下降现象,饱和点的Pn值即为Pmax,这是由于植物随光强的增大出现光抑制现象,表明在光强增大时植物对光强较敏感[18],本研究发现硬叶兜兰对光的适应能力较强,Pmax较高,这与龙健等[19]对小叶兜兰的研究结果类似。暗呼吸速率(Rd)的高低反映植物消耗有机物的能力,长瓣兜兰和带叶兜兰的暗呼吸效率较高,消耗有机物较多,可能会导致其积累较少。LSP和LCP反映植物在不同光强下的适应能力,3种兜兰中,硬叶兜兰适应光强的范围较其他2种兜兰宽,但总体而言,3种植物适应光强的范围均较为狭窄,具有显著的阴生植物特征。AQY反映植物对弱光的利用能力,对弱光的利用能力越强,AQY值越大,本研究发现硬叶兜兰对弱光的利用效果更好。
3种兜兰的CO2响应参数中,Pmax、光呼吸速率(Rp)、CO2饱和点(CSP)和CO2补偿点(CCP)以及羧化效率(CE)具有显著差异。Pmax最大的为硬叶兜兰(5.334 μmol·m-2·s-1),说明硬叶兜兰对CO2的吸收利用能力较强。从CSP和CCP可以看出植物对CO2浓度的适应范围,硬叶兜兰对高浓度CO2的适应能力更强,而长瓣兜兰的适应范围较为狭窄。羧化效率(CE)的高低代表植物对CO2吸收能力的强弱,本研究中硬叶兜兰对CO2的吸收能力更强,但3种兜兰仍显著低于一般C3植物的羧化效率(0.06-0.12 μmol·m-2·s-1)[20]。
植物生长发育依靠光合作用,光合作用是它们赖以生存的方式和手段,其强弱不仅与外界环境因子(温度、水分、光照以及CO2含量等)相关,还与其自身的叶绿素含量[21]相关。本研究中SPAD值表现为硬叶兜兰(58.13)>长瓣兜兰(54.12)>带叶兜兰(51.88),这与其Pmax的变化趋势一致,说明叶绿素含量是影响兜兰光合作用的重要因素。
4 结论通过光合参数比较发现,3种兜兰在相同环境下光合生理特性较为相似,3种兜兰对光强的利用范围较为狭窄,其中硬叶兜兰较带叶兜兰和长瓣兜兰对光强的适应范围宽,在弱光下有较好吸收,且在弱光下有更多的物质积累,有利于其自身的生长发育;光照较强会产生光抑制现象,阻碍光合作用,从而导致兜兰生长缓慢甚至死亡。因此,3种兜兰植物应培育在光照较弱的环境下,如林下遮阴棚中。叶绿素是影响光合作用的重要因素,SPAD值越大,光合作用效果越好,本研究中SPAD值排序为硬叶兜兰>长瓣兜兰>带叶兜兰;另外,增加空气中CO2含量有利于提高兜兰植物的光合能力,较为显著地提高其Pn值,Pn值排序为硬叶兜兰>带叶兜兰>长瓣兜兰。在当今生态环境破坏严重、适宜生境越来越少的背景下,兜兰培育是保护兜兰资源的重要途径,本研究结果可为硬叶兜兰、带叶兜兰和长瓣兜兰的引种栽培及保护提供参考,对兜兰居群保护具有重要意义。
| [1] |
张艳艳, 方中明, 黄玮婷, 等. 3种兜兰在华南地区引种时的叶片形态及光合特性变化研究[J]. 广东农业科学, 2014, 41(5): 92-95, 99. |
| [2] |
邹金美, 康红涛, 陈羡德, 等. 2种兜兰在温室栽培条件下的光合代谢特性[J]. 闽南师范大学学报(自然科学版), 2017, 30(1): 68-72. |
| [3] |
刘仲健, 陈心启, 陈利君, 等. 中国兜兰属植物[M]. 北京: 科学出版社, 2009.
|
| [4] |
中国科学院中国植物志编辑委员会. 中国植物志: 第十九卷[M]. 北京: 科学出版社, 1999.
|
| [5] |
王燕君, 闻真珍, 蔡继业, 等. 4种兜兰光合特性研究[J]. 现代农业科技, 2011(20): 200-202, 204. DOI:10.3969/j.issn.1007-5739.2011.20.131 |
| [6] |
杨颖婕, 黄家林, 胡虹, 等. 中国兜兰属植物种质资源保护和利用研究进展[J]. 西部林业科学, 2021, 50(5): 108-112, 119. |
| [7] |
董艳莉. 杏黄兜兰的生物生态学特性及迁地栽培试验研究[D]. 北京: 中国林业科学研究院, 2006.
|
| [8] |
王文晓, 程浩, 徐玉凤, 等. 带叶兜兰5个野生居群表型多样性分析[J]. 植物遗传资源学报, 2020, 21(5): 1196-1206. |
| [9] |
潘发光, 叶钦良, 李玉峰, 等. 珍稀濒危植物紫纹兜兰的种群结构和数量动态[J]. 热带亚热带植物学报, 2020, 28(4): 375-384. |
| [10] |
唐凤鸾, 盘波, 赵健, 等. 极小种群野生植物海伦兜兰的地理分布及生境调查[J/OL]. 广西科学院学报, 2022, 38(1): 40-44[2022-01-10]. https://kns.cnki.net/kcms/detail/45.1075.N.20211214.1024.002.html.
|
| [11] |
邓莎, 吴艳妮, 吴坤林, 等. 14种中国典型极小种群野生植物繁育特性和人工繁殖研究进展[J]. 生物多样性, 2020, 28(3): 385-400. |
| [12] |
LEWIS J D, OLSZYK D, TINGEY D T. Seasonal patterns of photosynthetic light response in Douglas-fir seedlings subjected to elevated atmospheric CO2 and temperature[J]. Tree Physiology, 1999, 19(4/5): 243-252. |
| [13] |
HARLEY P C, SHARKEY T D. An improved model of C3 photosynthesis at high CO2: Reversed O2 sensitivity explained by lack of glycerate reentry into the chloroplast[J]. Photosynthesis Research, 1991, 27(3): 169-178. DOI:10.1007/BF00035838 |
| [14] |
叶子飘. 光合作用对光和CO2响应模型的研究进展[J]. 植物生态学报, 2010, 34(6): 727-740. DOI:10.3773/j.issn.1005-264x.2010.06.012 |
| [15] |
YANG Z H, HUANG W, YANG Q Y, et al. Anatomical and diffusional determinants inside leaves explain the difference in photosynthetic capacity between Cypripedium and Paphiopedilum, Orchidaceae[J]. Photosynthesis Research, 2018, 136(3): 315-328. DOI:10.1007/s11120-017-0466-8 |
| [16] |
ZHANG S B, GUAN Z J, CHANG W, et al. Slow photosynthetic induction and low photosynthesis in Paphiopedilum armeniacum are related to its lack of guard cell chloroplast and peculiar stomatal anatomy[J]. Physiologia Plantarum, 2011, 142(2): 118-127. |
| [17] |
冯巧, 权秋梅, 皮华强, 等. 虾脊兰光合-光响应曲线的拟合及分析[J]. 西华师范大学学报(自然科学版), 2014, 35(4): 333-338. |
| [18] |
沈立明, 戴中武, 钟惠, 等. 3种独蒜兰属植物的光合特性[J]. 热带作物学报, 2021, 42(5): 1355-1360. |
| [19] |
龙健, 周建威, 冉景丞, 等. 茂兰国家级自然保护区濒危植物小叶兜兰生态适应性研究[J]. 安徽农业科学, 2009, 37(27): 13049-13051. |
| [20] |
史艳财, 蒋运生, 覃芳, 等. 珍稀濒危植物喙核桃的光合特性研究[J]. 广西科学院学报, 2020, 36(1): 73-77. |
| [21] |
顾骏飞, 周振翔, 李志康, 等. 水稻低叶绿素含量突变对光合作用及产量的影响[J]. 作物学报, 2016, 42(4): 551-560. |



