2. 广西壮族自治区中国科学院广西植物研究所, 广西植物功能物质研究与利用重点实验室, 广西桂林 541006;
3. 广西雅长兰科植物国家级自然保护区管理中心, 广西百色 533209
2. Guangxi Key Laboratory of Functional Phytochemicals Research and Utilization, Guangxi Institute of Botany, Guangxi Zhuang Autonomous Region and Chinese Academy of Siences, Guilin, Guangxi, 541006, China;
3. Guangxi Yachang Orchid National Nature Reserve Management Center, Baise, Guangxi, 533209, China
鹅毛玉凤花(Habenaria dentata)系兰科玉凤花属(Habenaria)的地生草本植物,主要分布于云南、安徽、福建、广东以及广西海拔为190-2 300 m的沟边或山坡林地[1],多见于土层较厚、光照较充足的山坡林地、山地道路两侧。鹅毛玉凤花作为一种药用植物,其药用部位为地下块茎,称双肾参、双肾子、吊阳草(浙江)、白参草(四川)、鸡卵参(广西),在傣药中又称“婉康盖”[2],其性平、味甘、微苦,具有散气、解毒[3]、滋补肺肾、止咳化痰[4]、利尿、消炎等功效[5],常用于治疗病后体虚、睾丸炎、肾虚腰痛、阳痿、肺痨咳嗽、疝气、白带、白浊、尿路感染等疾病[6]。
目前,鹅毛玉凤花的研究主要集中于组织培养、菌根真菌的分离和鉴定等方面[7-11],对于化学成分、药理药效等方面的研究却鲜有报道。糖类作为人类生命中继蛋白质、核酸和脂类之后的第四大重要物质,在机体免疫调节、抗疲劳以及癌症的诊断和治疗等方面发挥着重要作用。因此,本研究以鹅毛玉凤花中的总多糖为研究对象,拟采用超声辅助提取法对鹅毛玉凤花总多糖进行提取,并结合响应面法对提取工艺进行优化,确定其最佳提取工艺,并利用DPPH自由基(DPPH·)清除率、羟基自由基(·OH)清除率、超氧阴离子自由基(O2-·)清除率和总还原力评价其抗氧化能力,为鹅毛玉凤花总多糖的开发利用提供科学理论依据。
1 材料与方法 1.1 材料 1.1.1 材料与试剂鹅毛玉凤花新鲜块茎,采自广西壮族自治区百色市乐业县,经广西植物研究所黄俞淞副研究员鉴定为鹅毛玉凤花Habenaria dentata (Sw.) Schltr.块茎。葡萄糖对照品(批号:B21882,HPLC≥98%,上海源叶生物科技有限公司);95%乙醇、浓硫酸,购自西陇科学股份有限公司;5%苯酚溶液,购自阿拉丁试剂(上海)有限公司,以上均为分析纯试剂。
1.1.2 仪器与设备TU-1901型双光束紫外可见分光光度计,购自北京普析通用仪器有限责任公司;DL-720E型智能超声波、AE200S型万分之一电子分析天平,均购自梅特勒-托利多仪器(上海)有限公司;HH-S4型数显恒温水浴锅,购自金坛双捷实验仪器厂;QE-100型高速粉碎机,购自浙江屹立工贸有限公司;Multifuge X1R台式高速冷冻离心机,购自赛默飞世尔科技(中国)公司。
1.2 方法 1.2.1 样品处理鹅毛玉凤花块茎洗净,切片,60℃烘干48 h,粉碎,过60目筛,制成样品粉末,备用。
1.2.2 标准溶液及标准曲线的制备精密称取105℃干燥至恒重的葡萄糖48 mg,用蒸馏水溶解并定容于100 mL的容量瓶中,摇匀,得到0.48 mg/mL的标准溶液。精密吸取葡萄糖标准溶液0.1 mL、0.2 mL、0.3 mL、0.4 mL、0.5 mL,并分别用蒸馏水补至2 mL。然后先加入1 mL 5%的苯酚溶液,混匀后再加入4 mL的浓硫酸,摇匀,室温下放置5 min后,于80℃水浴15 min,迅速冷却至室温,以相同方法处理下的空白试剂作为参比溶液,于490 nm处测定吸光值。以葡萄糖浓度(μg/mL)为横坐标,吸光值为纵坐标,制作标准曲线并计算回归方程,回归方程为Y=0.0444x-0.0013,R2=0.999 6。
1.2.3 供试品溶液的制备和测定称取0.2 g样品粉末,按照料液比1:59 (g/mL),加入11.8 mL去离子水,在74℃、功率300 W的条件下提取7 h。冷却至室温后,离心,取上清液并采用Sevag法除蛋白,将正丁醇、氯仿(V: V=1:4)混合,再与提取液混合,萃取,保留水层,再加入3倍体积95%乙醇,低温醇沉10 h。离心后,弃上清液,用热水溶解多糖沉淀,并定容于50 mL容量瓶中,即得供试品溶液。按照标准曲线的步骤进行加样,测定吸光度。取3组平行实验结果计算总多糖得率,总多糖得率的计算方法如下:
| $ \text { 总多糖得率 }(\%)=\frac{C \times V_{1} \times D}{W \times V_{2} \times 10^{6}} \times 100 \% \text {, } $ | (1) |
式中,C为提取液中总多糖浓度(μg/mL);V1为提取液总体积(mL);V2为测定时所用样品的体积(mL);D为稀释倍数;W为样品质量(g)。
1.3 单因素试验 1.3.1 提取时间对鹅毛玉凤花总多糖得率的影响准确称取0.2 g样品粉末,按照1:60 (g/mL)料液比,加入12 mL去离子水,在80℃、功率为300 W的条件下,分别超声提取1 h、3 h、5 h、7 h、9 h。按照1.2.3节供试品溶液的制备和测定方法进行加样,于490 nm处测定吸光值,计算总多糖得率,每个处理做3组重复。选取最佳提取时间,然后进行下一步单因素试验。
1.3.2 料液比对鹅毛玉凤花总多糖得率的影响准确称取0.2 g样品粉末,分别按照料液比1:40 (g/mL)、1:50 (g/mL)、1:60 (g/mL)、1:70 (g/mL)、1:80 (g/mL),分别加入8 mL、10 mL、12 mL、14 mL、16 mL去离子水,在80℃、功率为300 W、提取时间为1.3.1节试验所得的最优时间的条件下进行超声提取。按照1.2.3节供试品溶液的制备和测定方法进行加样,于490 nm处测定吸光值,计算总多糖得率,每个处理做3组重复。选取最佳料液比,然后进行下一步单因素试验。
1.3.3 提取温度对鹅毛玉凤花总多糖得率的影响准确称取0.2 g样品粉末,按照1.3.2节试验所得的最优料液比,加入相应体积的去离子水,分别在50℃、60℃、70℃、80℃、90℃,功率为300 W,提取时间为1.3.1节试验中所得的最优时间的条件下进行提取。按照1.2.3节供试品溶液的制备和测定方法进行加样,于490 nm处测定吸光值,计算总多糖得率,每个处理做3组重复。
1.4 响应面分析根据单因素试验结果,应用Design Expert 8.0.6软件进行响应面试验设计。以提取时间(A)、料液比(B)和提取温度(C)为自变量,以总多糖得率为响应值,对17个试验点进行组合试验。每个自变量分别有低、中、高3个水平,对这3个水平分别按照-1,0,1进行编码,因素与水平见表 1。
| 水平 Level |
A: 提取时间(h) A: Extraction time (h) |
B: 料液比(g/mL) B: Solid-liquid ratio (g/mL) |
C: 提取温度(℃) C: Extraction temperature (℃) |
| -1 | 3 | 1:50 | 60 |
| 0 | 5 | 1:60 | 70 |
| 1 | 7 | 1:70 | 80 |
1.5 抗氧化活性测定
在最佳提取条件下提取鹅毛玉凤花总多糖,并将提取液稀释成0.06 mg/mL、0.09 mg/mL、0.12 mg/mL、0.15 mg/mL、0.18 mg/mL 5个浓度,测定其DPPH· 清除率、·OH清除率、O2-·清除率和总还原力,综合评价其抗氧化能力。
1.5.1 鹅毛玉凤花总多糖对DPPH·清除能力的测定参考吴冬凡等[12]的方法对DPPH·清除能力进行测定。①取10 mL的试管依次编号,加入4 mL不同浓度的样液于试管中,加入等体积的0.1 mmol/L的DPPH溶液,充分混匀,在室温下避光保存30 min后,用无水乙醇作参比溶液,于517 nm处测定样品液的吸光值,记为A1。②用4 mL无水乙醇代替①中DPPH溶液,测定吸光值,记为A2。③用4 mL蒸馏水代替①中样液,与0.1 mmol/L DPPH溶液等体积混合,测定吸光值,记为A0。以相同浓度的抗坏血酸作阳性对照。
| $ \mathrm{DPPH} \cdot \text { 清除率 }(\%)=\left(1-\frac{A_{1}-A_{2}}{A_{0}}\right) \times 100 \% 。$ | (2) |
·OH清除能力的测定参考Fenton反应体系[13],并稍作调整。①取10 mL的试管依次编号,加入2.0 mL不同浓度的样品溶液,然后依次加入1.0 mL 2.5 mmol/L的水杨酸溶液、1.0 mL 5 mmol/L的FeSO4溶液和2.0 mL的蒸馏水,充分混匀,加入1.0 mL 5 mmol/L的H2O2溶液启动反应,在37℃恒温水浴30 min后,用蒸馏水作参比溶液,于510 nm处测定吸光值,记为As。②用1.0 mL蒸馏水代替①中H2O2溶液,测定的吸光值记为Ab。③用2.0 mL蒸馏水代替①中样品溶液,测定的吸光值记为Ap。以相同浓度的抗坏血酸作阳性对照。
| $ \cdot \mathrm{OH} \text { 清除率 }(\%)=\left(1-\frac{A_{\mathrm{s}}-A_{\mathrm{b}}}{A_{\mathrm{p}}}\right) \times 100 \%。$ | (3) |
O2-·清除能力的测定参考杨永涛[14]的邻苯三酚自氧化法。①取10 mL试管依次编号,先加入4.5 mL Tris-HCl缓冲液(0.05 mol/L,pH值为8.2,25℃水浴20 min)和2.5 mL的蒸馏水,经过37℃水浴20 min后,再加入1.5 mL不同浓度的样品溶液和0.5 mL 25 mmol/L的邻苯三酚溶液,混合均匀,在25℃下水浴8 min,最后加入0.1 mL的8 mmol/L的HCl来终止反应,用蒸馏水作参比溶液,于320 nm处测定吸光值,记为Aq。②用0.5 mL的蒸馏水代替①中的邻苯三酚,测定的吸光值记为Ag。③用1.5 mL的蒸馏水代替①中的样品溶液做空白对照,记为Af。以相同浓度的抗坏血酸作阳性对照。
| $ \mathrm{O}_{2}^{-} \cdot \text { 清除率 }(\%)=\left(1-\frac{A_{\mathrm{q}}-A_{\mathrm{g}}}{A_{\mathrm{f}}}\right) \times 100 \%。$ | (4) |
总还原力测定参考朱成豪等[15]的方法。取2.0 mL不同浓度的样品溶液,先加入2.5 mL 0.2 mol/L的磷酸缓冲液,再加入2.5 mL 1%的K3Fe(CN)6溶液,混匀,在50℃条件下水浴20 min后,迅速冷却,最后加入2.5 mL 10%的三氯乙酸溶液来终止反应。取2.5 mL的上清液,加入2.5 mL的蒸馏水和0.5 mL的FeCl3溶液,混匀,10 min后,用蒸馏水作参比溶液,于700 nm处测定吸光值。以相同浓度的抗坏血酸做对照。
1.6 数据处理采用Excel 2010和SPSS 18.0软件进行数据处理与分析,绘图采用Origin 2019软件。
2 结果与分析 2.1 单因素试验结果 2.1.1 提取时间对鹅毛玉凤花总多糖得率的影响由图 1可知,随着提取时间的增加,鹅毛玉凤花总多糖得率呈先增加后减少的趋势,在提取时间为5 h时,总多糖得率最大,为9.09%。在达到最高点前,提取时间越长,总多糖的浸出效果越好,说明提取时间对鹅毛玉凤花总多糖得率存在一定的影响;但在达到最高点后,总多糖的得率开始下降,产生这一现象的原因可能是提取时间过长,导致部分多糖的结构被破坏。
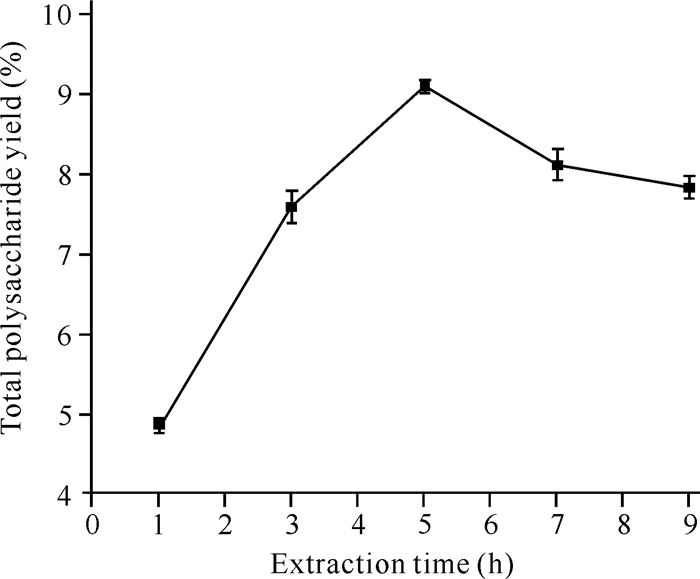
|
| 图 1 提取时间对总多糖得率的影响 Fig.1 Effect of extraction time on total polysaccharide yield |
2.1.2 料液比对鹅毛玉凤花总多糖得率的影响
由图 2可知,随着料液比的增加,鹅毛玉凤花总多糖得率先缓慢增加,并在料液比为1:60 (g/mL)时达到最大值,为7.7%。随着料液比继续增加,总多糖得率有所下降,但幅度较小。在得率达到最高点前,总多糖的浸出效果随着溶质的增加而增加;在达到最高点后,总多糖已经较为完全地浸出,即使料液比再继续增加,总多糖的得率也无明显变化。
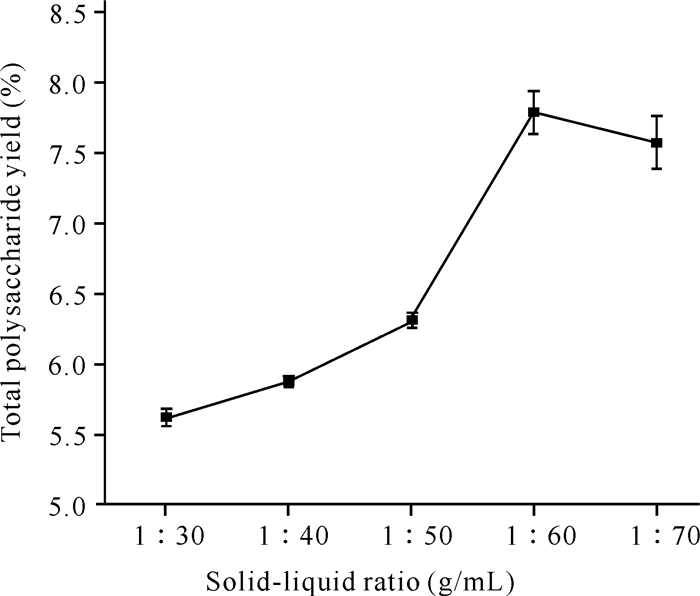
|
| 图 2 料液比对总多糖得率的影响 Fig.2 Effect of solid-liquid ratio on total polysaccharide yield |
2.1.3 提取温度对鹅毛玉凤花总多糖得率的影响
由图 3可知,随着提取温度的增加,鹅毛玉凤花总多糖得率明显升高,当温度为70℃时,得率达到最高点,为9.34%。达到最高点后,总多糖得率有下降的趋势,可能是由于温度过高导致总多糖水解。

|
| 图 3 提取温度对总多糖得率的影响 Fig.3 Effect of extraction temperature on total polysaccharide yield |
2.2 响应面试验结果与分析 2.2.1 响应面试验结果
基于单因素试验结果,并根据因素水平设计三因素三水平响应面分析试验,得到17个试验点的试验结果,如表 2所示。
| 试验号 Test number |
A: 提取时间(h) A: Extraction time (h) |
B: 料液比 (g/mL) B: Soild-liquid ratio (g/mL) |
C: 提取温度(℃) C: Extraction temperature (℃) |
总多糖得率(%) Total polysaccharide yield (%) |
| 1 | 3 | 1:50 | 70 | 6.86 |
| 2 | 5 | 1:60 | 70 | 9.14 |
| 3 | 5 | 1:50 | 80 | 7.50 |
| 4 | 7 | 1:50 | 70 | 8.60 |
| 5 | 5 | 1:60 | 70 | 9.43 |
| 6 | 5 | 1:60 | 70 | 9.50 |
| 7 | 5 | 1:50 | 60 | 5.69 |
| 8 | 7 | 1:60 | 80 | 8.31 |
| 9 | 5 | 1:70 | 60 | 6.49 |
| 10 | 5 | 1:70 | 80 | 7.55 |
| 11 | 7 | 1:70 | 70 | 7.89 |
| 12 | 5 | 1:60 | 70 | 8.13 |
| 13 | 3 | 1:70 | 70 | 6.79 |
| 14 | 5 | 1:60 | 70 | 9.26 |
| 15 | 3 | 1:60 | 80 | 5.96 |
| 16 | 7 | 1:60 | 60 | 6.87 |
| 17 | 3 | 1:60 | 60 | 6.61 |
由表 3的数据可知,模型的显著性检测P值为0.005 7 (P < 0.01,极显著),且失拟误差显著性检测P值为0.495 2(P>0.05,不显著),模型的相关系数为0.912 9,矫正系数为0.800 9,综合上述数据可知,模型的拟合效果较好,误差小,选用的模型可以较为真实地反映出各因素与鹅毛玉凤花总多糖得率的关系。
| 方差来源 Source of variance |
平方和 Sum of square |
自由度 Degree of freedom |
均方 Mean square |
F值 F value |
P值 P value |
| Model | 22.06 | 9 | 2.45 | 8.15 | 0.005 7** |
| A | 3.73 | 1 | 3.73 | 12.40 | 0.009 7** |
| B | 4.795E-004 | 1 | 4.795E-004 | 1.595E-003 | 0.969 3 |
| C | 1.67 | 1 | 1.67 | 5.57 | 0.049 3* |
| AB | 0.10 | 1 | 0.10 | 0.34 | 0.576 7 |
| AC | 1.10 | 1 | 1.10 | 3.65 | 0.097 9 |
| BC | 0.14 | 1 | 0.14 | 0.46 | 0.521 2 |
| A2 | 2.14 | 1 | 2.14 | 7.13 | 0.032 0* |
| B2 | 3.01 | 1 | 3.01 | 10.00 | 0.015 9* |
| C2 | 8.74 | 1 | 8.74 | 29.08 | 0.001 0** |
| Residual | 2.10 | 7 | 0.30 | ||
| Misfit error | 0.88 | 3 | 0.29 | 0.95 | 0.495 2 |
| Pure error | 1.23 | 4 | 0.31 | ||
| Total error | 24.16 | 16 | |||
| Note: *indicates significant differences (P < 0.05);**indicates extremely significant differences (P < 0.01) | |||||
对表 3的数据进行二项多元回归拟合,得到提取时间(A)、料液比(B)和提取温度(C) 3因素的回归模型为Y=9.09+0.68A+7.74E-003B+0.46C-0.16AB+0.52AC-0.19BC-0.71A2-0.85B2-1.44C2,其中Y值表示鹅毛玉凤花中总多糖的得率。一次项中,提取时间(A)对总多糖得率的线性效应为极显著水平(P=0.009 7 < 0.01),料液比(B)对总多糖得率的线性效应不显著(P=0.969 3>0.05),提取温度(C)为显著水平(P=0.049 3 < 0.05);二次项中,AB、BC、AC的影响效果不显著,A2和B2的影响效果为显著水平(P < 0.05),C2的影响效果为极显著水平(P=0.001 < 0.01)。各因素对总多糖得率的影响顺序为提取温度二次项(C2)>提取时间一次项(A)>提取温度一次项(C)>料液比二次项(B2)>提取时间二次项(A2)>提取时间-提取温度交互项(AC)>料液比-提取温度交互项(BC)>提取时间-料液比交互项(AB)>料液比一次项(B)。由F值可知,单因素对总多糖得率的影响大小依次为提取时间(A)>提取温度(C)>料液比(B)。
2.2.2 响应面交互作用分析利用Design Expert 8.0.6软件和回归模型,绘出相应的等高线和响应面三维曲线图。等高线越密集,表明该因素对总多糖得率的影响效果越显著。两个因素交互作用的强弱还可以通过等高线的形状来判断,等高线若呈椭圆形则说明两因素的交互作用显著。此外,三维立体图的曲面倾斜程度也可以判断各因素之间的交互作用。由图 4可知,提取时间(A)的等高线相比于料液比(B)较为密集[图 4(a)],说明提取时间(A)对总多糖得率的影响较料液比(B)的影响显著。等高线为圆形且三维曲线图倾斜度较小,说明提取时间(A)和料液比(B)的交互作用不显著[图 4(b)];同理,提取时间(A)对总多糖得率的影响较提取温度(C)的影响显著[图 4(c)]。提取时间(A)和提取温度(C)的交互作用比提取时间(A)和料液比(B)的交互作用显著[图 4(d)];提取温度(C)对总多糖得率的影响较料液比(B)的影响显著[图 4(e)],且提取温度(C)和料液比(B)的交互作用不如提取时间(A)和提取温度(C)的交互作用显著[图 4(f)]。综上可知,各因素交互作用的大小顺序为提取时间-提取温度(AC)>料液比-提取温度(BC)>提取时间-料液比(AB)。
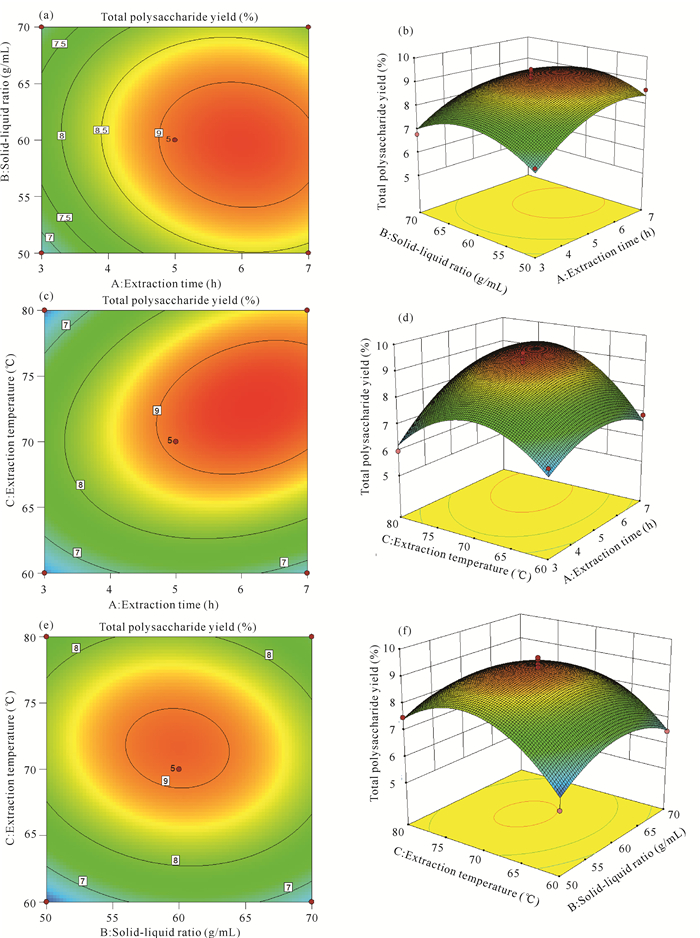
|
| 图 4 交互因素对鹅毛玉凤花总多糖得率影响的响应曲面图 Fig.4 Response surface diagrams of interaction factors on total polysaccharide yield from H.dentata |
2.2.3 优化与验证试验
对响应面得出的数据进行综合分析,得出鹅毛玉凤花总多糖的最佳提取条件为提取时间7 h,料液比为1:58.7 (g/mL),提取温度为73.49℃,在此条件下,鹅毛玉凤花总多糖的理论得率为9.61%。为方便试验,将最佳提取条件设置为提取时间7 h,料液比为1:59 (g/mL),提取温度为74℃,在此条件下进行3次平行验证试验,得到总多糖的实际得率为9.59%,相对标准偏差(RSD)为0.13%,与模型预测值相差0.02%,表示该模型可以较好地对总多糖的提取工艺进行优化,且重现性较好。
2.3 鹅毛玉凤花总多糖的体外抗氧化活性鹅毛玉凤花中总多糖的体外抗氧化活性如图 5所示。由图 5(a)可知,鹅毛玉凤花总多糖对DPPH·的清除率在10%以下,可知其清除能力较差;而L-抗坏血酸对DPPH· 的清除率稳定在95%左右,明显高于总多糖的清除率。经线性拟合,得到总多糖对DPPH· 的半抑制浓度(IC50)值为1.385 mg/mL。由图 5(b)可知,随着浓度增加,总多糖对·OH的清除率先增加后趋于稳定,当浓度超过0.12 mg/mL时,清除率稳定在77%左右。L-抗坏血酸对·OH的清除能力稳定在95%左右。经线性拟合,得到总多糖对·OH的IC50值为0.006 mg/mL。由图 5(c)可知,总多糖对O2-·的清除率随着浓度的增加而增加,而L-抗坏血酸对O2-·的清除率变化不明显,稳定在75%左右。通过对比可以发现,当浓度在0.06-0.12 mg/mL时,总多糖对O2-·的清除率较L-抗坏血酸小;在浓度为0.12 mg/mL,两者对O2-·的清除率基本一致;当浓度超过0.12 mg/mL时,总多糖对O2-·的清除率则大于L-抗坏血酸的清除率。经线性拟合,得到总多糖对O2-·的IC50值为0.020 mg/mL。由图 5(d)可知,L-抗坏血酸的总还原力随着质量浓度的增加而逐渐增加,总多糖的总还原力明显低于同质量浓度的L-抗坏血酸,表明鹅毛玉凤花总多糖的总还原力较弱。对总多糖和L-抗坏血酸的总还原力曲线进行线性拟合,得到当吸光值为0.5时,总多糖和L-抗坏血酸的浓度分别为1.695 mg/mL、0.038 mg/mL,可知总多糖的还原力是L-抗坏血酸的2.24%。
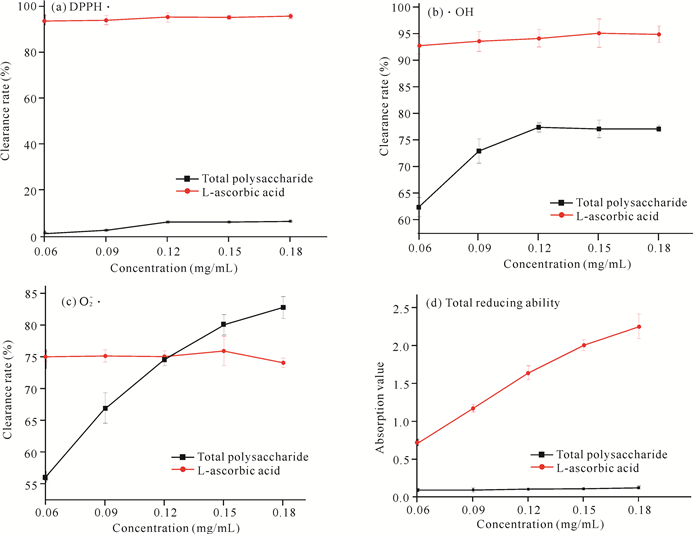
|
| 图 5 鹅毛玉凤花总多糖对DPPH·、·OH、O2-·的清除能力及总还原力 Fig.5 Scavenging ability of DPPH·, ·OH, O2-· and reducing ability on total polysaccharide from H.dentata |
3 讨论
鹅毛玉凤花作为一种药用植物,其药效价值及功能主治还仅限于典籍中的记载,关于其活性物质鲜有报道。本研究发现,在超声辅助提取的条件下,鹅毛玉凤花总多糖的最高得率为9.59%,总多糖含量为95.9 mg/g。抗氧化研究结果显示,DPPH·、·OH、O2-·的IC50值分别为1.385 mg/mL、0.006 mg/mL、0.020 mg/mL。值得注意的是,当总多糖的浓度超过0.12 mg/mL时,其对O2-·的清除能力超过了相应浓度的L-抗坏血酸,说明鹅毛玉凤花总多糖对O2-·具有较好的清除能力。正常状态下,生物体内的O2-·处于一个动态的平衡,当细胞受到外界的刺激或者产生病变时,细胞内会产生过量的O2-·,引发癌症、帕金森等疾病。本研究虽然证实了鹅毛玉凤花总多糖对O2-·具有较好的清除能力,但是发挥相应功能的具体物质还不明确,需要进一步深入研究,以期对鹅毛玉凤花进行更有价值的开发和利用。
除对O2-·具有较好的清除能力外,鹅毛玉凤花总多糖的总体抗氧化能力也优于其他兰科药用植物。苗永美等[16]研究发现,广东石豆兰(Bulbophyllum kwangtungense)中总多糖含量为79.06 mg/g,其总多糖对DPPH自由基、羟基自由基、超氧阴离子自由基的IC50值分别为2.769 mg/mL、0.059 mg/mL、0.0589 7 mg/mL。邱现创[17]对铁皮石斛中的石斛多糖进行抗氧化能力研究发现,当石斛多糖为1 mg/mL时,其对DPPH自由基、羟基自由基和超氧阴离子自由基的清除率都未超过50%。此外,也有研究表明,当台湾金线莲(Anoectochilus formosanus)和浙江金线莲(A.zhejiangensis)中的多糖浓度为1 g/L时,其对羟基自由基的清除率未超过50%[18]。将以上兰科药用植物与鹅毛玉凤花进行比较发现,鹅毛玉凤花中的总多糖对DPPH自由基、羟基自由基、超氧阴离子自由基的清除率有明显的优势。
鹅毛玉凤花作为一种天然药物,其发挥药效功能的物质基础并不是单一的,而是由各种成分综合作用的结果,但本研究仅对鹅毛玉凤花中总多糖含量和抗氧化能力进行测定,还未对多糖类成分或其他类型的活性物质进行深入研究,未来仍需进一步探究其抗氧化能力,以确定发挥此类功效的主要活性物质,为其后续的研究和实际应用提供理论和数据基础。
4 结论本研究在单因素试验的基础上结合响应面试验,对鹅毛玉凤花总多糖的提取工艺进行优化,得出3个因素对鹅毛玉凤花总多糖得率的影响大小依次为提取时间(A)>提取温度(C)>料液比(B)。鹅毛玉凤花总多糖的最佳提取工艺参数为提取时间7 h,料液比1:58.7 (g/mL),提取温度73.49℃,优化验证后的总多糖得率为9.59%。抗氧化研究结果显示,鹅毛玉凤花总多糖对DPPH自由基、羟基自由基、超氧阴离子自由基的IC50值分别为1.385 mg/mL、0.006 mg/mL、0.020 mg/mL,总还原能力是L-抗坏血酸的2.24%。综上可知,鹅毛玉凤花总多糖有较好的抗氧化活性,具有广阔的发展利用空间。
| [1] |
中国科学院中国植物志编辑委员会. 中国植物志: 第十七卷[M]. 北京: 科学出版社, 1993.
|
| [2] |
段宝忠. 傣药资源品种整理与分子鉴定[D]. 武汉: 湖北中医药大学, 2017.
|
| [3] |
江西省卫生局革命委员会. 江西草药[M]. 南昌: 江西省新华书店, 1970: 420-421.
|
| [4] |
思茅地区革命委员会生产指挥组文卫组. 云南思茅中草药选[M]. 韶关: 广东省韶关地区新华印刷厂, 1971.
|
| [5] |
昆明市卫生局. 昆明民间常用草药[M]. 昆明: 云南人民出版社, 1970: 392.
|
| [6] |
陈谦海. 贵州植物志: 第十卷[M]. 贵阳: 贵州科技出版社, 2004: 389.
|
| [7] |
陈娅娅, 毛堂芬, 李奇科, 等. 药用植物鹅毛玉凤花胚培养的研究[J]. 种子, 2008(2): 89-90. DOI:10.3969/j.issn.1001-4705.2008.02.026 |
| [8] |
颜容. 兰科植物菌根真菌的分类及其与共生植物间的营养关系[J]. 西部林业科学, 2004, 33(4): 50-53. DOI:10.3969/j.issn.1672-8246.2004.04.011 |
| [9] |
陈娅娅, 朱国胜, 毛堂芬, 等. 鹅毛玉凤花内生真菌的初步研究[J]. 贵州农业科学, 2008, 36(3): 12-13. DOI:10.3969/j.issn.1001-3601.2008.03.005 |
| [10] |
陈娅娅, 杨琳, 刘作易. 菌根真菌与鹅毛玉凤花种子共生萌发研究[J]. 种子, 2011, 30(4): 92-94. DOI:10.3969/j.issn.1001-4705.2011.04.025 |
| [11] |
陈娅娅, 朱国胜, 毛堂芬, 等. 鹅毛玉凤花菌根真菌对鹅毛玉凤花无菌幼苗生长的影响[J]. 贵州农业科学, 2009, 37(12): 33-34. DOI:10.3969/j.issn.1001-3601.2009.12.010 |
| [12] |
吴冬凡, 庞杜贤, 林清盛. 火龙果果皮总黄酮和多糖的提取工艺及抗氧化研究[J]. 华南师范大学学报(自然科学版), 2021, 53(5): 68-75. |
| [13] |
潘继生, 邓家云, 张棋翔, 等. 羟基自由基高级氧化技术应用进展综述[J]. 广东工业大学学报, 2019, 36(2): 70-77. DOI:10.12052/gdutxb.180121 |
| [14] |
杨永涛. 罗布麻总黄酮的提取、分离纯化及其抗氧化性能研究[D]. 广州: 华南理工大学, 2018.
|
| [15] |
朱成豪, 唐健民, 韦霄, 等. 鳞尾木中总黄酮含量测定及抗氧化活性研究[J]. 食品研究与开发, 2019, 40(20): 168-175. DOI:10.12161/j.issn.1005-6521.2019.20.030 |
| [16] |
苗永美, 孙佳琦, 徐荣华, 等. 广东石豆兰多糖的提取工艺及其抗氧化活性[J]. 天然产物研究与开发, 2019, 31(5): 779-785. |
| [17] |
邱现创. 铁皮石斛多糖提取工艺优化及其抗氧化活性研究[D]. 太原: 山西大学, 2017.
|
| [18] |
唐楠楠, 陶佳青, 陈常理, 等. 台湾金线莲与浙江金线莲多糖含量及抗氧化活性比较研究[J]. 西北植物学报, 2016, 36(3): 521-526. |



