2. 广西科学院, 国家非粮生物质能源工程技术研究中心, 非粮生物质酶解国家重点实验室, 广西生物炼制重点实验室, 广西南宁 530007
2. State Key Laboratory of Non-Food Biomass and Enzyme Technology, National Engineering Research Center for Non-Food Biorefinery, Guangxi Key Laboratory of Biorefinery, Guangxi Academy of Sciences, Nanning, Guangxi, 530007, China
淀粉大量存在于植物的谷物和块茎中,是植物的主要储能方式,也是动物和微生物的主要能量来源[1]。但淀粉大分子无法直接被吸收,需先将大分子多糖转化为葡萄糖、麦芽糖等小分子糖才能被吸收利用。支链淀粉是淀粉的主要成分[2],其主链由1, 4-糖苷键连接形成,侧链由1, 6-糖苷键进行连接[3]。α-1, 6-糖苷键虽仅占总支链淀粉的4%-5%,但少量的精细结构仍会使淀粉糖化变得困难[4]。由于淀粉酶只能随机水解α-1, 4-糖苷键,糖化酶可以水解α-1, 4-糖苷键和α-1, 6-糖苷键,但对α-1, 6-糖苷键的水解极其缓慢[5]。因此淀粉水解后会残留含有α-1, 6-糖苷键的极限糊精,极限糊精的残留降低了淀粉的利用率[6]。普鲁兰酶因能高度特异性地水解支链淀粉中的α-1, 6-糖苷键,常被应用于淀粉糖化。麦芽糖淀粉酶也能水解支链淀粉,相比于普鲁兰酶,其具有更广泛的底物特异性。这使麦芽糖淀粉酶代替普鲁兰酶作为新的糖化辅助酶成为可能。但普通麦芽糖淀粉酶对支链淀粉的水解能力弱,导致其很难在支链淀粉水解方面进行实际应用。因此在淀粉工业中,高度特异性水解支链淀粉的麦芽糖淀粉酶的开发不仅能加快生产速度,提高淀粉的转化率,还能减少淀粉酶和糖化酶的用量,节省成本[7]。木薯中淀粉含量高达70.50%,其中支链淀粉占44%-57%,直链淀粉占14%-24%[8, 9],高含量的支链淀粉使得木薯淀粉的糖化变得困难。目前在加速淀粉糖化方面主要使用普鲁兰酶进行α-1, 6-糖苷键的水解[7, 10]。相关研究表明,在标准糖化过程中,在不添加普鲁兰酶的条件下,可获得的最大葡萄糖含量约为96%,添加普鲁兰酶可使葡萄糖水平提高约2%,并降低糖化酶的使用量[7]。Zhang等[11]研究发现,普鲁兰酶PulPB1与葡萄糖淀粉酶在40℃条件下水解支链淀粉,能提高其催化效率。此外,在糖基水解酶家族13中发现有一类酶也能够水解支链淀粉,如麦芽糖淀粉酶、环糊精水解酶、新普鲁兰酶[12, 13]。Lee等[14]认为这3种酶的作用方式一样,应统称为麦芽糖淀粉酶。多项研究已表明,麦芽糖淀粉酶对部分底物具有优先选择性且偏好水解小分子底物,能优先水解直链淀粉和环状糊精,也可对少量支链淀粉进行水解[15-17]。莫莉等[18]研究表明麦芽糖淀粉酶CDS 1-3区别于传统的麦芽糖淀粉酶,偏好水解大分子支链淀粉,因此在淀粉糖化方面可能更具生产潜力。本文拟通过加入CDS 1-3,对淀粉酶和糖化酶水解缓慢的支链结构进行水解,以期进一步提高淀粉糖化的速率,加快工业生产效率。
1 材料与方法 1.1 材料CDS 1-3重组蛋白菌株由本实验室构建保存[18, 19],基因来自实验室保存的广西武鸣糖厂周围土壤的宏基因组文库[20];木薯淀粉购自上海源叶生物科技有限公司;α-淀粉酶、糖化酶购自诺维信(中国)生物技术有限公司;IPTG(Isopropyl β-D-Thiogalactoside)购自生工生物工程(上海)股份有限公司;Yeast extract和Tryptone购自英国OXOID公司;其他试剂为国产分析纯试剂。
1.2 CDS 1-3的表达纯化将实验室保藏的CDS 1-3重组蛋白菌株进行划线活化,挑取单菌落转接至10 mL卢里亚-贝尔塔尼(Luria-Bertani, LB)培养基中,培养8-12 h得到种子液。取8 mL种子液转接至800 mL LB培养基中,培养至OD600约为0.6,加入终浓度为1 mmol/L的诱导剂IPTG,在37℃、220 r/min条件下诱导8 h。重组蛋白按照德国Qiagen公司蛋白质纯化试剂盒使用说明,用镍亲和层析Ni-NTA进行重组蛋白的纯化,具体如下:对诱导后的CDS 1-3重组菌体进行超声破胞处理(参数设置:功率300 W,工作时间1 s,间歇时间2 s,总工作时长30 min),将破胞液置于4℃冷冻离心机,12 000 r/min离心20 min,收集上清即为CDS 1-3粗酶液。所得粗酶液与Ni-NTA填料孵育30 min后,首先用40 mmol/L咪唑洗脱液多次过柱洗脱,将杂蛋白去除,然后用300 mmol/L咪唑洗脱液将CDS 1-3洗脱收集并透析脱盐。纯化蛋白进行聚丙烯酰胺凝胶电泳(SDS-PAGE)分析。
1.3 协同水解木薯淀粉溶液的制备:称取1.25 g木薯淀粉溶解于pH值为5.5的缓冲液中,定容至5 mL,配制成终浓度为25%的木薯淀粉溶液。
CDS 1-3组加入0.2 μL α-淀粉酶、1 μL糖化酶和0.444 mg CDS 1-3,空白对照组加入0.2 μL α-淀粉酶和1 μL糖化酶。两组分别于37℃、200 r/min摇床震荡培养,分别于30 min、60 min、90 min后取样。
1.4 糖化液还原糖测定按照DNS定糖法[21],取稀释的糖化液加入2倍体积的DNS试剂,沸水浴5 min后迅速冷却,取200 μL至96孔板,测定OD540值,每个梯度做3个平行实验。测得数据后通过葡萄糖标准曲线计算产量。
1.5 DE值测定淀粉的水解程度以产生的还原糖(全部以葡萄糖计)表示。葡萄糖当量(Dextrose Equivalent, DE)值的计算公式如下:
| $ {\rm{ DE= }}\frac{{还原糖质量}}{{淀粉干物质质量}}。$ |
取糖化液经0.45 μm滤膜过滤,稀释一定倍数后上机进行高效液相色谱(High Performance Liquid Chromatography, HPLC)分析。具体HPLC检测条件如下:色谱柱为Agilent ZORBAX NH2(250 mm×4.6 mm),检测器为Waters 2414示差检测器,流动相为乙腈∶水(75∶25),柱温为25℃,流速为1 mL/min,进样量为10 μL。参考韩玉洁等[22]的方法对葡萄糖、麦芽糖和麦芽三糖进行外标法定量。
1.7 数据处理使用Excel 2021进行数据的计算与处理,运用GraphPad Prism 7.0进行图表绘制,使用ImageLab 4.1.0.2177软件记录蛋白电泳图并进行蛋白纯度分析。
2 结果与分析 2.1 CDS 1-3表达纯化对CDS 1-3重组菌株进行诱导表达与镍柱亲和层析纯化,以同样方法诱导空白对照菌株,破胞液作为空白对照。如图 1所示,经SDS-PAGE电泳分析,空白对照菌株在65 kDa无明显条带,CDS 1-3重组菌株在65 kDa有明显条带,且与CDS 1-3蛋白大小一致,粗酶液经镍柱亲和层析纯化后,得到了纯度较高的目的蛋白。
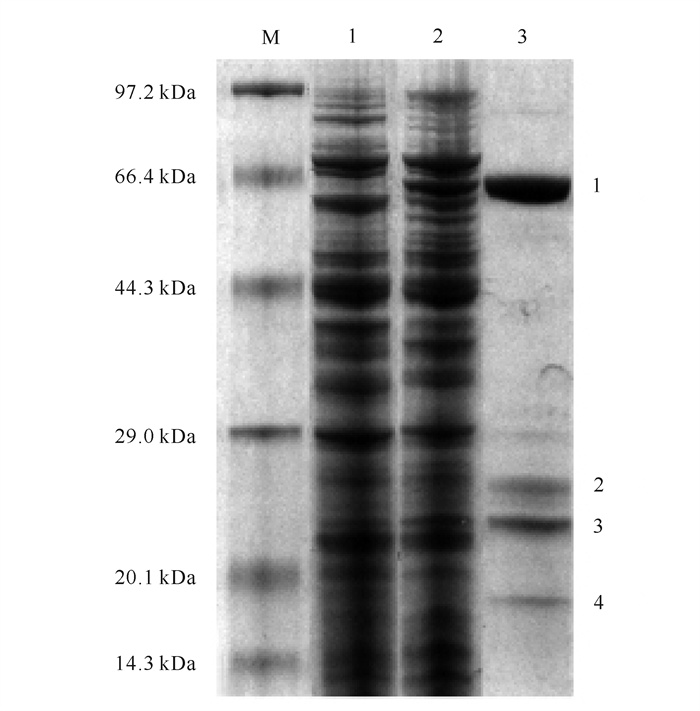
|
| M: Protein marker; 1:Control cell lysate supernatant; 2:Supernatant of CDS 1-3 cell lysate; 3:CDS 1-3 after nickel column purification 图 1 CDS 1-3的SDS-PAGE电泳分析 Fig.1 SDS-PAGE electrophoresis analysis of CDS 1-3 |
经Image Lab软件对图 1第三泳道进行条带分析,所得数据如表 1所示。酶液中目的蛋白CDS 1-3纯度达到90%以上。使用核酸蛋白定量仪(NanoDrop)进行蛋白含量测定,测得蛋白浓度为1.53 mg/mL。结合Image Lab软件数据,目的蛋白条带占比为91.59%,计算出CDS 1-3的最终蛋白浓度为1.4 mg/mL。
| 条带编号Strip number | 体积(积分) Volume (Int) | 条带百分比(%) Band percentage (%) |
| 1 | 3 709 440 | 91.59 |
| 2 | 92 848 | 2.29 |
| 3 | 166 208 | 4.10 |
| 4 | 81 536 | 2.01 |
2.2 糖化液还原糖分析
淀粉被协同水解后,经二硝基水杨酸(DNS)法测定还原糖(全部以葡萄糖计),结果如表 2所示。在整个反应过程中,CDS 1-3组的淀粉水解率高于Control组,淀粉糖化30 min、60 min和90 min时,CDS 1-3组总还原糖产量分别是Control组的1.27倍、1.05倍和1.08倍。如图 2所示,淀粉糖化30 min、60 min和90 min时,CDS 1-3组的DE值分别比Control组提高4.51%、1.17%和2.12%。在0-30 min阶段,CDS 1-3组淀粉水解速率高于Control组;在30-60 min阶段,CDS 1-3组淀粉水解速率低于Control组;在60-90 min阶段,CDS 1-3组淀粉水解速率高于Control组,与上一阶段CDS 1-3组淀粉水解速率基本一致,而Control组水解速率明显降低。
| 组别 Groups |
还原糖总量(mg) Total reducing sugar (mg) | ||
| 30 min | 60 min | 90 min | |
| Control | 211.71±16.19a | 315.63±16.91a | 353.12±6.02a |
| CDS 1-3 | 268.18±13.12b | 330.31±23.83ab | 379.67±52.84a |
| Note: Different lowercase letters indicate significant differences of the data in each column (P < 0.05) | |||

|
| 图 2 CDS 1-3对淀粉水解速率的影响 Fig.2 Effect of CDS 1-3 on hydrolysis rate of starch |
2.3 糖化液高效液相色谱分析 2.3.1 糖化液各组分线性回归方程和相关系数
以标准峰面积对标准工作液的浓度进行线性回归,得到葡萄糖、麦芽糖和麦芽三糖的线性回归方程和相关系数。各组分线性回归方程及相关系数如表 3所示。
| 组分 Components |
线性回归方程 Equation of linear regression |
相关系数 Correlation coefficient |
| Glucose | y=251429x-13492 | 0.997 8 |
| Maltose | y=203520x-5128 | 0.993 3 |
| Maltotrios | y=241447x-27325 | 0.995 3 |
2.3.2 高效液相色谱
按照方法1.6节中色谱条件测定Control组和CDS 1-3组反应30 min、60 min和90 min的糖化液,结果如图 3所示。

|
| 图 3 糖化液色谱图 Fig.3 Chromatogram of glycosylated liquid |
2.3.3 糖化液各组分浓度测定
本研究对30 min、60 min、90 min的淀粉糖化液各组分浓度进行了测定,结果如表 4所示。反应30 min时,CDS 1-3组葡萄糖和麦芽糖浓度均高于Control组,但Control组麦芽三糖浓度高于CDS 1-3组。反应60 min时,CDS 1-3组与Control组相比,麦芽糖和麦芽三糖产量提升明显,此时CDS 1-3组麦芽三糖浓度高于Control组。反应90 min时,CDS 1-3组与Control组相比葡萄糖产量接近,麦芽糖产量更高,麦芽三糖产量低于Control组。CDS 1-3组反应90 min时与反应60 min时麦芽三糖产量基本一致。反应30 min、60 min、90 min后,CDS 1-3组中葡萄糖和麦芽糖的产量均高于Control组。以上结果表明,CDS 1-3的加入提高了葡萄糖和麦芽糖的产量,CDS 1-3有助于木薯淀粉的水解。
| 反应时间(分) Reaction time (min) |
Control组Control group | CDS 1-3组CDS 1-3 group | |||||
| 葡萄糖(mg/mL) Glucose (mg/mL) | 麦芽糖(mg/mL) Maltose (mg/mL) | 麦芽三糖(mg/mL) Maltotriose (mg/mL) | 葡萄糖(mg/mL) Glucose (mg/mL) | 麦芽糖(mg/mL) Maltose (mg/mL) | 麦芽三糖(mg/mL) Maltotriose (mg/mL) | ||
| 30 | 0.67±0.04a | 0.30±0.10a | 0.86±0.13c | 0.80±0.05ab | 0.40±0.05a | 0.45±0.08a | |
| 60 | 1.29±0.06a | 0.50±0.07a | 0.84±0.10a | 1.50±0.05b | 1.09±0.05c | 0.94±0.12ab | |
| 90 | 2.02±0.13a | 0.90±0.08a | 1.39±0.19b | 2.15±0.09a | 1.47±0.06c | 1.09±0.01a | |
| Note: Different lowercase letters indicate significant differences between different groups at the same time of the same component (P < 0.05) | |||||||
3 讨论
本研究以加速支链淀粉水解,提高淀粉转化率为出发点。选用更具支链淀粉水解能力的麦芽糖淀粉酶CDS 1-3与α-淀粉酶和糖化酶进行淀粉糖化实验研究,探究CDS 1-3在0-90 min内对淀粉糖化的影响。通过DNS法测定不同反应时间的还原糖产量,发现CDS 1-3组水解率高于Control组,但不同阶段淀粉水解速率有一定差异。在反应的0-30 min阶段,淀粉糖化初期底物中存在大量高聚合度淀粉分子链,CDS 1-3的添加协助α-淀粉酶对大分子底物进行分解产生更多的非还原端,增加葡萄糖淀粉酶的结合位点,促进糖化。此外,CDS 1-3具有外切α-1, 4-糖苷键活性,从非还原端外切产生麦芽糖,也提高了糖化的效率。反应30 min时,CDS 1-3组的还原糖产量是Control组的1.27倍,表明CDS 1-3协同α-淀粉酶和葡萄糖淀粉酶促进了淀粉的水解。在反应的30-60 min阶段,CDS 1-3组还原糖产生速率低于Control组。在此过程中,α-淀粉酶和葡萄糖淀粉酶先将容易水解的线性结构淀粉水解[23],然后进一步水解糊精结构的α-1, 4糖苷键。事实上,CDS 1-3比酶活为20.23 U/mg,葡萄糖淀粉酶比酶活为113 U/mg,两者均从淀粉链非还原端将淀粉水解,后者相比前者α-1, 4糖苷键水解能力更强。所以当淀粉结合位点不足时,CDS 1-3组由于CDS 1-3水解α-1, 4-糖苷键的速度低于葡萄糖淀粉酶水解α-1, 4-糖苷键的速度,却又占用了葡萄糖淀粉酶与淀粉分子结合位点,形成竞争抑制,造成还原糖产生速率下降[24]。在反应的60-90 min阶段,Control组的水解速率明显降低,残留的分支结构糊精无法被快速降解。而CDS 1-3组水解速率与上一阶段基本保持一致,原因是CDS 1-3这类酶可将具有分支结构的糊精水解成潘糖、麦芽糖等小分子糖[25],使糊精结构进一步水解。本研究初步探究CDS 1-3在淀粉糖化中的作用,结果表明CDS 1-3、α-淀粉酶和葡萄糖淀粉酶三酶协同比α-淀粉酶和葡萄糖淀粉酶双酶协同淀粉水解率高,说明CDS 1-3能加速淀粉糖化。
本研究对不同时间的糖化液也进行了高效液相色谱分析,通过检测底物组成成分变化,了解CDS1-3在淀粉糖化过程中的作用方式。高效液相色谱分析结果表明,反应进行到30 min时,CDS 1-3组葡萄糖和麦芽糖产量高于Control组,这与DNS法测定还原糖的结果一致。而麦芽三糖的产量低于Control组,这种情况可能由两方面原因造成,其一,CDS 1-3能够水解麦芽三糖,产生葡萄糖和麦芽糖;其二,这类酶具有广泛的底物转糖苷活性,可将麦芽三糖转变为其他低聚糖,从而导致麦芽三糖产量减少。Lee等[26]用麦芽三糖为底物,通过这类酶完成了分支寡糖的制备,说明其具有麦芽三糖水解活性和转糖苷活性,这合理解释了本研究的实验现象。反应进行到60 min时,CDS 1-3组相比Control组麦芽糖和麦芽三糖产量大幅提升。麦芽糖浓度提高是由于CDS 1-3从淀粉链非还原端外切产生麦芽糖。而麦芽三糖产量的提高是由于随着时间的推进,淀粉糖化程度越来越高,葡萄糖浓度逐渐增大,CDS 1-3转糖苷活性可将葡萄糖(供体)转移到麦芽糖(受体)上形成麦芽三糖。这与同源性很高的ThMA酶转糖苷功能一致[25]。反应进行到90 min时,Control组与CDS 1-3组的葡萄糖产量逐渐接近,Control组的麦芽三糖产量超过CDS 1-3组,CDS 1-3组60 min时与90 min时麦芽三糖水平基本一致,两组麦芽糖产量同步提升。CDS 1-3能水解分支结构,将淀粉糊精水解成侧链更短的糊精,Chen等[27]和Ruan等[28]报道了同类型酶可通过缩短支链淀粉侧链特性实现抑制淀粉回生。而这种更小的糊精不利于葡萄糖淀粉酶的水解,葡萄糖淀粉酶对于小分子的亲和力相对较弱,影响葡萄糖的产生速率[29]。因此,在反应后期Control组产生葡萄糖速率快,总产量逐渐接近CDS 1-3组葡萄糖总产量。CDS 1-3组反应60 min与90 min后麦芽三糖的无变化现象可以用酶反应的动态平衡进行解释,产物生成速率与产物分解速率一致。CDS 1-3能水解麦芽三糖又能合成麦芽三糖,当麦芽三糖达到一定浓度时反应达到动态平衡。糖化液还原糖测定和高效液相色谱分析结果表明,CDS 1-3的加入在反应30 min内效果最好,发酵糖(葡萄糖和麦芽糖)产量均高于Control组,反应30 min后,由于底物组成成分的复杂性以及酶对底物具有选择偏好性,导致还原糖产生速率变得不稳定。目前淀粉糖化工业为加快生产效率,缩短生产周期,一般将糖化时间控制在30 min以内。本研究结果表明CDS 1-3在初期对淀粉糖化有明显的促进作用,因此在实际生产中具有潜在的应用价值。
4 结论本研究将特异性水解支链大分子底物的CDS 1-3应用于淀粉糖化中,结果表明其能提高淀粉的糖化速率(最高可达4.51%),这为大分子淀粉水解提供了新的选择,但相关的工艺有待进一步优化。此外,基于副产物对淀粉糖化效率产生影响,可以考虑利用同步糖化发酵的方法,尽快消耗掉可发酵糖,避免发生转糖苷反应,减少副产物的形成,实现淀粉的最大转化。
| [1] |
LE CORRE D, BRAS J, DUFRESNE A. Starch nanoparticles: A review[J]. Biomacromolecules, 2010, 11(5): 1139-1153. DOI:10.1021/bm901428y |
| [2] |
ERIC B. Understanding starch structure: Recent progress[J]. Agronomy, 2017, 7(3): 56. DOI:10.3390/agronomy7030056 |
| [3] |
BIJTTEBIER A, GOESAERT H, DELCOUR J A. Hydrolysis of amylopectin by amylolytic enzymes: Structural analysis of the residual amylopectin population[J]. Carbohydrate Research, 2010, 345(2): 235-242. DOI:10.1016/j.carres.2009.11.010 |
| [4] |
张华. 支链淀粉酶在食品工业中的应用[J]. 生物技术通报, 1985(10): 123-124. |
| [5] |
HAN X, WEN H, LUO Y, et al. Effects of α-amylase and glucoamylase on the characterization and function of maize porous starches[J]. Food Hydrocolloids, 2021, 116: 106661. DOI:10.1016/j.foodhyd.2021.106661 |
| [6] |
GOESAERT H, BIJTTEBIER A, DELCOUR J A. Hydrolysis of amylopectin by amylolytic enzymes: Level of inner chain attack as an important analytical differentiation criterion[J]. Carbohydrate Research, 2010, 345(3): 397-401. DOI:10.1016/j.carres.2009.11.011 |
| [7] |
HⅡ S L, TAN J S, LING T C, et al. Pullulanase: Role in starch hydrolysis and potential industrial applications[J]. Enzyme Research, 2012, 2012: 921362. DOI:10.1155/2012/921362 |
| [8] |
郭运玲, 孔华, 左娇, 等. 双波长法测定木薯的直链和支链淀粉含量[J]. 热带作物学报, 2016, 37(6): 1213-1217. |
| [9] |
吴家林. 木薯粒营养价值评定及其在家禽日粮中的应用[D]. 长沙: 湖南农业大学, 2016.
|
| [10] |
XIA W, ZHANG K, SU L Q, et al. Microbial starch debranching enzymes: Developments and applications[J]. Biotechnology Advances, 2021, 50: 107786. DOI:10.1016/j.biotechadv.2021.107786 |
| [11] |
ZHANG S Y, GUO Z W, WU X L, et al. Recombinant expression and characterization of a novel cold-adapted type Ⅰ pullulanase for efficient amylopectin hydrolysis[J]. Journal of Biotechnology, 2020, 313: 39-47. DOI:10.1016/j.jbiotec.2020.03.007 |
| [12] |
KIM Y K, KIM M J, PARK C S, et al. Modification of sorbitol by transglycosylation using Bacillus stearothermophilus maltogenic amylase[J]. Food Science and Biotechnology, 2002, 11: 401-406. |
| [13] |
LIU B, WANG Y Q, ZHANG X B. Characterization of a recombinant maltogenic amylase from deep sea thermophilic Bacillus sp.WPD616[J]. Enzyme and Microbial Technology, 2006, 39(4): 805-810. DOI:10.1016/j.enzmictec.2006.01.003 |
| [14] |
LEE H S, KIM M S, CHO H S, et al. Cyclomaltodextrinase, neopullulanase, and maltogenic amylase are nearly indistinguishable from each other[J]. Journal of Biological Chemistry, 2002, 277(24): 21891-21897. DOI:10.1074/jbc.M201623200 |
| [15] |
IGARASHI K, ARA K, SAEKI K, et al. Nucleotide sequence of the gene that encodes a neopullulanase from an alkalophilic Bacillus[J]. Bioscience, Biotechnology, and Biochemistry, 1992, 56(3): 514-516. DOI:10.1271/bbb.56.514 |
| [16] |
LEE H S, AUH J H, YOON H G, et al. Cooperative action of alpha-glucanotransferase and maltogenic amylase for an improved process of isomaltooligosaccharide (IMO) production[J]. Journal of Agricultural and Food Chemistry, 2002, 50(10): 2812-2817. DOI:10.1021/jf011529y |
| [17] |
OGUMA T, MATSUYAMA A, KIKUCHI M, et al. Cloning and sequence analysis of the cyclomaltodextrinase gene from Bacillus sphaericus and expression in Escherichia coli cells[J]. Applied Microbiology and Biotechnology, 1993, 39(2): 197-203. |
| [18] |
莫莉. 支链淀粉酶CDS1-3的功能鉴定以及结构分析和分子改造的研究[D]. 南宁: 广西大学, 2016.
|
| [19] |
莫莉, 韦廷宗, 闭海, 等. 支链淀粉水解酶水解支链淀粉的特异氨基酸分析[J]. 广西科学, 2015, 22(1): 31-36, 43. |
| [20] |
杜丽琴, 庞浩, 胡媛媛, 等. 蔗糖富集环境土壤微生物宏基因组分析及蔗糖水解相关酶基因克隆[J]. 应用与环境生物学报, 2010, 16(3): 403-407. |
| [21] |
MILLER G L. Use of dinitrosalicylic acid reagent for determination of reducing sugar[J]. Analytical Biochemistry, 1959, 31(3): 426-428. |
| [22] |
韩玉洁, 张洪微, 徐忠. 高效液相色谱法测定高麦芽糖浆[J]. 食品科学, 2004, 24(3): 150-152. |
| [23] |
TESTER R F, QI X, KARKALAS J. Hydrolysis of native starches with amylases[J]. Animal Feed Science and Technology, 2006, 130(1/2): 39-54. |
| [24] |
DANG Y H, LIU M Q, WU X Q. Recombinant rice xylanase-inhibiting protein inhibits GH11 endo-xylanases through competitive inhibition[J]. Protein Expression and Purification, 2019, 156: 17-24. |
| [25] |
BOWMAN D, YEATES D. A remarkable moment in australian biogeography[J]. New Phytologist, 2006, 170(2): 208-212. |
| [26] |
LEE S J, YOO S H, KIM M J, et al. Production and characterization of branched oligosaccharides from liquefied starch by the action of B.licheniformis amylase[J]. Starch-Strke, 1995, 47(4): 127-134. |
| [27] |
CHEN X P, ZHANG L, LI X, et al. Impact of maltogenic α-amylase on the structure of potato starch and its retrogradation properties[J]. International Journal of Biological Macromolecules, 2019, 145: 325-331. |
| [28] |
RUAN Y Q, ZHANG R Z, XU Y. Directed evolution of maltogenic amylase from Bacillus licheniformis R-53:Enhancing activity and thermostability improves bread quality and extends shelf life[J]. Food Chemistry, 2022, 381: 132222. DOI:10.1016/j.foodchem.2022.132222 |
| [29] |
廖威. 燃料乙醇生产技术[M]. 北京: 化学工业出版社, 2014.
|



