2. 桂林医学院药学院, 广西桂林 541199
2. College of Pharmacy, Guilin Medical University, Guilin, Guangxi, 541199, China
被誉为“植物界大熊猫”的苏铁类植物是地球上古老的孑遗植物,也是现存种子植物中最原始的类群,苏铁科(Cycadaceae)仅苏铁属(Cycas Linn.)1属,约118种[1]。中国目前共有苏铁属植物23种,有16种(69.57%)被列为世界自然保护联盟受威胁物种,其中6种(26.09%)为濒危物种[2]。苏铁属全属均为国家一级重点保护植物[3],云南和广西的大多数苏铁属植物都被列入极小种群野生植物名录(Plant Species with Extremely Small Populations, PSESP)[4, 5],占中国极小种群野生植物总数的9.17%。长叶苏铁(Cycas dolichophylla K.D.Hill)是苏铁属的一种极小种群植物,分布在越南、老挝、泰国北部和我国云南、广西等地,因其羽叶长而大、小羽叶数较多而得名,具有重要的研究和观赏价值。长叶苏铁虽然在越南北部分布最广泛、最丰富,但直到20世纪90年代末才被认为是一个独立的种[6]。目前对长叶苏铁的全面性研究并不多,Zheng等[2]通过长叶苏铁的谱系地理研究证明了地质构造和气候对云南红河断裂带两侧生物群的影响。目前在广西区内只发现了3个长叶苏铁种群,对其遗传多样性的研究还未出现。因此,分析广西长叶苏铁种群的遗传多样性对其资源保护和开发具有重要意义。
Simple Sequence Repeats (SSR)又叫微卫星DNA,是由简单的重复单位组成的串联重复序列。SSR的产生主要有两种方式:一是DNA复制或修复过程中DNA滑动和错配;二是有丝分裂、减数分裂过程中姐妹染色单体发生了不均等交换。因此,SSR具有较高的物种特异性[7, 8]。随着越来越多的全基因组参考序列被公布,SSR标记被广泛应用于动植物基因定位、种质鉴定、群体遗传多样性分析、指纹图谱及遗传连锁图谱构建、分子标记辅助选择等方向[9-11]。SSR标记因具有数量大、多态性高、分布广泛均匀、检测方便以及成本低等特点而得到广泛应用[12, 13]。
广西地形地貌复杂,生态环境多样,区内野生苏铁资源丰富,特色鲜明[14]。经调查发现,长叶苏铁仅在百色市田阳县和德保县有分布,并且面临着种群小、数量少、生长环境退化以及人为采挖盗卖严重等问题,因此对广西长叶苏铁进行研究和种群保护迫在眉睫。本研究采用SSR分子标记方法,对分布于广西的3个野生长叶苏铁种群进行遗传多样性及遗传结构分析,探究广西长叶苏铁的遗传多样性、遗传变异以及群体划分,为长叶苏铁的遗传多样性保护提供数据支持,并基于研究结果为广西长叶苏铁种群的保护工作提供建议。
1 材料与方法 1.1 材料2022年于广西百色市的田阳县梅茶镇(PL)、德保县那甲镇(NL)和德保县城关镇(QH)3地采集3个不同种群的长叶苏铁样品共计42份,其中PL种群19份,NL种群14份,QH种群9份。采集的长叶苏铁叶片放置于装有变色硅胶的密封袋中干燥保存,对每份样品的具体信息做好标签,并对采样点进行GPS定位,具体采样点信息如表 1。植物样品由广西壮族自治区中国科学院广西植物研究所韦发南研究员鉴定。
| 种群 Population |
采样点 Sampling point |
经度 Longitude |
纬度 Latitude |
| PL | Meicha Town, Tianyang County | 107°03′06″E | 23°27′30″N |
| NL | Najia Town, Debao County | 106°47′54″E | 23°28′04″N |
| QH | Chengguan Town, Debao County | 106°39′49″E | 23°21′50″N |
1.2 方法 1.2.1 DNA提取和检测
本研究使用改良的十六烷基三甲基溴化铵(CTAB)提取方法提取长叶苏铁叶片DNA,使用1%琼脂糖凝胶电泳检测纯度,并用Nanodrop 2000微量分光光度计检测浓度和质量,将合格的DNA样品保存于-20 ℃冰箱用于后续实验。
1.2.2 引物筛选由于对Zheng等[2]筛选出的长叶苏铁SSR引物的验证结果显示其多态性低,所以利用primer 3软件(https://sourceforge.net/projects/primer 3/)根据叶绿体基因组重新设计引物共计96对,从96对引物中筛选出6对扩增效果较好的SSR引物(表 2)。引物由生工生物工程(上海)股份有限公司北京分公司合成。为了提高文章的可读性,本文将各引物的位点作为其名称。
| 引物名 The name of primer | 重复单元 Repeat unit |
上游引物(5′→3′) Upstream primer (5′→3′) |
下游引物(5′→3′) Downstream primer (5′→3′) |
等位基因区间 Allelic interval |
| GZST002 | (GA)6 | TGTGGAACGTGGAATGGTAA | AGGAATCCCGAAGGAAGAAA | 158-160 |
| GZST019 | (ATAA)5 | GATGAGGAAGCCTACGCAGT | GAAAGACCTCACCATCCGAG | 212-221 |
| GZST055 | (AT)6 | TCATGAAGATGGCAACCAAC | TCCCTTCCAAGCAAATGTCT | 161-184 |
| GZST013 | (GAG)5 | ACCGGTCGACTAGATGGATG | AGGTCCGAAGCTTTCCTCTC | 252-265 |
| GZST088 | (AG)7 | TGGCTTTCGATTTCCACACT | GAACGCTCGCTCTCTCTCTC | 136-159 |
| GZST065 | (CGA)5 | GCTTGGCTGTACCGTTCTTT | CGCCATTGACAACAACAGAC | 157-174 |
1.2.3 PCR扩增及测序
PCR扩增反应在Veriti 384 PCR仪上进行,PCR反应体系为10 μL:2×Taq PCR Master Mix 5.0 μL,DNA (约20 ng) 1.0 μL,10 μmol/L的上、下游引物各0.5 μL,ddH2O 3.0 μL。PCR扩增反应程序如下:95 ℃预变性5 min;95 ℃变性30 s,62-52 ℃退火30 s,72 ℃延伸30 s,10个循环,每个循环下降1 ℃;95 ℃变性30 s,52 ℃退火30 s,72 ℃延伸30 s,25个循环;72 ℃末端延伸20 min,4 ℃保存。PCR产物在经过1%琼脂糖凝胶电泳检测后参照ABI 3730xl上机操作流程进行荧光毛细管电泳测序。
1.3 数据分析从ABI 3730xl仪器上导出原始数据,按检测位点分类归档后,分别导入GeneMarker分析软件中进行基因型数据的读取,并按位点名称分别导出Excel格式的基因型原始数据和PDF格式的分型峰图文件。使用GenAlEx version 6.501软件计算SSR引物和群体的各项遗传多样性指标,包括观测等位基因(Number of observed alleles, Na)、有效等位基因(Number of effective alleles, Ne)、Shannon信息指数(Shannon′s information index, I)、多态性信息指数(Polymorphism Information Content, PIC)、观测杂合度(Observed heterozygosity, Ho)和期望杂合度(Expected heterozygosity, He)。利用Powermarker软件计算各群体间的遗传距离。利用Unweighted Pair-Group Method with Arithmeticmeans (UPGMA)方法进行聚类分析,并绘制环状聚类图和树状聚类图。使用GenAlex version 6.501软件计算各群体间和群体内的变异、分化并进行显著性检验;计算遗传分化系数(Genetic differentiation coefficient, Fst)和基因流(Gene flow, Nm),基因流按公式Nm=0.25(1-Fst)/Fst计算。
2 结果与分析 2.1 SSR引物多态性分析使用6对引物对42份长叶苏铁样品进行SSR多态性分析,结果见表 3。实验共检测到Na 23个,每对引物的等位基因数为2-8,平均每对引物的等位基因数目为3.833。Ne总数为13.161,数值为1.024 (GZST019)-3.662 (GZST065),平均值为2.194。I最高的是GZST065(1.525),平均值为0.762。Ho和He的平均值分别为0.279和0.396,GZST065和GZST088的Ho最高,均为0.610,He最高的是GZST065(0.727)。PIC为0.023-0.695,平均值为0.364,其中引物GZST065的多态性信息指数最高(PIC=0.695)。6对引物中,GZST013、GZST019和GZST088不存在显著性差异,其余3对引物均存在显著性差异。综合来看,引物GZST065和GZST088的各项遗传多样性指数数值较高。
| 引物名 The name of primer |
Na | Ne | I | Ho | He | PIC | P value | 显著性 Significance |
| GZST002 | 2 | 1.049 | 0.113 | 0.000 | 0.047 | 0.046 | 0.000 | *** |
| GZST013 | 2 | 1.325 | 0.410 | 0.286 | 0.245 | 0.215 | 0.280 | ns |
| GZST019 | 2 | 1.024 | 0.065 | 0.024 | 0.024 | 0.023 | 0.938 | ns |
| GZST055 | 3 | 2.620 | 1.016 | 0.143 | 0.618 | 0.538 | 0.000 | *** |
| GZST065 | 6 | 3.662 | 1.525 | 0.610 | 0.727 | 0.695 | 0.004 | ** |
| GZST088 | 8 | 3.481 | 1.444 | 0.610 | 0.713 | 0.665 | 0.421 | ns |
| Mean | 3.833 | 2.194 | 0.762 | 0.279 | 0.396 | 0.364 | ||
| St Dev | 2.563 | 1.219 | 0.655 | 0.276 | 0.329 | |||
| Note: ns means not significant, the group conforms to Hardy-Weinberg equilibrium; ** means significant difference (P < 0.01), *** means significant difference (P < 0.001); Mean indicates average value; St Dev means standard deviation. | ||||||||
2.2 长叶苏铁群体遗传多样性分析 2.2.1 群体间的遗传多样性分析
广西长叶苏铁3个野生种群的遗传多样性检测结果见表 4。3个种群的Na平均为2.833,PL种群最高(3.167)。NL种群的Ne最高,为2.234,3个种群平均值为2.005。NL种群的I最高,表明该种群内遗传多样性最丰富。3个种群的Ho最高的是PL种群(0.338),最低的是QH种群(0.167)。He为0.263 (QH)-0.423 (NL)。3个种群Ho均小于对应的He,说明3个种群内杂合子个体较少。QH种群的遗传多样性参数[除固定指数F(Fixed index)外]在3个种群间均表现最低,遗传多样性水平在3个种群中较低。
| 种群 Population |
Na | Ne | I | Ho | He | F |
| NL | 3.000 | 2.234 | 0.763 | 0.274 | 0.423 | 0.409 |
| PL | 3.167 | 2.190 | 0.734 | 0.338 | 0.392 | 0.076 |
| QH | 2.333 | 1.590 | 0.474 | 0.167 | 0.263 | 0.380 |
| Mean | 2.833 | 2.005 | 0.657 | 0.259 | 0.359 | 0.274 |
2.2.2 群体的遗传分化
广西长叶苏铁种群的分子方差分析结果显示长叶苏铁种群间的遗传变异占3%,个体间的遗传变异占30%,大多数的遗传变异来源于个体内(67%)。长叶苏铁种群间的基因流和遗传分化系数分析结果见表 5,NL与PL间的基因流最大(11.034)且遗传分化系数最小(0.022),NL与QH间的基因流最小(2.981)且遗传分化系数最大(0.077)。
| 种群 Population |
NL | PL | QH |
| NL | - | 11.034 | 2.981 |
| PL | 0.022 | - | 4.996 |
| QH | 0.077 | 0.048 | - |
2.2.3 长叶苏铁的聚类分析和主坐标分析
采用遗传距离对3个长叶苏铁种群进行UPGMA聚类分析(图 1),结果显示3个种群可分为两类,其中PL和NL遗传关系更近(遗传距离为0.059),可归为一类,QH独自一类。
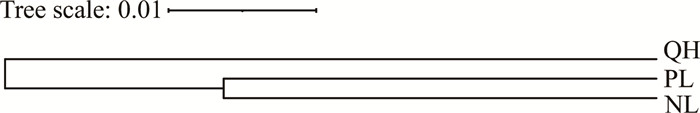
|
| 图 1 长叶苏铁3个种群的UPGMA聚类结果 Fig.1 UPGMA clustering results of 3 populations of C.dolichophylla K.D.Hill |
42份长叶苏铁样品的UPGMA聚类分析结果见图 2,42份样品可分为9类,3个种群的42份样本在各类中相互穿插,并不存在明显的群体分组,多数PL和NL聚类在同一类中,说明PL和NL遗传距离更近。

|
| 图 2 长叶苏铁42个样品的UPGMA聚类结果 Fig.2 UPGMA clustering results of 42 samples of C.dolichophylla K.D.Hill |
对广西长叶苏铁的42个样本进行主坐标分析(图 3),结果显示第一主坐标贡献率为26.38%,第二主坐标贡献率为15.20%,累积贡献率为41.58%,可代表原始数据的主要信息。图中3个种群的42个样本个体相互交叉和重叠,表明3个种群间存在着频繁的基因渗透和基因交流。

|
| 图 3 42个长叶苏铁样本的主坐标分析 Fig.3 Principal coordinate analysis of 42 samples of C.dolichophylla K.D.Hill |
3 讨论 3.1 长叶苏铁遗传多样性
SSR标记在植物遗传多样性分析和分子标记辅助育种等方面具有较为广泛的应用[15, 16]。本研究使用筛选出的6对重复性好的SSR引物对长叶苏铁遗传多样性进行检测。结果表明,6对引物中,GZST065和GZST088的各项遗传多样性指数数值较高,说明这两个位点的多态性较高,拥有的遗传变异较多。参照张红瑞等[17]对PIC的划分方法,本研究中有3对引物(GZST055、GZST065、GZST088)是高度多态性引物(PIC>0.5),3对引物(GZST002、GZST013、GZST019)是低度多态性引物(PIC≤0.25)。遗传多样性能体现物种进化潜力及其适应环境变化的能力,物种的遗传多样性水平越高,其适应环境变化的能力越强,反之越弱[18]。本研究中3个种群的期望杂合度(0.359)低于红河断裂带分布的长叶苏铁(He=0.446)[2],也低于其他濒危物种的平均值(He=0.42)[19]。与其他苏铁属植物相比,长叶苏铁期望杂合度低于台湾苏铁(Cycas taiwaniana,0.703)、叉叶苏铁(C.bifida,0.543)、多歧苏铁(C.multipinnata,0.497)和德保苏铁(C.debaoensis,0.484)等,高于攀枝花苏铁(C.panzhihuaensis,0.328)和四川苏铁(C.szechuanensis,0.288)[20, 21]。3个种群中德保县那甲镇(NL)种群的遗传多样性最高。但总体来看,广西长叶苏铁遗传多样性水平均较低。Zheng等[2]基于SSR对云南长叶苏铁的遗传多样性研究结果显示,云南长叶苏铁的期望杂合度为0.466 0,遗传分化系数为0.260 0。本研究中长叶苏铁的期望杂合度为0.359,遗传分化系数为0.049,表明广西的长叶苏铁相对于云南的遗传多样性更低,种群分化程度更低。这可能与广西长叶苏铁的种群植株数量少且成年植株稀少有关,因此急需对广西长叶苏铁进行繁育及回归引种的相关研究,扩大其种群植株数量。
3.2 长叶苏铁遗传分化对于本研究中的长叶苏铁,其群体间的遗传变异占3%,群体内的遗传变异占97%,变异主要集中在群体内,种群间的遗传交流较少。这种现象发生的原因可能有两点:一是广西长叶苏铁种群所积累的遗传变异少,这是种群植株数量少导致的;二是长叶苏铁的花粉可能无法远距离传播。苏铁类植物传粉方式大多为虫媒或者风媒。根据杨泉光等[22]发现的越南篦齿苏铁(C.enlongata)在3.0 m范围外花粉的分布密度随距离的增加而急剧下降的研究结果,笔者推测长叶苏铁多为种群内杂交,种群内的基因交流频繁。关于长叶苏铁传粉机制的研究目前还未见报道,后续应加强这方面的研究。
3.3 广西长叶苏铁的保护策略苏铁属植物是古生代孑遗植物,零星分布,竞争能力较弱,且雌雄异株异熟,多为虫媒或风媒传粉,结实率不高,更新能力较弱[14, 22]。因其观赏和经济价值都很高,野生苏铁遭受过度的开发利用。社会经济的快速发展以及全球气候变化也使得苏铁属植物生境遭受破坏甚至毁灭[20]。上述的内因与外因使得苏铁属植物濒临灭绝,需要尽快对其进行研究和保护。自2004年第一次关于长叶苏铁的论文发表以来[6],业界对其进行的研究甚少。本研究中广西长叶苏铁种群的遗传多样性水平较低,群体间遗传分化程度低,绝大部分的遗传变异来自于群体内,且3个种群42个个体的遗传背景相互混杂,存在频繁的基因交流。鉴于长叶苏铁自身的生物学性状及外界的影响,对广西长叶苏铁种质资源保护提出以下建议:(1)3个种群均位于保护区外,因此都需要建立保护小区,全面保护长叶苏铁野外个体和种群。德保县那甲镇(NL)种群的遗传多样性较高,保护时应将该种群作为重点保护单元进行保护。(2)筛选遗传多样性高的优良个体进行迁地保护,并系统地对其生物学性状、繁育方法及回归引种等相关基础知识进行研究。(3)加大对群众的宣传教育力度,提高群众保护环境的意识。(4)加强种群动态监测,采用人工授粉等方式人为辅助长叶苏铁种群更新。
| [1] |
王祎晴, 肖斯悦, 席辉辉, 等. 云南西南地区3种苏铁属植物的分布现状和生境特征[J]. 植物资源与环境学报, 2021, 30(1): 36-43. |
| [2] |
ZHENG Y, LIU J, GONG X. Tectonic and climatic impacts on the biota within the Red River Fault, evidence from phylogeography of Cycas dolichophylla (Cycadaceae)[J]. Scientific Reports, 2016, 6: 33540. DOI:10.1038/srep33540 |
| [3] |
REN H, ZHANG Q M, LU H F, et al. Wild plant species with extremely small populations require conservation and reintroduction in China[J]. AMBIO, 2012, 41(8): 913-917. DOI:10.1007/s13280-012-0284-3 |
| [4] |
MA Y P, CHEN G, GRUMBINE R E, et al. Conserving plant species with extremely small populations (PSESP) in China[J]. Biodiversity and Conservation, 2013, 22(3): 803-809. DOI:10.1007/s10531-013-0434-3 |
| [5] |
管中天. 中国苏铁植物[M]. 成都: 四川科学技术出版社, 1996.
|
| [6] |
HILL K D, HIEP T N, LOC P K. The genus Cycas (Cycadaceae) in Vietnam[J]. The Botanical Review, 2004, 70(2): 134-193. DOI:10.1663/0006-8101(2004)070[0134:TGCCIV]2.0.CO;2 |
| [7] |
黄稚清, 吴林源, 高筱钰, 等.基于SSR标记的紫花风铃木群体遗传多样性分析[J/OL]. 热带亚热带植物学报, 2023: 1-9[2023-05-22]. http://kns.cnki.net/kcms/detail/44.1374.Q.20230331.1604.004.html.
|
| [8] |
林立, 林乐静, 祝志勇, 等. 93份槭树种质资源的SSR指纹图谱构建与遗传多样性分析[J]. 分子植物育种, 2022, 20(4): 1250-1263. |
| [9] |
GARCIA A A F, KIDO A E, MEZA N A, et al. Development of an integrated genetic map of a sugarcane (Saccharum spp.) commercial cross, based on a maximum-likelihood approach for estimation of linkage and linkage phases[J]. Theoretical and Applied Genetics, 2006, 112(2): 298-314. DOI:10.1007/s00122-005-0129-6 |
| [10] |
李子航, 何立飞, 王秀军, 等. 基于SSR分子标记的地被菊遗传多样性分析和指纹图谱构建[J]. 生物工程学报, 2023, 39(7): 2839-2860. |
| [11] |
DONG H, SHANG X D, ZHAO X Y, et al. Construction of a genetic linkage map of Lentinula edodes based on SSR, SRAP and TRAP markers[J]. Breeding Science, 2019, 69(4): 585-591. DOI:10.1270/jsbbs.18123 |
| [12] |
万映伶, 金亦佳, 刘爱青, 等. 不同栽培地芍药品种资源遗传多样性的SSR分析比较[J]. 园艺学报, 2023, 50(4): 875-884. |
| [13] |
邹建文, 饶红欣, 陈灵, 等. 黑老虎新品系的SSR指纹图谱构建[J]. 热带作物学报, 2023, 44(4): 716-723. |
| [14] |
张国革, 黎德丘, 罗保, 等. 广西百色市野生苏铁植物资源及其保育[J]. 广西农业生物科学, 2008, 27(3): 230-234. |
| [15] |
陈彪, 陈铭, 李洋洋, 等. 烟草糖酯SSR分子标记筛选及辅助育种应用[J]. 中国烟草科学, 2019, 40(3): 8-15. |
| [16] |
叶冬梅, 吴晓萌, 段国珍, 等.基于SSR分子标记分析白杄的群体遗传多样性[J/OL]. 分子植物育种, 2023, 1-15[2023-05-22]. http://kns.cnki.net/kcms/detail/46.1068.S.20230329.1043.008.html.
|
| [17] |
张红瑞, 李鑫, 陈振夏, 等. 基于SSR分子标记的裸花紫珠种质资源遗传多样性分析及DNA指纹图谱构建[J]. 中草药, 2023, 54(12): 3971-3982. |
| [18] |
田星, 李中霁, 刘小莉, 等. 基于SSR分子标记的灯盏花遗传多样性分析[J]. 中国实验方剂学杂志, 2021, 27(18): 136-143. |
| [19] |
杨磊, 曹秋梅, 冯缨, 等. 珍稀濒危植物阜康阿魏的遗传多样性及遗传结构[J]. 植物研究, 2023, 43(1): 51-58. |
| [20] |
席辉辉, 王祎晴, 潘跃芝, 等. 中国苏铁属植物资源和保护[J]. 生物多样性, 2022, 30(7): 1-13. |
| [21] |
ZHENG Y, LIU J, FENG X Y, et al. The distribution, diversity, and conservation status of Cycas in China[J]. Ecology and Evolution, 2017, 7: 3212-3224. |
| [22] |
杨泉光, 宋洪涛, 杨海娟, 等. 苏铁类植物传粉生物学研究进展(综述)[J]. 亚热带植物科学, 2012, 41(3): 83-88. |



