2. 中国科学院大学, 北京 100049;
3. 赣南师范大学, 江西赣州 341000
2. University of Chinese Academy of Science, Beijing, 100049, China;
3. Gannan Normal University, Ganzhou, Jiangxi, 341000, China
走马胎(Ardisia kteniophylla)为报春花科(Primula)紫金牛属(Ardisia)多年生常绿灌木[1],是我国岭南少数民族地区常用的民间药物,素有“岭南药王”之称[2]。其根或根茎常作为风湿跌打药被广泛使用,有“两脚迈不开,就用走马胎”的说法[3]。其叶亦供药用,具有去腐生肌、消炎等功效,并作为少数民族(瑶、苗、壮、侗等)传统药浴的常备原料[4],在传统瑶医理论“七十二风”中占有重要地位。其三萜皂苷类成分具有显著的抗肿瘤作用[5, 6]。然而,随着市场需求的不断增大以及当地人们掠夺性的采挖,其野生植物资源遭到严重破坏[2]。目前,走马胎已被《广东省重点保护野生植物名录》收录为地方重点保护野生植物。因此,推动走马胎人工栽培势在必行。走马胎生性喜阴,常见于林下阴暗潮湿的地方[7]。光照和水分是影响走马胎生长的重要因素。
作为影响植物茁壮成长的关键生态因子[8],光和水的时空变化及其交互作用,使植物在形态特征、生理反应及次生代谢产物等方面产生可塑性响应[8-10]。研究发现,吊罗山薹草(Carex diaoluoshanica)在40%透光率和70%土壤持水量(θf)下生长最好[9]。印楝(Azadirachta indica)在充足光照和适当干旱胁迫下,其初生代谢及次生代谢产物的积累显著提高[10]。然而,走马胎的生长和代谢在不同水分和光照条件下的研究尚未见报道。因此,本文采用盆栽试验和人工遮光的方法研究不同水分和光照条件对走马胎生长、生理指标、光合特性和药效成分的影响,以期找出走马胎生长的最适光照和水分条件,为走马胎的野外保护及引种栽培提供科学依据。
1 材料与方法 1.1 供试材料和组别设置走马胎种子采于广东省南雄市,其带果植株经华南植物园陈红锋研究员鉴定为报春花科植物走马胎(Ardisia kteniophylla A.DC)。
试验于2016年4-7月在广东省广州市华南植物园种质资源圃进行,选择生长环境一致、植株形态大小相似、健康无病斑的二年生走马胎苗,单株种于花盆中。选取泥炭∶细沙∶椰糠=2∶2∶1的混合栽培基质。试验采用双因素随机区组设计。遮阳棚采用塑料膜和遮阳网搭建,设置3个光照梯度:30%-40%透光率(L1)、20%-30%透光率(L2)、10%-20%透光率(L3)。水分处理设置3个水分梯度:90%-100%θf(W1)、70%-80%θf (W2)、50%-60%θf (W3)。共计产生9个处理组(L1W1、L1W2、L1W3、L2W1、L2W2、L2W3、L3W1、L3W2、L3W3),每个处理组3盆幼苗,共27盆。试验时间共90 d。
1.2 株高和茎粗测定试验结束后采样。首先将各处理组中走马胎植株进行标记,然后测量生长指标:卷尺量株高,游标卡尺统一在距离地面2 cm部位测量茎粗。各指标测定均为3次重复。
1.3 不同组织部位生长量测定株高和茎粗测量结束后,将走马胎植株从盆内取出,抖掉泥土,流水冲洗干净,随后用枝剪将其分离成根、茎及叶等不同部位,再置于烘箱内,100 ℃杀青30 min,然后在60 ℃下烘干至恒重后称量干重,重复3次。称量完的样品保存于干燥箱备用。
1.4 生理指标测定试验结束后,随机选取各处理组中位置相同、形态相似的健康植株叶片,用蒸馏水冲洗干净,带回实验室测定各生理指标,每个处理组重复3次。脯氨酸(Proline)采用茚三酮比色法测定[11];可溶性糖采用蒽酮比色法测定[12];丙二醛(MDA)采用硫代巴比妥酸法测定[12];细胞质膜相对透性(RP)采用雷磁DDS-11A数显电导率仪(上海仪电科学仪器股份有限公司)测定[12]。
1.5 光合生理指标测定叶绿素含量以走马胎叶片为材料,采用95%乙醇萃取,并用分光光度法测定[11]。走马胎苗在适应各组处理后,选一个天气晴朗的上午(8:30-11:30),利用LI-6400便携式光合仪(LI-COR公司,美国)测定光合作用-光响应曲线[13],测定从1 500 μmol·m-2·s-1光合有效辐射(PAR)开始,依次降为1 200、1 000、800、600、400、200、150、100、50、20、0 μmol·m-2·s-1,所有数据均由光合仪自动记录。
1.6 总皂苷测定走马胎总皂苷采用紫外-可见分光光度法测定,其主要步骤如下:将1.3节中已干燥的走马胎根、茎及叶样品分别准确称取0.2 g,置于锥形瓶中,加入50 mL 50%乙醇,称量,超声提取30 min (超声功率为240 W),静置于室温,50%乙醇补足质量。根及茎样品过滤,收集续滤液作为供试品备用。叶样品补足质量后,滤过,滤渣与锥形瓶用20 mL 50%乙醇分数次洗涤,合并滤液和洗液于250 mL茄形瓶中,减压回收溶剂至无醇味。定量转移至分液漏斗中,用等体积石油醚萃取3次,弃去石油醚层,水层定量转移至50 mL量瓶中,用乙醇稀释至刻度,作为供试品备用。最后用L5S型紫外可见分光光度计(山东济南禾普仪器设备有限公司)检测,波长设定为520 nm。以齐墩果酸为标准品,获得回归方程为y=0.0044x-0.0212,R=0.999 3,对走马胎总皂苷成分进行定量计算。
1.7 数据统计采用Microsoft Office Excel 2013进行数据录入和统计,利用SPSS 26软件进行方差分析和差异显著性检验,作图采用Graphpad Prism 8软件,图片编辑采用Adobe Illustrator 2021软件。使用光合数据分析软件Photosynthesis V1.0计算光饱和点(Light Saturation Point, LSP)、光补偿点(Light Compensation Point, LCP)、最大净光合速率、光下呼吸速率、光合速率拟合值及表观量子效率(Apparent Quantum Efficiency, AQE)等参数,采用经典的非直角双曲线模型拟合曲线。
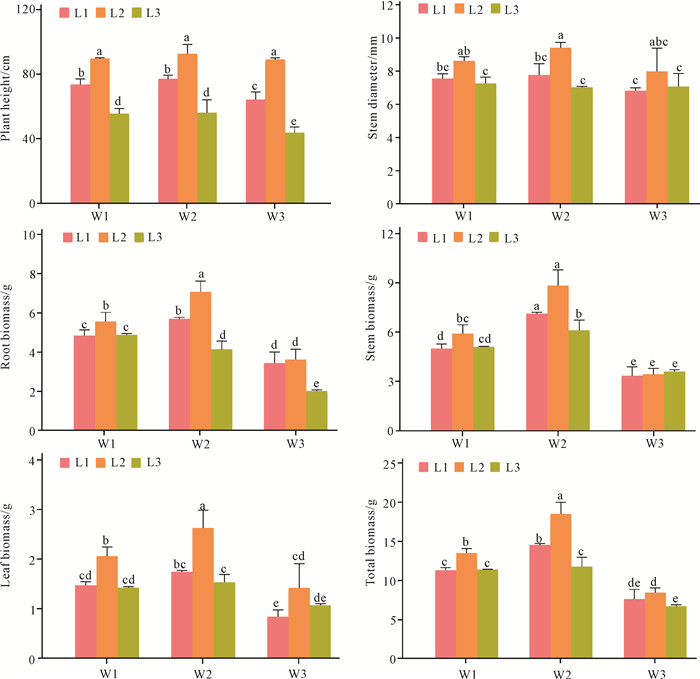
2 结果与分析 2.1 水分及光照处理对走马胎株高、茎粗及生物量的影响通过双因素方差分析(表 1)可以看出,不同水分条件对走马胎株高,根、茎、叶及全株生物量均产生显著影响,对茎粗影响不显著;光照条件对各生长指标均产生显著影响;而二者的交互作用对株高,根、茎及全株生物量影响显著,对茎粗和叶生物量影响较小。
| 评价指标Evaluation index | 参数Parameter | 水分Moisture | 光照Light | 水分×光照Moisture×light |
| Index of growth | Height | 12.453** | 185.492** | 1.773* |
| Thick stems | 3.595 | 15.845** | 1.171 | |
| Root biomass | 108.778** | 43.960** | 7.756** | |
| Stem biomass | 146.685** | 13.724** | 7.056* | |
| Leaf biomass | 33.851* | 28.280* | 2.208 | |
| Whole plant biomass | 181.447** | 43.169** | 8.969** | |
| Physiological indicators | Proline | 13.527* | 21.859* | 1.197* |
| Soluble sugar | 14.287* | 8.203* | 1.303 | |
| MDA | 15.908* | 17.713* | 1.566* | |
| Relative permeability of cytoplasmic membrane | 14.691* | 19.274** | 0.661 | |
| Chlorophyll | 0.672 | 21.684* | 0.562* | |
| Medicinal active ingredient | Root of total saponins | 28.805** | 36.365** | 27.503** |
| Stem total saponins | 53.749* | 6.734 | 1.327 | |
| Leaf total saponins | 11.059* | 21.037* | 4.685* | |
| Note: *indicates the correlation is significant (P < 0.05);**indicates the correlation is extremely significant (P < 0.01). | ||||
如图 1所示,在水分条件相同时,走马胎的株高,茎粗,根、茎、叶及全株的生物量均在L2条件下最高,显著高于L1和L3。表明走马胎在20%-30%透光率下生长最好,过高或过低的透光率都会使其生长受到明显抑制。在光照条件相同时,株高以及茎粗均在W2条件下最高,但没有表现出显著性差异;根、茎、叶及全株的生物量在不同水分条件下,均表现出显著性差异(P<0.05),并且其变化规律基本一致:W2>W1>W3。表明走马胎在70%-80%θf条件下生长最好,水分过多或过少其生长都会受到限制。
|
| Different lowercase letters indicate variance analysis reached significant difference at the 0.05 level. 图 1 光照和水分对走马胎生长指标的影响 Fig.1 Effects of light and water treatments on the growth parameters of A.kteniophylla |
2.2 水分和光照对走马胎渗透调节物质及膜质过氧化作用的影响
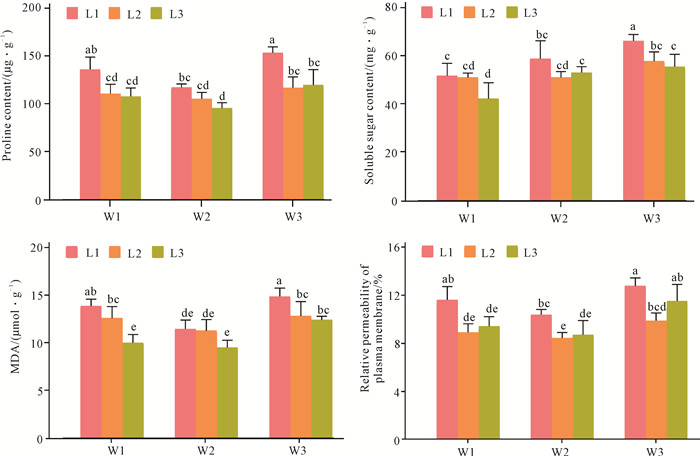
由表 1可知,不同水分及光照条件对走马胎脯氨酸和可溶性糖的含量均产生显著影响,二者交互作用对脯氨酸影响显著,而对可溶性糖的影响较小。如图 2所示,在相同水分条件下,脯氨酸和可溶性糖含量大体上随着光照强度的降低而降低,均是在L1条件下达到最大值,并显著高于其他处理,在L2和L3条件下没有显著性差异。走马胎在30%-40%透光率下,脯氨酸和可溶性糖等生理渗透调节物质显著积累,表明光照太强对走马胎来说属于逆境。在相同光照条件下,脯氨酸的含量在W3最高,其次为W1,最小为W2;而可溶性糖的含量则表现出随着水分减少而不断增加的规律,即W3>W2>W1,并且不同水分处理之间差异显著(P<0.05)。由此可见,脯氨酸和可溶性糖等生理渗透调节物质分别在70%-80%θf和90%-100%θf条件下积累最少,表明走马胎适宜生长在水分充足的环境中。此外,水分和光照强度对脯氨酸存在显著的交互作用,L1W3条件下脯氨酸含量最高。
|
| Different lowercase letters indicate variance analysis reached significant difference at the 0.05 level. 图 2 光照和水分对走马胎生理指标的影响 Fig.2 Effects of light and water treatments on the physiological parameters of A.kteniophylla |
由表 1可知,不同水分及光照条件对丙二醛含量和细胞质膜相对透性均产生显著影响,二者交互作用对丙二醛含量的影响显著,而对细胞质膜相对透性的影响较小。如图 2所示,在水分条件相同时,丙二醛含量随着光照强度的降低而降低,L1条件下丙二醛含量显著高于其他处理组;细胞质膜相对透性在L1条件下最高,其次为L3,在L2条件下最低。在3种水分条件下,丙二醛含量和细胞质膜相对透性均在L1条件下最高,表明在30%-40%透光率时,走马胎膜系统的受害程度最重。在相同光照条件下,丙二醛含量和细胞质膜相对透性均是在W3条件下最高,其次是W1,最低为W2。其中,二者在W2条件下均显著低于处理组W1和W3。走马胎在70%-80%θf条件下,丙二醛含量和细胞质膜相对透性等膜质过氧化指标最低,表明该水分生长条件下,走马胎膜的稳定性最好。
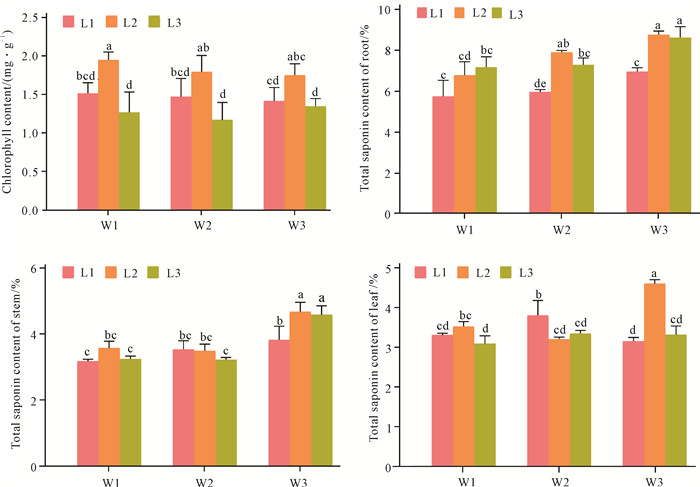
2.3 水分和光照对走马胎叶绿素及总皂苷含量的影响通过双因素方差分析(表 1)可以看出:水分对叶绿素含量主效应不显著,光照对叶绿素含量的影响达到了显著水平;光照和水分的交互作用对叶绿素含量影响达到了显著水平。从图 3可知,在相同水分条件下,叶绿素含量在不同光照条件下均表现出先升高后降低的趋势,在L2光照条件下叶绿素含量最高,L3条件下叶绿素含量最低。在L1和L2光照条件下,叶绿素含量均呈随水分降低而降低的趋势,但各处理组间差异不显著;在L3光照条件下,叶绿素含量则表现出先降低后增高的趋势。此外,水分和光照对叶绿素含量存在显著的交互作用,L2W1条件下叶绿素含量最高。
|
| Different lowercase letters indicate variance analysis reaches significant difference at the 0.05 level. 图 3 光照和水分对走马胎叶绿素及总皂苷含量的影响 Fig.3 Effects of light and water treatments on the contents of chlorophyll and total saponins in A.kteniophylla |
双因素方差分析表明水分对走马胎的根、茎及叶总皂苷含量影响显著,光照除了对茎总皂苷的影响不显著外,对走马胎的根、叶总皂苷含量影响达到显著水平。光照和水分的交互作用对走马胎的根及叶总皂苷含量影响达到显著水平(表 1)。从图 3可知,走马胎根总皂苷的含量在W2和W3水分条件下,有随着光照的减弱呈先升高后降低的趋势,L2与L3间没有显著性差异,而二者均显著高于L1;在W1条件下,根总皂苷含量随着光照的减弱表现出逐步升高的趋势,但各处理组间差异不显著。走马胎茎、叶中总皂苷的含量在W1和W3水分条件下,随着光照的减弱表现出先升高后降低的趋势;在W2条件下,茎总皂苷的含量在不同光照条件下差异不显著,叶总皂苷的含量在L1光照条件下显著高于其他处理组(P<0.05)。走马胎在L2光照条件下,除茎、叶的W2水分条件下外,其余组织部位及水分条件的总皂苷含量均最高。相同光照条件下,走马胎根、茎总皂苷的含量均表现出随着水分的减少而升高的趋势,其中W3处理组显著高于W2和W1,而W2和W1处理组间差异不显著;叶总皂苷含量在L1光照条件下,随着水分的减弱表现出先升高后降低的趋势;在L2光照条件下,表现出随着水分的减弱先降低后升高的趋势,W3处理组显著高于其他处理组;而在L3光照条件下,各水分处理组间差异不显著。走马胎在W3水分条件下,各个组织部位的总皂苷含量均最高。此外,水分和光照对走马胎根和叶总皂苷含量存在显著的交互作用,根和叶总皂苷含量均在W3L2条件下最高。
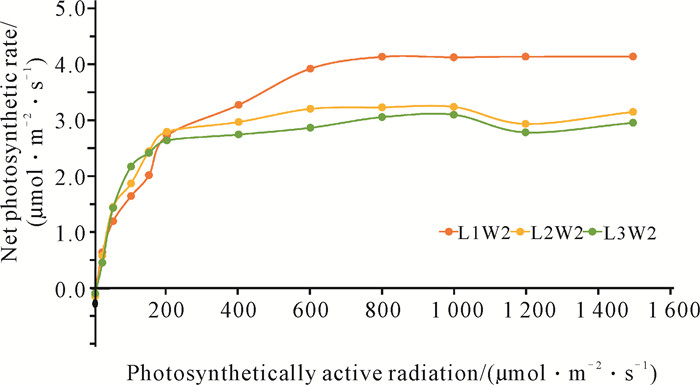
2.4 走马胎叶片的光合作用-光响应曲线植物对光照条件的要求由植物的光饱和点和光补偿点体现,LSP、LCP与植物利用光能进行光合作用的能力有关。如图 4所示,在相同水分不同光照条件下,在达到光饱和点之前,净光合速率(Net Photosynthetic Rate, Pn)随光合有效辐射PAR的增加而增大;在达到光饱和点后,Pn随PAR的增加趋于稳定并有降低的趋势,可能是过高的光照强度引起了光抑制。
|
| 图 4 不同透光率下走马胎的光合速率 Fig.4 Photosynthetic rate of A.kteniophylla under different light transmittance |
如表 2所示,随着光照强度的下降(L1W2>L2W2>L3W2),叶片最大净光合速率Pmax和LSP随之递减,表观量子效率随之增加,L1与L2、L3之间差异显著(P<0.05),L2与L3之间差异不显著。LCP是植物耐阴性评价的重要指标,直接反映植物对弱光的利用能力。阳性植物的光补偿点为9-18 μmol·m-2·s-1,阴性植物的光补偿点<9 μmol·m-2·s-1, 从表 2可以看出走马胎植株对弱光有较强的适应能力。
| 处理Treatment | 光饱和点LSP | 光补偿点LCP | 表观量子效率AQE | 最大净光合速率Pmax |
| L1W2 | 465 | 6 | 0.021b | 4.254a |
| L2W2 | 279 | 6 | 0.031a | 3.331b |
| L3W2 | 255 | 3 | 0.033a | 3.188b |
| Note: different lowercase letters indicate variance analysis reached significant difference at the 0.05 level. | ||||
3 讨论
植物生长受外界环境条件的影响,光照和水分作为植物生长发育必不可少的环境因子,对植物的生长和发育起着决定性的作用[14-16]。研究发现,低水分抑制植株的苗高、地径和叶面积等,而低光照同样会使植株的叶面积、株高及基径等降低[14, 15]。董伊晨等[16]研究发现,随着土壤水分的降低,异株荨麻(Urtica dioica)生长量和生物量积累呈先上升后下降趋势,其最佳生长的土壤水分为67.90%-80.74%。本研究结果表明,走马胎在70%-80%θf条件下,株高,茎粗,根、茎、叶及全株生物量的值均最高,表明该水分条件下走马胎生长最好;而在50%-60%θf的低水分条件下,走马胎生长受到显著抑制,这也与前人的研究结果[14, 16]一致。有研究表明,走马胎在弱光条件(20%)下产量最高[4]。本研究中,走马胎在20%-30%透光率下,株高,茎粗,根、茎、叶及全株生物量均最高,这也与周泽建[4]的研究结果类似。因此,走马胎的最适生长环境为70%-80%θf和20%-30%透光率。
游离脯氨酸和可溶性糖作为常用的植物生理渗透调节物质,在植物遭受低温、干旱、水涝及强光等逆境胁迫时会在体内大量积累,以提高细胞的渗透调节,这是植物自身的一种保护性反应[10, 17]。MDA作为膜质过氧化产物之一,其含量可以表示膜系统的损伤程度[15];而细胞质膜相对透性则能反应出膜的稳定性,其值越大表示细胞膜损伤程度越大[18]。本研究结果表明,脯氨酸、可溶性糖、MDA及细胞质膜4种抗逆相关的生理指标主要是在强光照(L1)下大量积累,而在低光照条件下没有明显变化。这也与周泽建[4]的研究结果一致,但与甘薯(Dioscorea esculenta)[19]和红毛五加(Eleutherococcus giraldii)[20]的研究结果相反。同时,研究表明在水分不足时,会导致MDA含量增多,细胞质膜相对透性增大,脯氨酸和可溶性糖含量增高。这也与前人的研究结果[15, 21, 22]一致。综上,较强光照和较低的水分条件使得MDA含量积累增多,并导致细胞质膜相对透性增大,这对植株的膜和细胞造成一定损伤。走马胎通过积累脯氨酸和可溶性糖来提高细胞的渗透调节能力,使细胞膨压得以维持,从而减缓环境胁迫带来的负面影响。因此,从抗逆生理指标来看,强光照和低水分对走马胎来说属于逆境,70%-80%θf和20%-30%透光率最适于走马胎生长。
走马胎主要药用成分为具有抗肿瘤作用的多种三萜皂苷类成分。药用植物在逆境胁迫下,作为主要药效成分的次生代谢产物往往会大量积累[4, 10]。研究表明适度缺水情况下,菘蓝(Isatis tinctoria)根部靛玉红的含量积累呈升高的趋势[23],黄檗(Phellodendron amurense)幼苗中药根碱、小檗碱及掌叶防己碱的合成积累增多[24]。本研究发现,走马胎在同一水分条件下,在L2和L3光照条件下,根、茎的总皂苷含量均较高。这也与周泽建[4]的研究结果一致。相同光照条件下,走马胎根、茎总皂苷的含量在W3处理组较高,与菘蓝[23]、黄檗[24]一致。这表明水分较低的逆境更有利于走马胎总皂苷的合成积累。
通过拟合光合作用-光响应曲线得到一系列光响应特征参数,对了解植物光合作用进程中的光化学效率有着重要意义[25]。LSP是植物的光合速率达到最大值时的光照强度,代表了植物耐强光的能力[25]。LCP可代表植物的耐阴能力,LCP越低,说明植物利用弱光的能力越强[26]。AQE是指植物光合作用的光能利用效率,AQE越高,说明叶片光能转化效率越高,利用弱光的能力越强[27]。Pmax是植物光合潜能的重要参数,反映植物最大光合作用能力[28]。本研究结果表明,走马胎在较强光照(L1)下,植物光合潜能最高,但对光的利用效率最低。而在L2条件下,其光合作用潜能及光的利用效率适中,最适宜植物生物量的积累,这也与本研究中生物量在L2条件下积累最多的结果(图 1)一致。本研究中,LSP随光照强度的下降递减,LCP为3-6 μmol·m-2·s-1,而阴生植物LCP<9 μmol·m-2·s-1,这表明走马胎耐强光能力较弱,利用弱光的能力较强,符合典型的阴生植物特点[29]。
4 结论本研究结果表明,强光照和低水分对走马胎的影响较大,不利于其生长。70%-80%θf和20%-30%透光率为走马胎最适生长条件,并且适度的缺水胁迫能够促进药效成分总皂苷的合成积累。光照和土壤水分对走马胎的生长、生理指标、光合特性和药效活性成分具有一定的影响。该研究可为走马胎的野外保护、人工栽培以及更好地开发利用提供参考。
| [1] |
HUANG G H, HU C M, HAO G. Rediscovery of Ardisia gigantifolia and the reinstatement of A.kteniophylla (Primulaceae): finding the correct name for the Chinese medicinal plant 'Zou Ma Tai'[J]. Nordic Journal of Botany, 2017, 35(6): 628-632. DOI:10.1111/njb.01672 |
| [2] |
魏蓉, 负建全, 谢思明, 等. 走马胎资源与利用研究进展[J]. 广东林业科技, 2015, 31(5): 94-98. DOI:10.3969/j.issn.1006-4427.2015.05.019 |
| [3] |
龙杰超, 徐传贵, 韦贵元, 等. 中药走马胎研究进展[J]. 中医药导报, 2017, 23(21): 75-78, 81. |
| [4] |
周泽建. 林药复合种植走马胎植物生长与生理生态特性[D]. 北京: 中央民族大学, 2020.
|
| [5] |
MU L H, WANG L H, WANG Y N, et al. Antiangiogenic effects of AG36, a triterpenoid saponin from Ardisia gigantifolia stapf[J]. Journal of Natural Medicines, 2020, 74(4): 732-740. DOI:10.1007/s11418-020-01427-4 |
| [6] |
MU L H, WANG L H, YU T F, et al. Triterpenoid saponin AG8 from Ardisia gigantifolia stapf induces triple negative breast cancer cells apoptosis through oxidative stress pathway[J]. Oxidative Medicine and Cellular Longevity, 2020, 7963212. |
| [7] |
中国科学院中国植物志编辑委员会. 中国植物志: 第二十七卷[M]. 北京: 科学出版社, 1979.
|
| [8] |
GUO X, GUO W, LUO Y, et al. Morphological and biomass characteristic acclimation of trident maple (Acer buergerianum Miq.) in response to light and water stress[J]. Acta Physiologiae Plantarum, 2013, 35(4): 1149-1159. DOI:10.1007/s11738-012-1154-0 |
| [9] |
杨虎彪, 林鹏, 刘国道. 不同光照和水分对吊罗山薹草生长的影响[J]. 热带作物学报, 2021, 42(9): 2623-2630. DOI:10.3969/j.issn.1000-2561.2021.09.025 |
| [10] |
孙恒, 张燕平, 王友琼, 等. 印楝幼苗对不同水分和光照条件的生理生态学响应[J]. 热带作物学报, 2020, 41(11): 2245-2252. DOI:10.3969/j.issn.1000-2561.2020.11.014 |
| [11] |
王学奎. 植物生理生化试验原理与技术[M]. 北京: 高等教育出版社, 2008.
|
| [12] |
陈建勋, 王晓峰. 植物生理学实验指导[M]. 广州: 华南理工大学出版社, 2015.
|
| [13] |
毛世忠, 赵博, 蒋小华, 等. 林下不同光照条件对走马胎苗木生长及光合特性的影响[J]. 西北林学院学报, 2016, 31(1): 21-24, 41. DOI:10.3969/j.issn.1001-7461.2016.01.04 |
| [14] |
柴胜丰, 唐健民, 王满莲, 等. 干旱胁迫对金花茶幼苗光合生理特性的影响[J]. 西北植物学报, 2015, 35(2): 322-328. |
| [15] |
刘翠菊, 郭霄, 王奎玲, 等. 耐冬山茶对不同光照和水分的生理生态学响应[J]. 应用生态学报, 2018, 29(4): 1125-1132. |
| [16] |
董伊晨, 刘悦秋. 异株荨麻(Urtica dioica)生长及光合特性对不同土壤水分含量的响应[J]. 生态学报, 2008(10): 4685-4691. DOI:10.3321/j.issn:1000-0933.2008.10.008 |
| [17] |
汪丽娜, 杨志玲, 杨旭, 等. 不同遮光处理对平茬后厚朴萌蘖株部分形态及生理指标的影响[J]. 植物资源与环境学报, 2017, 26(2): 55-60. |
| [18] |
邸锐, 杨春燕. 干旱胁迫下极细链格孢激活蛋白对大豆幼苗形态、叶片含水量、细胞质膜相对透性和抗氧化酶的影响[J]. 华北农学报, 2016, 31(S1): 213-218. |
| [19] |
李韦柳, 唐秀桦, 韦民政, 等. 遮阴对淀粉型甘薯生长发育及生理特性的影响[J]. 热带作物学报, 2017, 38(2): 258-263. |
| [20] |
陈玉锋, 黄旭峰, 古锐, 等. 不同光照强度下红毛五加光合及生理特性研究[J]. 中国中药杂志, 2018, 43(5): 926-933. |
| [21] |
邓旭, 董晨, 张广明. 干旱对两种金花茶幼苗抗氧化能力及渗透物质含量的影响[J]. 热带作物学报, 2012, 33(6): 1034-1039. |
| [22] |
潘昕, 邱权, 李吉跃, 等. 干旱胁迫对青藏高原6种植物生理指标的影响[J]. 生态学报, 2014, 34(13): 3558-3567. |
| [23] |
谭勇, 梁宗锁, 董娟娥, 等. 水分胁迫对菘蓝生长发育和有效成分积累的影响[J]. 中国中药杂志, 2008(1): 19-22. |
| [24] |
李霞, 王洋, 阎秀峰. 水分胁迫对黄檗幼苗三种生物碱含量的影响[J]. 生态学报, 2007, 27(1): 58-64. |
| [25] |
许国春, 罗文彬, 李华伟, 等. 彩色马铃薯光合光响应曲线模拟及其特征参数分析[J]. 福建农业学报, 2020, 35(7): 691-698. |
| [26] |
丁宇晖, 杨再强, 徐超, 等. 低温胁迫对设施三七叶片光响应曲线拟合的影响[J]. 东北林业大学学报, 2020, 48(3): 41-49, 55. |
| [27] |
许大全. 光合作用效率[M]. 上海: 上海科学技术出版社, 2002.
|
| [28] |
徐金忠, 魏琳, 徐洪亮, 等. 不同生态因子对荚果蕨生长和光合特性的影响[J]. 中国农学通报, 2017, 33(8): 19-24. |
| [29] |
孙悦燕, 郭跃东, 刘宁, 等. 不同光照条件下华北落叶松更新木的光响应曲线[J]. 山西农业大学学报(自然科学版), 2010, 30(5): 404-408. |



