2. 广西科学院, 广西海洋科学院(广西红树林研究中心), 广西海洋天然产物与组合生物合成化学重点实验室, 广西南宁 530007
2. Guangxi Key Laboratory of Marine Natural Products and Combinatorial Biosynthesis Chemistry, Guangxi Academy of Marine Sciences (Guangxi Mangrove Research Center), Guangxi Academy of Sciences, Nanning, Guangxi, 530007, China
虾蟹是世界渔业生产的重要产品,近年来每年虾蟹总产量高达1 000万吨,虾蟹在剥离可食部分后会产生大量固体废弃物,包括头部、壳体和尾部[1],这些固体废弃物在生产和消费过程中不可避免。然而,这些废弃物在环境保护和资源利用方面具有巨大的潜力。虾壳中含有约50%的蛋白质、20%的几丁质以及天然抗氧化剂虾青素等有价值的组分,这些组分在虾壳中相互紧密结合,不能被动物有效消化吸收利用[1, 2]。传统的强酸碱等加工工艺破坏了虾蟹壳中的蛋白质和其他有价值组分,会造成严重的环境污染和生物资源浪费[3]。在一些发达国家,处理虾蟹壳废弃物花费了高昂的成本[4]。因此,如何综合利用虾蟹壳废弃物是亟需解决的问题,同时,如何降解动物难以消化吸收的几丁质为高值的益生几丁寡糖也是当今研究的热点之一。
几丁质,又称甲壳素,是一种含氮多糖,由N-乙酰-D-氨基葡萄糖(N-Nacetyl-D-glucosamine,GlcNAc) 聚合而成,它是自然界中除纤维素外的第二大生物质,在甲壳类动物的外骨骼和大多数真菌的细胞壁中存在[5]。与纤维素等多糖不同,几丁质是N-乙酰-D-氨基葡萄糖经β-1, 4糖苷键聚合形成的含氮多糖,地球上几丁质的含氮量超过人类通过Haber-Bosch方法(氮肥合成的方法)固定的氮气总量, 其产物N-乙酰-D-氨基葡萄糖及几丁寡糖具有较好的生理功能。在哺乳动物中,N-乙酰-D-氨基葡萄糖是透明质酸和关节滑液合成的重要前体[6]。近年来的研究还发现蛋白质(包括转录因子)存在N-乙酰葡萄糖胺修饰,并调控了众多的免疫激活、代谢调节等通路,这些机制赋予了几丁寡糖丰富的生物学活性,包括美颜、缓解关节炎、血糖调节、抗肿瘤和抗炎作用等[7-9]。因此,越来越多的人开始关注几丁质及其水解产物的价值。
目前工业上对虾蟹壳废弃物的利用主要是通过化学法去除虾蟹壳废弃物中的矿物质和蛋白质,再生产几丁质、壳聚糖和几丁寡糖等物质。Percot等[10]对现有化学法生产几丁质的条件进行了优化,最终获得了脱矿度和脱蛋白度都很高的几丁质,但是处理过程中仍然会大量使用盐酸和氢氧化钠,不仅对环境造成严重污染,而且导致几丁质N-乙酰值的变化从而影响产品品质。为了解决化学法降解虾蟹壳中蛋白质等物质存在的问题,人们开始利用酶法和微生物法降解虾蟹壳。酶法包括使用胰蛋白酶、木瓜蛋白酶和消化酶等,但酶的成本较高、提取效率低。微生物法主要通过发酵过程中微生物产生的蛋白酶和有机酸实现脱蛋白和脱矿,从而使几丁质暴露出来[3, 7, 11]。
微生物处理法的优点在于实现资源重新利用的同时不会产生过多对环境有害的物质,这种方法有潜力解决虾蟹壳废弃物处理的问题。然而,目前微生物处理法还处在探索阶段,限制了其实际应用。此外,微生物降解虾蟹壳涉及的过程也相对复杂,需要进一步研究和优化[8, 12]。因此,本研究旨在寻找能够高效降解虾蟹壳的微生物,有效地将虾蟹壳废弃物转化为有用的产物,如生物肥料、动物饲料或生物能源;优化目标微生物降解虾蟹壳废弃物的降解条件,实现虾蟹壳废弃物的综合利用,减轻对环境的负荷。因此,研究虾蟹壳降解微生物对资源利用和环境保护都具有重要意义。
1 材料与方法 1.1 试剂和原料虾壳为温州洞头特产虾壳(购自洞头特产渔夫之家淘宝店),50 ℃烘箱烘干剪碎后过40目筛,灭菌烘干备用。
1.2 菌种土样来源将新鲜的土样样品活化并筛选出能高效降解几丁质的细菌。这些土样样品分别从广西河池市天峨县川洞,巴马瑶族自治县长寿村,盘阳河流域,都安瑶族自治县桃花水母天窗、九灵天窗,百色市乐业石围天坑群等地采集。
1.3 培养基配方配方中含有糖的培养基灭菌温度为115 ℃,时间为持续15 min;而其他培养基的灭菌温度为121 ℃,时间为持续20 min。
(1) 液体富集培养基1 000 mL:FeSO4·7H2O 0.01 g,MgSO4·7H2O 0.6 g,胶体几丁质10 g,K2HPO4 0.7 g,KH2PO4 0.3 g,初始pH值7.0。
(2) 分离培养基1 000 mL: K2HPO4 0.3 g,NaCl 0.1 g,FeSO4·7H2O 0.01 g,NH4Cl 0.1 g,MgSO4·7H2O 0.5 g,KH2PO4 0.7 g,胶体几丁质10 g,琼脂15-20 g, 初始pH值7.0。
(3) 种子培养基1 000 mL: 葡萄糖4 g,KH2PO4 0.7 g,K2HPO4 0.3 g,MgSO4·7H2O 0.6 g,酵母粉2 g,蛋白胨2 g,pH值7.0。
(4) 发酵培养基1 000 mL: 果糖2 g,KH2PO4 0.7 g,K2HPO4 0.3 g,MgSO4·7H2O 0.6 g,酵母粉0.5 g,牛肉膏4 g,蛋白胨4 g,初始pH值8.0。
1.4 富集培养取1 g土壤样品加入30 mL无菌水中,30 ℃、200 r/min培养6 h,充分混合后,取上清液置于富集培养基中,30 ℃、150 r/min恒温摇床下培养3 d,得到富集的菌样。
1.5 几丁质降解菌的筛选与纯化平板透明圈法是筛选几丁质菌的一种高效方法,即在固体培养基中加入溶解性差、可被微生物利用的营养成分,造成浑浊、不透明的培养基背景,待筛选的菌落附近就会形成透明圈,透明圈的大小反映了菌落降解此物质的能力[13, 14]。吸取富集菌的培养液按10-3-10-4梯度稀释后,每个稀释梯度取100 μL均匀地涂覆在分离培养基中并于30 ℃恒温培养箱中倒置培养,定期观察。挑取菌落周围出现透明圈较大的菌落进行4区划线纯化。
1.6 菌株的鉴定以27F和1492R作为引物,以菌体作为模板。按表 1配制成25 μL的体系后进行PCR反应扩增并对PCR产物进行琼脂糖凝胶电泳。选出有目的片段的PCR产物,送至生工生物工程(上海)股份限公司测序,测序结果提交美国国家生物技术信息中心(NCBI)官网上的BLAST对16S rDNA序列进行分析,确定菌株的分类地位。实验使用25 μL体系进行PCR扩增,程序建立如表 2所示,反应共30个循环。
| 添加物 Additive |
用量/μL Amount/μL |
| DNA templates | 1.0 |
| Forward primer 27F | 1.0 |
| Reverse primer 1492R | 1.0 |
| ddH2O | 9.5 |
| 2×Taq Master Mix | 12.5 |
| 程序 Procedure |
温度/℃ Temperature/℃ |
时间 Time |
| Pre-denaturation | 95 | 15 min |
| Denaturation | 95 | 30 s |
| Annealing | 50 | 30 s |
| Extend | 72 | 90 s |
| Post-extension | 72 | 10 min |
1.7 产几丁质酶菌种直径比的测定
将筛选到的菌种接种于种子培养基中,25 ℃、180 r/min培养12 h,用牙签蘸取少量菌液接种于分离培养基中并于30 ℃恒温培养箱中倒置培养,定期测量透明圈和菌株的大小,并通过两者的比值确定该菌株的直径比。
1.8 几丁质粗酶活力测定几丁质酶可水解几丁质的β-1,4-糖苷键并生成还原糖,本研究利用二硝基水杨酸(DNS)法[15]测定几丁质酶活力,以N-乙酰-D-氨基葡萄糖为底物,测定不同底物浓度在540 nm处的吸光度,绘制标准曲线。利用含有以胶体几丁质为唯一碳源的富集培养基,选择直径比较大的几株菌进行粗酶活力测定,比较其酶活力大小并进一步选择酶活力较高的菌株探究其对虾壳的降解能力。反应体系:离心后的发酵液上清液100 μL和400 μL胶体几丁质,反应温度为45 ℃,反应时间为30 min,水浴结束后沸水浴10 min终止反应,加入500 μL的DNS溶液,沸水浴中反应5 min,冰水冷却至室温后12 000 r/min离心3 min,于540 nm处测量吸光度。通过标准曲线求出其还原糖含量。酶活力定义为在30 ℃、pH值为7的条件下,每分钟生成1 μmoL还原糖所需酶量。
1.9 产几丁质酶菌株降解虾壳条件的优化取虾壳烘干并剪碎后过40目筛,灭菌后烘干备用。将C.aquatile gxas1菌种接种于种子培养基中,25 ℃、180 r/min培养12 h,接种于100 mL发酵培养基中,培养24 h后,按照2%的添加量加入过筛后的虾壳进行发酵试验条件优化,通过不同培养条件发酵后虾壳的损耗量选择最佳培养条件。
1.9.1 氮源对产几丁质酶菌株降解虾壳能力的影响以不加虾壳废弃物的发酵培养基为对照组,在温度为30 ℃、pH值为7的发酵条件下发酵7 d,选择牛肉膏(0.8%)、蛋白胨(0.8%)、麦芽提取物(0.8%)以及牛肉膏+蛋白胨(0.4%+0.4%)作为氮源,探究不同氮源对产几丁质酶菌株降解虾壳能力的影响,每组设3个平行样,其他培养基成分为葡萄糖2 g/L,KH2PO4 0.7 g/L,K2HPO4 0.3 g/L,MgSO4·7H2O 0.6 g/L,酵母粉0.5 g/L。
1.9.2 碳源对产几丁质酶菌株降解虾壳能力的影响在温度为30 ℃、pH值为7的发酵条件下发酵7 d,选择葡萄糖、果糖、蔗糖以及麦芽糖作为碳源探究不同碳源对产几丁质酶菌株降解虾壳能力的影响,每组设3个平行样,其他培养基成分为KH2PO4 0.7 g/L,K2HPO4 0.3 g/L,MgSO4·7H2O 0.6 g/L,酵母粉0.5 g/L,牛肉膏4 g/L,蛋白胨4 g/L。
1.9.3 发酵时间对产几丁质酶菌株降解虾壳能力的影响在温度为30 ℃、pH值为7的发酵条件下,确定最优碳源和氮源后,设置发酵时间分别为3、5、7、9 d,每组设3个平行样,探究不同发酵时间对产几丁质酶菌株降解虾壳能力的影响。
1.9.4 发酵温度对产几丁质酶菌株降解虾壳能力的影响在pH值为7、最优碳源和氮源的发酵条件下发酵9 d,设置发酵温度分别为20、25、30、37 ℃,每组设3个平行样,探究发酵温度对产几丁质酶菌株降解虾壳能力的影响。
1.9.5 发酵接种量对产几丁质酶菌株降解虾壳能力的影响在温度为20 ℃、pH值为7、最优碳源和氮源的发酵条件下发酵9 d,设置发酵接种量分别为0.2%、0.5%、1.0%、1.5%、2.0%,每组设3个平行样,探究发酵接种量对产几丁质酶菌株降解虾壳能力的影响。
1.9.6 初始pH值对产几丁质酶菌株降解虾壳能力的影响在温度为20 ℃、最优碳源和氮源、接种量为2.0%的条件下发酵9 d,设置发酵初始pH值分别为6.0、7.0、7.2、8.0,每组设3个平行样,探究初始pH值对产几丁质酶菌株降解虾壳能力的影响。
1.10 虾壳降解率的测定称取经过发酵处理或未经发酵处理的虾壳0.2 g,烘干,称重,得到经过发酵处理或未经发酵处理的干虾壳的重量,根据公式计算发酵处理后虾壳的降解率。计算公式如下:
| $X(\%)=\left(m_0-m\right) / m_0 \times 100 \%, $ | (1) |
式中,X为虾壳的降解率,m0为未经发酵处理的干虾壳的质量,m为经过发酵处理的干虾壳的质量。
1.11 微生物降解虾壳过程中的生长曲线及pH值变化将C.aquatile gxas1菌种接种于种子培养基中,30 ℃、160 r/min培养24 h,得到活化菌液。取活化菌液以2.0%接种量接种于100 mL发酵培养基中培养24 h后得到菌液,在所得菌液中加入2 g虾壳,20 ℃发酵培养9 d,每12 h取发酵液,检测发酵液的OD600和pH值。
1.12 蛋白质含量测定在最佳条件下发酵,发酵结束后,离心,弃上清,沉淀为样品虾壳。以未经过发酵处理的相同质量的虾壳为对照,利用凯式定氮法[16]检测两种虾壳中蛋白质的含量。具体检测方法:将虾壳(经过发酵处理的样品虾壳或未经过发酵处理的虾壳)分别用15 mL 1 mol/L NaOH处理4 h(搅拌2 h,60 ℃干燥箱放置2 h)进行脱蛋白处理,处理结束后12 000 r/min离心10 min,取上清液作液体样品;用等量的1 mol/L NaOH为空白对照;在实验组和空白对照组分别加入3 g催化剂(硫酸铜和硫酸钾)和10 mL浓硫酸进行消化,然后放入消化炉中,盖上漏斗盖子,同时打开水阀循环吸收气体;冷却之后将50 mL水倒入消化管中(加水前先将样品摇匀),然后每个管加入过量NaOH;打开自动定氮仪,首先用水清洗一遍机子,然后开始过样品,同时放置装有硼酸的接收瓶(每个样5 min),最后在装有硼酸的接收瓶里加入指示剂进行盐酸滴定、空白滴定,液体颜色由蓝变红即为滴定终点。计算公式如下:
| $ X=\left[\left(V_1-V_2\right) \times c \times 0.014\right] / m \times F \times 100, $ |
式中,X为蛋白质含量,V1为空白对照滴定消耗的标准溶液(mL),V2为样品滴定消耗的标准溶液(mL),c为盐酸标准溶液的浓度(mol/L),m为样品质量(g),0.014为氮的毫摩尔质量(g/mmol),F为蛋白质系数,100为单位换算系数。根据公式计算脱蛋白率。
脱蛋白率(%)=(未经发酵处理的虾壳中蛋白质的含量-样品虾壳中蛋白质的含量)/未经发酵处理的虾壳中蛋白质的含量×100%。
1.13 几丁质含量的测定根据张恒[17]的方法提取几丁质。分别称取经过发酵处理或未经发酵处理的虾壳0.2 g与15 mL 1 mol/L NaOH溶液混合后放到搅拌器上搅拌30 min,接着放入干燥箱内干燥2.5 h,重复两次;然后离心机离心(12 000 r/min、5 min),倒掉上清后用水将虾壳反复离心清洗至中性;再取15 mL 2 mol/L HCl溶液和虾壳一起倒入小烧杯中常温搅拌3 h,结束后离心机12 000 r/min离心5 min,弃上清液并用去离子水反复冲洗并离心,直至pH为中性,最后放入干燥箱内干燥后称重,得到经过发酵处理或未经发酵处理的虾壳中几丁质的含量。其中用NaOH和HCl溶液处理的目的是分别去除虾壳中的蛋白质和钙离子。计算几丁质的回收率。
几丁质的回收率(%)=(未经发酵处理的虾壳中几丁质的含量-经发酵处理的虾壳中几丁质的含量)/未经发酵处理的虾壳中几丁质的含量×100%。
2 结果与分析 2.1 几丁质降解菌的筛选及其分离纯化样品经富集培养、分离纯化后得到了4株具有降解几丁质能力的细菌。表 3是经过筛选得到的4株菌株的测序鉴定结果,其中粘质沙雷氏菌Serratia marcescens gxas3与S.marcescens strain 27F相似性为98.41%,蜡样芽孢杆菌B.cereus gxas5与B.cereus strain NS26相似性为99.36%,嗜麦芽糖窄食单胞菌Stenotrophomonas maltophilia gxas7与S.maltophilia strain BF4-4相似性为99.45%,水生几丁质菌C.aquatile gxas1与C.aquatile strain PS4R-81相似性为97.5%。
| 菌株 Strains |
相似菌株 Similar strains |
相似性/% Similarity/% |
| Serratia marcescens gxas3 | S.marcescens strain 27F | 98.41 |
| B.cereus gxas5 | B.cereus strain NS26 | 99.36 |
| Stenotrophomonas maltophilia gxas7 | S.maltophilia strain BF4-4 | 99.45 |
| C.aquatile gxas1 | C.aquatile strain PS4R-81 | 97.50 |
2.2 菌落透明圈及粗酶活力测定
如表 4所示,B.cereus gxas5的直径比最大,为4.8,其次为C.aquatile gxas1和Serratia marcescens gxas3,Stenotrophomonas maltophilia gxas7最小。
| 菌株 Strains |
透明圈直径 (D)/mm Diameter of transparent circle (D)/mm |
菌落直径 (d)/mm Colony diameter (d)/mm |
D/d |
| Serratia marcescens gxas3 | 34 | 15.0 | 2.27 |
| B.cereus gxas5 | 12 | 2.5 | 4.80 |
| Stenotrophomonas maltophilia gxas7 | 17 | 16.5 | 1.03 |
| C.aquatile gxas1 | 29 | 12.5 | 2.32 |
选择B.cereus gxas5、Serratia marcescens gxas3和C.aquatile gxas1进行粗酶活力测定,探究不同菌株的产酶情况,结果如图 1所示。这3株菌在不同时期其产酶活力也不同,其中S.marcescens gxas3在发酵72 h时粗酶活力最高,达到0.20 U/mL;B.cereus gxas5在发酵36 h时粗酶活力最高,达到0.158 U/mL;C.aquatile gxas1在发酵96 h时粗酶活力最高,达到0.244 U/mL。
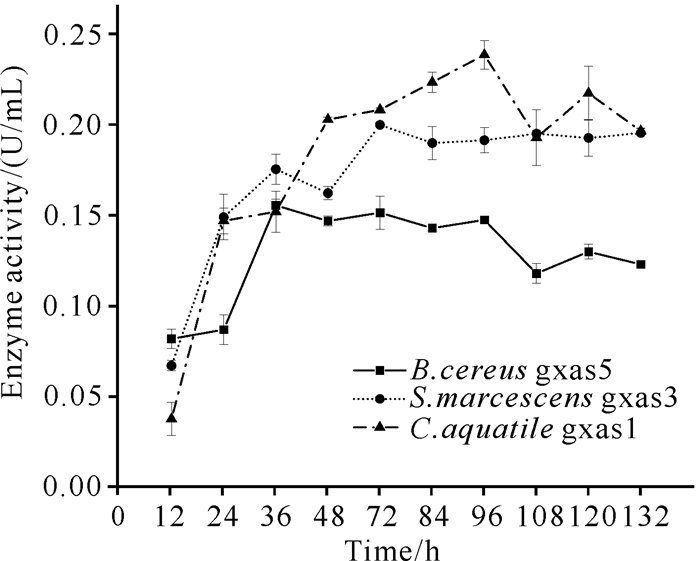
|
| 图 1 几丁质高效降解菌株粗酶活力 Fig.1 Crude enzyme activity of chitin-degrading strain |
2.3 虾壳最适降解发酵条件优化 2.3.1 氮源的优化
氮源对发酵降解虾壳废弃物的降解率如图 2所示。采用菌株C.aquatile gxas1处理虾壳,培养基以牛肉膏+蛋白胨为氮源时的降解能力最强,为48%,比牛肉膏、蛋白胨和麦芽提取物分别高4%、4%和2%,因此选择牛肉膏+蛋白胨(0.4%+0.4%)为发酵氮源。

|
| 图 2 氮源对虾壳降解的影响 Fig.2 Effects of nitrogen sources on shrimp shell degradation |
2.3.2 碳源的优化
由图 3可知,4种碳源对菌株C.aquatile gxas1的产量和生长状况的影响存在差异,其中以果糖作为碳源为C.aquatile gxas1提供能量时对虾壳的降解率最高,为50%,而以麦芽糖和葡萄糖作为碳源时对C.aquatile gxas1的影响较大,其中蔗糖对虾壳的降解率最低,为37%。因此选择果糖作为发酵培养基的碳源。
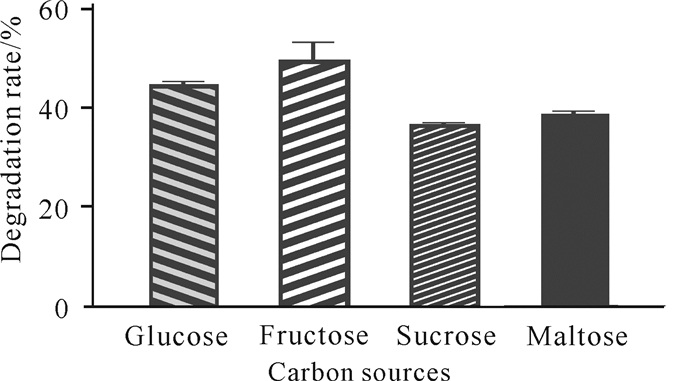
|
| 图 3 碳源对虾壳降解的影响 Fig.3 Effects of carbon sources on shrimp shell degradation |
2.3.3 发酵时间的优化
发酵时间对虾壳降解影响较大。如图 4所示,当菌株C.aquatile gxas1对虾壳发酵到第9 d时,降解能力最优。
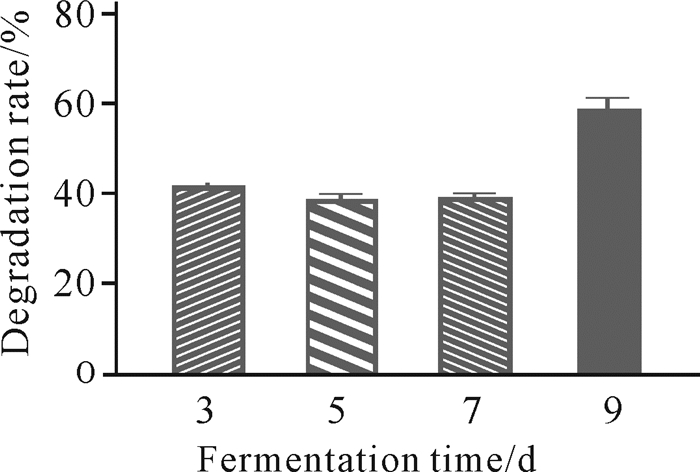
|
| 图 4 发酵时间对虾壳降解的影响 Fig.4 Effects of fermentation time on shrimp shell degradation |
2.3.4 发酵温度的优化
发酵温度对虾壳降解的影响如图 5所示。当温度为20 ℃时,菌株C.aquatile gxas1对虾壳的降解能力最优。
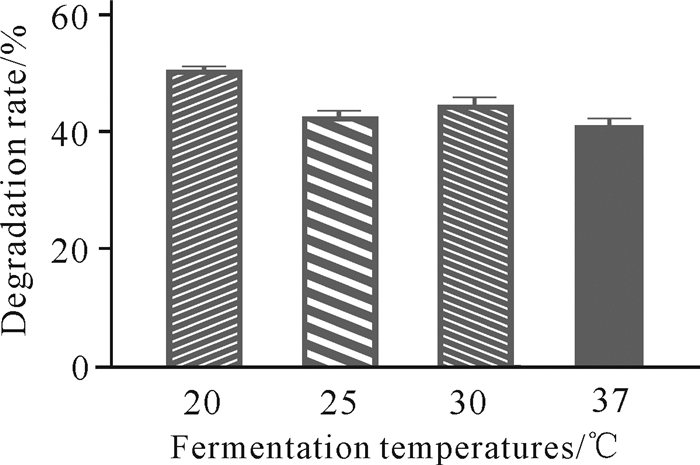
|
| 图 5 发酵温度对虾壳降解的影响 Fig.5 Effects of fermentation temperatures on shrimp shell degradation |
2.3.5 发酵接种量的优化
发酵接种量对虾壳降解的影响如图 6所示。当发酵接种量为2.0%时,菌株C.aquatile gxas1对虾壳的降解能力最强;当菌液接种量小于2.0%时,C.aquatile gxas1对虾壳的降解能力有所下降。因此,采用C.aquatile gxas1降解虾壳时,最佳菌液接种量为2.0%。
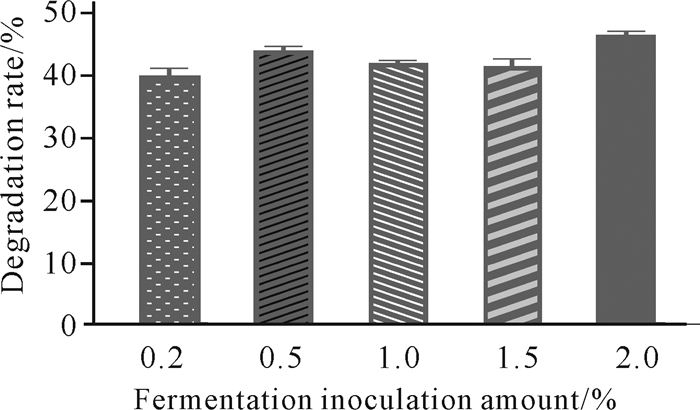
|
| 图 6 发酵接种量对虾壳降解的影响 Fig.6 Effects of fermentation inoculation amount on shrimp shell degradation |
2.3.6 发酵培养基初始pH值的优化
微生物在生长代谢过程中会引起培养环境pH值的变化,pH值过高或过低都会影响其进一步的生长。如图 7所示,当发酵培养基初始pH值分别为6.0、7.0、7.2、8.0时,菌株C.aquatile gxas1对虾壳的降解能力差别较小。当初始pH值为8.0时,C.aquatile gxas1对虾壳的降解能力最强,为46%。
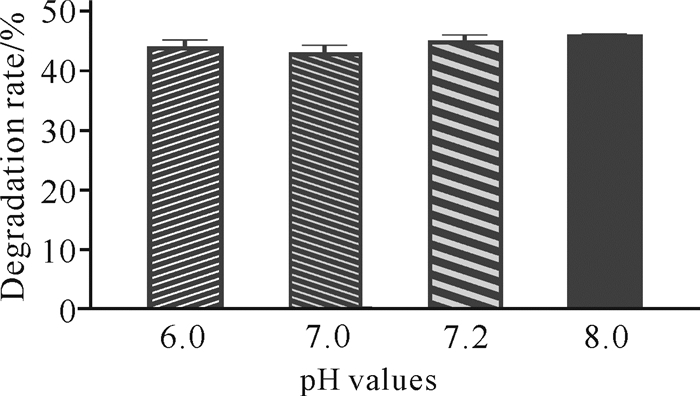
|
| 图 7 发酵培养基初始pH值对虾壳降解的影响 Fig.7 Effects of initial pH values of fermentation media on shrimp shell degradation |
2.4 菌株C.aquatile gxas1降解虾壳过程中的生长状况及pH值变化
如图 8所示,C.aquatile gxas1在降解虾壳过程中,OD600值在加入虾壳的第1天至第2天呈快速上升趋势,第2天至第7天缓慢上升,菌株生长趋于稳定。如图 9所示,pH值在加入虾壳的前两天呈快速上升趋势,之后呈缓慢上升趋势。
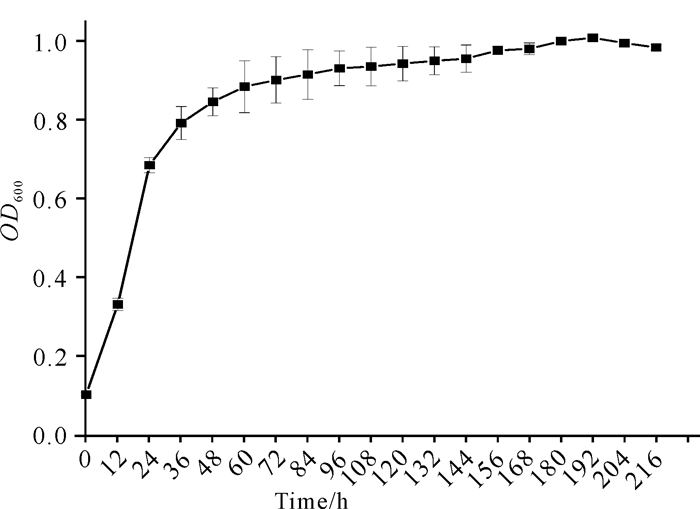
|
| 图 8 菌株C.aquatile gxas1降解虾壳的生长曲线 Fig.8 Growth curve of strain C.aquatile gxas1 in the treatment of shrimp shell |
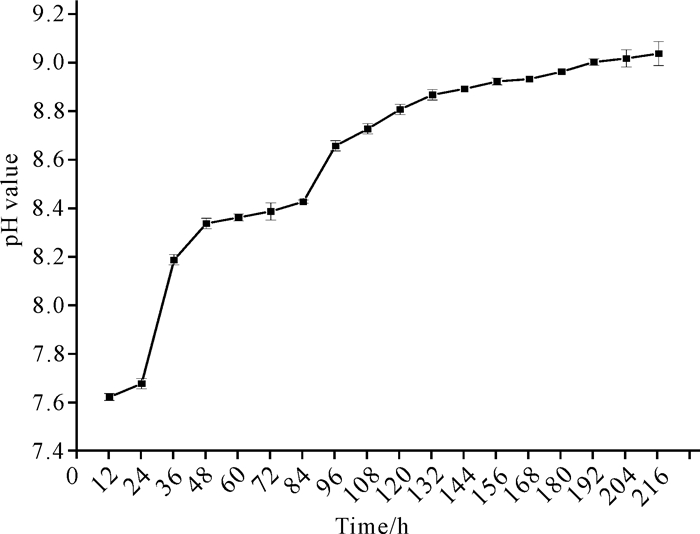
|
| 图 9 菌株C.aquatile gxas1降解虾壳的pH值变化曲线 Fig.9 pH value variation curve of strain C.aquatile gxas1 in the treatment of shrimp shell |
2.5 菌株C.aquatile gxas1发酵虾壳最优试验
单因素优化试验得出,C.aquatile gxas1发酵虾壳试验最优发酵培养基碳源为果糖、氮源为牛肉膏+蛋白胨,最优发酵条件初始pH值为8.0、接种量为2.0%、发酵天数为9 d、发酵温度为20 ℃。在最优条件下进行菌株降解虾壳试验,最终得出C.aquatile gxas1对虾壳的降解率为60%,其中几丁质回收率为87%、脱蛋白率为76.77%。
3 讨论与传统对环境污染严重的化学法和能耗高的物理法相比,利用微生物发酵法降解虾蟹壳废弃物中的几丁质和蛋白质是一种更绿色环保、成本更低的方法,可进一步作为未来实现绿色降解虾蟹壳废弃物的方向。本研究筛选到一株能够降解几丁质的菌株C.aquatile gxas1并探究其降解虾蟹壳的能力。通过单因素优化试验确定了培养基的最佳碳源为果糖(0.2%),最佳氮源为牛肉膏+蛋白胨(0.4%+0.4%);最优发酵条件初始pH值为8.0,接种量为2.0%,培养温度为20 ℃。在上述最优条件下,菌株C.aquatile gxas1在第9 d时达到虾壳最大降解率60%,其中,脱蛋白率为76.77%,几丁质回收率为87%,优于铜绿假单胞菌Pseudomonas aeruginosa[18]、植物乳杆菌和苏云金芽孢杆菌B.thuringiensis[19]。表 5列举了近年来微生物降解虾壳废弃物的一些研究。Li等[20]利用发酵乳杆菌L.fermuntum使虾壳脱蛋白率、脱矿率以及几丁质回收率分别为89.48%、85.11%和16.30%。菌酶连用、连续发酵或共发酵可提高虾壳的脱蛋白率和脱矿率。Zhang等[21]利用S.marcescens B742和L.plantarum ATCC 8014对虾壳进行处理,虾壳的脱矿率和脱蛋白率分别为93%和94.50%。Zhang等[22]采用枯草芽孢杆菌B.subtilis和巴氏醋杆菌A.pasteurianus、Liu等[23]采用鼠李糖乳杆菌L.rhamnoides和戊酸芽孢杆菌B.amyloliquefaciens对虾壳进行共发酵,虾壳的脱矿率和脱蛋白率均达到90%以上。影响微生物降解虾壳的因素主要包括发酵pH值、接种量、温度、预处理和发酵时间等。严金红等[26]研究发现,不同有机酸对虾壳的软化程度不同。Rao等[27]通过调节发酵初始pH值以及调节发酵过程中糖的添加量,发现发酵过程中pH值的变化对虾壳中灰分和蛋白质的去除有较大影响。
| 菌株 Strains |
几丁质得率/% Chitin yield/% |
几丁质回收率/% Chitin recovery rate/% |
脱蛋白率/% Deproteinization rate/% |
脱矿率/% Demineralization rate/% |
发酵时间/d Fermentation time/d |
参考文献 References |
| C.aquatile gxas1 | 87 | 76.77 | 9 | This study | ||
| Lactobacillus fermuntum | 16.3 | 89.48 | 85.11 | 4 | [20] | |
| Serratia marcescens B742 and L.plantarum ATCC 8014 | 18.90 | 94.50 | 93 | 6 | [21] | |
| Bacillus subtilis and A.pasteurianus | 18 | 94.50 | 92 | 5 | [22] | |
| L.rhamnoides and B.amyloliquefaciens | 19.60 | 96.80 | 97.50 | 5.5 | [23] | |
| B.subtilis | 93.00 | 84 | 72 | 15 | [24] | |
| Exiguobacterium profundum and L.acidophilus | 16.32 | 47.82 | 85.9±1.2 | 95±3 | 5 | [25] |
| Note: chitin yield indicates the residual chitin content after fermentation of shrimp and crab shells by microbial fermentation, chitin recovery rate indicates the ratio of the residual chitin in the shrimp shell after degradation to the chitin content in the shrimp shell before degradation. | ||||||
本研究只测定了菌株C.aquatile gxas1发酵虾壳后的蛋白质和几丁质含量变化,其脱矿率及产物等仍需要进一步分析。除此之外,连续发酵或共发酵也被用于降解虾壳,未来仍需进一步探究C.aquatile gxas1与其他菌株连续发酵或共发酵对虾壳降解率的影响,为微生物降解虾蟹壳提供理论依据。
4 结论对来源于广西河池市和百色市的土壤进行富集培养,分离纯化后得到4株能够降解几丁质的菌株Serratia marcescens gxas3、B.cereus gxas5、Stenotrophomonas maltophilia gxas7以及C.aquatile gxas1。对Serratia marcescens gxas3、B.cereus gxas5以及C.aquatile gxas1进行粗酶活力测定发现C.aquatile gxas1的酶活力在96 h时最高, 为0.244 U/mL。
利用C.aquatile gxas1对虾壳进行降解,通过对比处理前后虾壳的干重以及蛋白质、几丁质含量的变化发现C.aquatile gxas1对虾壳具有较好的降解能力。利用单因素试验对发酵培养基和发酵条件进行优化,结果显示C.aquatile gxas1发酵虾壳的最优条件是以果糖(0.2%)作为碳源、牛肉膏+蛋白胨(0.4%+0.4%)作为氮源,发酵温度为20 ℃、培养基初始pH值为8.0、接种量为2.0%,在此条件下发酵9 d时C.aquatile gxas1对虾壳的降解率最大,为60%,其中脱蛋白率为76.77%,几丁质回收率为87%。研究结果表明,在优化条件下,C.aquatile gxas1对虾壳具有较好的降解能力,可以用于废弃虾蟹壳的资源化利用,为实现绿色降解虾蟹壳废弃物提供了研究思路。本研究结果将有助于减少虾蟹壳废弃物对环境的污染,促进虾蟹养殖业的可持续发展。
| [1] |
邓俊劲. 新型蛋白酶及几丁质酶的开发及其在虾加工废弃物中的应用[D]. 广州: 华南理工大学, 2020.
|
| [2] |
刘宇, 方国宏, 戎素红, 等. 虾、蟹壳利用的研究进展[J]. 食品安全质量检测学报, 2018, 9(3): 461-466. DOI:10.3969/j.issn.2095-0381.2018.03.001 |
| [3] |
张荣, 凌晓宁, 李昆太. 微生物降解角蛋白机制及角蛋白酶应用研究进展[J]. 生物灾害科学, 2020, 43(4): 331-337. DOI:10.3969/j.issn.2095-3704.2020.04.61 |
| [4] |
刘妍池. 设计人工"几丁质小体"降解几丁质[D]. 保定: 河北农业大学, 2019.
|
| [5] |
王艳君. 海洋假交替单胞菌属细菌降解几丁质的特性及新型几丁质酶的表征[D]. 济南: 山东大学, 2020.
|
| [6] |
常艺锦. N-乙酰-D-氨基葡萄糖水凝胶修复软骨损伤的机制研究[D]. 锦州: 锦州医科大学, 2022.
|
| [7] |
LEE C G. Chitin, chitinases and chitinase-like proteins in allergic inflammation and tissue remodeling[J]. Yonsei Medical Journal, 2009, 50(1): 22-30. DOI:10.3349/ymj.2009.50.1.22 |
| [8] |
YOUNES I, RINAUDO M. Chitin and chitosan preparation from marine sources.Structure, properties and applications[J]. Marine Drugs, 2015, 13(3): 1133-1174. DOI:10.3390/md13031133 |
| [9] |
解鑫. N-乙酰-D-氨基葡萄糖的制备及其抗氧化性研究[D]. 大连: 大连工业大学, 2010.
|
| [10] |
PERCOT A, VITON C, DOMARD A. Optimization of chitin extraction from shrimp shells[J]. Biomacromolecules, 2003, 4(1): 12-18. DOI:10.1021/bm025602k |
| [11] |
TASER B, OZKAN H, ADIGUZEL A, et al. Preparation of chitosan from waste shrimp shells fermented with Paenibacillus jamilae BAT1[J]. International Journal of Biological Macromolecules, 2021, 183: 1191-1199. DOI:10.1016/j.ijbiomac.2021.05.062 |
| [12] |
CHEONG J Y, MUSKHAZLI M, NOR AZWADY A A, et al. Three dimensional optimisation for the enhancement of astaxanthin recovery from shrimp shell wastes by Aeromonas hydrophila[J]. Biocatalysis and Agricultural Biotechnology, 2020, 27: 101649. DOI:10.1016/j.bcab.2020.101649 |
| [13] |
傅嘉敏, 刘腾飞, 韩晓阳. 山东茶园土壤几丁质降解菌的分离、鉴定及产酶特性研究[J]. 山东农业科学, 2018, 50(10): 80-84. |
| [14] |
王宜磊, 邓振旭. 透明圈法快速筛选半纤维素分解菌[J]. 生物技术, 2000, 10(1): 37-39. |
| [15] |
沈诚, 李戎, 胡婷莉, 等. 木聚糖酶活力的二硝基水杨酸(DNS)测定法[J]. 印染, 2011, 37(2): 35-39. DOI:10.3321/j.issn.1000-4017.2011.02.011 |
| [16] |
国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准食品中蛋白质的测定: GB 5009.5-2016 [S]. 北京: 中国标准出版社, 2017.
|
| [17] |
张恒. 龙虾壳中几丁质的提取与应用[J]. 食品与机械, 1997, 13(4): 31-32. |
| [18] |
SEDAGHAT F, YOUSEFZADI M, TOISERKANI H, et al. Chitin from Penaeus merguiensis via microbial fermentation processing and antioxidant activity[J]. International Journal of Biological Macromolecules, 2016, 82: 279-283. DOI:10.1016/j.ijbiomac.2015.10.070 |
| [19] |
ROSMAWATI A, RUMHAYATI B, SRIHARDYASTUTIE A. Biorecovery of chitin from shrimp shell waste (Litopenaeus vanamme) using fermentation and co-fermentation of L.plantarum and B.thuringiensis[J]. IOP Conference Series: Materials Science and Engineering, 2019, 546(2): 022019. DOI:10.1088/1757-899X/546/2/022019 |
| [20] |
LI J, SONG R, ZOU X, et al. Simultaneous preparation of chitin and flavor protein hydrolysates from the by-products of shrimp processing by one-step fermentation with Lactobacillus fermuntum[J]. Molecules, 2023, 28(9): 3761. DOI:10.3390/molecules28093761 |
| [21] |
ZHANG H, JIN Y, DENG Y, et al. Production of chitin from shrimp shell powders using Serratia marcescens B742 and Lactobacillus plantarum ATCC 8014 successive two-step fermentation[J]. Carbohydrate Research, 2012, 362: 13-20. DOI:10.1016/j.carres.2012.09.011 |
| [22] |
ZHANG Q, WANG L, LIU S, et al. Establishment of successive co-fermentation by Bacillus subtilis and Acetobacter pasteurianus for extracting chitin from shrimp shells[J]. Carbohydrate Polymers, 2021, 258: 117720. DOI:10.1016/j.carbpol.2021.117720 |
| [23] |
LIU Y, XING R, YANG H, et al. Chitin extraction from shrimp (Litopenaeus vannamei) shells by successive two-step fermentation with Lactobacillus rhamnoides and Bacillus amyloliquefaciens[J]. International Journal of Biological Macromolecules, 2020, 148: 424-433. DOI:10.1016/j.ijbiomac.2020.01.124 |
| [24] |
DUN Y, LI Y, XU J, et al. Simultaneous fermentation and hydrolysis to extract chitin from crayfish shell waste[J]. International Journal of Biological Macromolecules, 2019, 123: 420-426. DOI:10.1016/j.ijbiomac.2018.11.088 |
| [25] |
XIE J, XIE W, YU J, et al. Extraction of chitin from shrimp shell by successive two-step fermentation of Exiguobacterium profundum and Lactobacillus acidophilus[J]. Frontiers in Microbiology, 2021, 12: 677126. DOI:10.3389/fmicb.2021.677126 |
| [26] |
严金红, 缪文华, BHOKE M N, 等. 有机酸软化凡纳滨对虾虾壳的效果研究[J]. 浙江海洋大学学报(自然科学版), 2018, 37(5): 394-399. DOI:10.3969/j.issn.1008-830X.2018.05.003 |
| [27] |
RAO M S, MUÑOZ J, STEVENS W F. Critical factors in chitin production by fermentation of shrimp biowaste[J]. Applied Microbiology and Biotechnology, 2000, 54(6): 808-813. DOI:10.1007/s002530000449 |



