2. 广西科学院大健康所, 非粮生物质酶解国家重点实验室, 国家非粮生物质能源工程技术研究中心, 广西生物质工程技术研究中心, 广西生物炼制重点实验室, 广西南宁 530007;
3. 中国科学院分子植物科学卓越创新中心, 中国科学院合成生物学重点实验室, 上海 200032
2. State Key Laboratory of Non-food Biomass and Enzyme Technology, National Engineering Research Center for Non-food Biorefinery, Guangxi Biomass Engineering Technology Research Center, Guangxi Key Laboratory of Bio-refinery, Institute of Grand Health, Guangxi Academy of Sciences, Nanning, Guangxi, 530007, China;
3. CAS-Key Laboratory of Synthetic Biology, CAS Center for Excellence in Molecular Plant Sciences, Shanghai, 200032, China
粉防己(Stephania tetrandra S.Moore)是防己科(Menispermaceae)千金藤属(Stephania)植物,属常年生落叶缠绕草质藤本,野生态根茎常外露,叶纸质,呈阔三角形或近圆形,生长于阴湿的低山区或丘陵,主要分布在皖南、江西、广西等地[1]。粉防己根作为一味重要的中药材已有近2000年的临床应用历史。传统中药学记载,防己具有祛风止痛、利尿、消肿等功效,可用于治疗类风湿关节炎、湿疹和高血压等疾病。近年来,随着对粉防己主要活性成分的提取、结构鉴定和药理作用等的深入研究,粉防己众多宝贵的药用价值逐渐得到挖掘和开发[2, 3]。目前,研究已发现粉防己具有抗癌[4, 5]、抗心律失常和心肌缺血[6]、抗肺纤维化[7]、抗炎镇痛[8]和抗菌[9, 10]等药理作用。
研究表明,粉防己的活性成分主要有原小檗碱类、阿朴菲类和苄基异喹啉类等生物碱[11],其中以苄基异喹啉类生物碱的含量较为丰富,尤其是汉防己甲素(Tetrandrine)、汉防己乙素(Fangchinoline)、小檗胺(Berbamine)和千金藤素(Cepharanthine)等的含量最高[12]。虽然苄基异喹啉类生物碱的类群庞大且复杂,但是它们的生物合成途径都起始于L-酪氨酸(L-tyrosine)[13]。L-酪氨酸经过间位羟基化、脱羧或转氨基等多步反应,生成前体物质多巴胺(Dopamine)和对羟基苯乙醛(4-hydroxyphenylacetaldehyde)[14]。二者经过去甲乌药碱合成酶(NCS)催化合成(S)-去甲乌药碱[(S)-Norcoclaurine][15]。(S)-去甲乌药碱在6-O-甲基转移酶(6OMT)和N-甲基转移酶(CNMT)的催化下依次生成乌药碱[(S)-Coclaurine]和N-甲基乌药碱[(S)-N-Methylcoclaurine][16-18]。而以N-甲基乌药碱为底物,在各种酶的催化下,可生成黄芦木碱(Berbamunine)、小檗胺、千金藤素、(S)-金黄紫堇碱[(S)-Scoulerine]、汉防己乙素和汉防己甲素等多种苄基异喹啉类生物碱[19-21](图 1)。
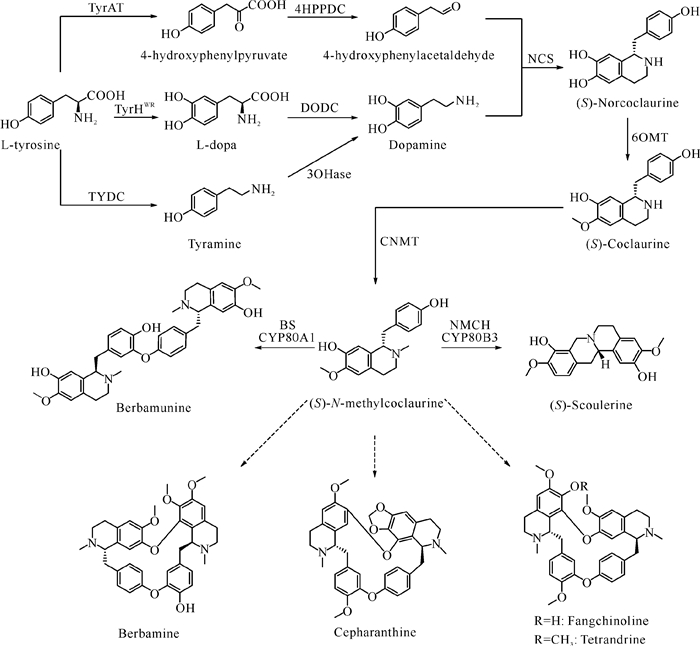
|
| 图 1 粉防己双苄基异喹啉生物碱的生物合成途径 Fig.1 Biosynthetic pathway of dibenzylisoquinoline alkaloids in S.tetrandra |
液质联用技术是中药质量研究领域的重要分析手段,以其强大的分离能力、极高的灵敏度,以及能够提供化合物定性和定量信息能力的优势,在植物代谢研究中起到非常重要的作用,具有广阔的应用前景[22, 23]。本研究利用超高效液相色谱-三重四极杆串联质谱(UPLC-QQQ-MS/MS)技术,在多反应监测(MRM)模式下,建立1种快速检测不同时空条件下粉防己根部样本中双苄基异喹啉生物碱代谢途径中系列化合物含量的方法,为解析汉防己甲素等双苄基异喹啉生物碱化合物分子合成机理提供代谢数据参考。
1 材料与方法 1.1 材料原产地为云南省昆明市,移植栽培于广西科学院实验大棚的粉防己。选取长势一致并具有良好代表性的粉防己植株,取其根部,用液氮速冻后放置于-80 ℃冰箱备用。
1.2 试剂乙腈、甲醇、甲酸(色谱纯,Themo Fisher公司,美国),甲酸铵(色谱纯,天津市科密欧化学试剂有限公司,中国),对照品:L-酪氨酸、L-多巴、酪胺、对羟基苯丙酮酸(4-hydroxyphenylpyruvate)、盐酸多巴胺、去甲乌药碱、乌药碱、N-甲基乌药碱、小檗胺、汉防己甲素和汉防己乙素[分析纯,阿拉丁试剂(上海)有限公司],千金藤素(色谱纯,成都普瑞法科技开发有限公司)。
1.3 仪器Agilent 1290型超高效液相色谱仪、Agilent 6470型三重四极杆串联质谱仪(Agilent Technologies公司,美国),真空冷冻干燥仪(SIM公司,美国),HGC-12A氮吹仪(天津市恒奥科技发展有限公司,中国),高通量研磨仪(宁波新芝生物科技股份有限公司,中国),超声波清洗器(深圳市深华泰超声洗净设备有限公司,中国),低温离心机(Eppendorf Innovation Company,德国),超纯水仪(ELGA LabWater公司,英国),鼓风干燥箱、涡旋混合器、电子天平等。
1.4 方法 1.4.1 样品前处理分别于2020年3月15日、2020年6月15日、2020年9月15日和2020年12月15日采集粉防己根部样品,依次编号为3月、6月、9月和12月,每批次3个生物学重复,经液氮速冻后放置于-80 ℃冰箱备用。参照Qiao等[24]的方法并适当改进,首先将-80 ℃保藏的样品放置于真空冷冻干燥仪脱水干燥72 h,然后采用高通量研磨仪进行研磨(频率60 Hz,时间1 min,批量研磨3次)。准确称取样品10 mg于2 mL离心管中,加入0.5 mL 70%(V/V)甲醇的水溶液,涡旋5 min,超声提取20 min,离心,转移上清液,重复萃取2次。合并萃取液并用氮吹仪干燥,用0.5 mL 70%(V/V)甲醇的水溶液复溶,用0.22 μm针式有机过滤器过滤并置于进样小瓶,上机检测。
1.4.2 对照品溶液的配制用电子天平分别精确称取12个对照品各2 mg,用甲醇溶解,分别配置成浓度为1 mg/mL的母液。精密移取对照品母液,用70%(V/V)的甲醇水溶液稀释成1 μg/mL的单标工作液用于UPLC-QQQ-MS/MS检测,以便建立化合物离子信息数据库。精密移取12个对照品母液并混合,用70%(V/V)的甲醇水溶液定容,制成1、5、10、50、100和500 μg/L,1、5、10和50 mg/L共10个浓度的混合对照品溶液。
1.4.3 超高效液相色谱条件色谱柱为Poroshell 120 CS-C18 (3.0 mm×150 mm,2.7 μm,Agilent),流动相为含0.1%甲酸的10 mmol/L甲酸铵水溶液(A)-乙腈(B),流速为0.3 mL/min,柱温为35 ℃,进样量5 μL,液相色谱梯度洗脱条件:0-1 min,95% A;1 -10 min,95% A→20% A;12-13 min,20% A→95% A;13-15 min,95% A→95% A。
1.4.4 质谱条件安捷伦喷射流技术离子源(AJS-ESI),正、负离子模式扫描,多反应监测。鞘气温度(Sheath gas temperature) 250 ℃;鞘气流速(Sheath gas flow) 11 L/min;喷嘴电压(Nozzle voltage) 500 V;雾化器(Nebulizer)压力35 psi;干燥器流速(Gas flow) 5 L/min;干燥器温度(Gas temperature) 300 ℃。
1.5 方法学考察 1.5.1 样品提取条件的优化根据1.4.1节的样品处理方法,对样品的提取溶剂进行考察和优化。王亚冬等[25]研究表明,超声温度对植物总生物碱的提取率具有重要的影响。超声温度由室温逐渐上升至60 ℃,生物碱类化合物随着温度的升高逐渐显示出不稳定性,甚至发生物质分解;而温度过高也会加速提取液的挥发,影响化合物的提取[25, 26]。因此,本研究的提取温度设定为30 ℃,超声60 min。另外,考察40%、50%、60%、70%、80%和90%等不同比例甲醇水溶液提取剂对粉防己根部样品主要化合物的提取率。从12种化合物中选择两种代表性的物质进行含量测定,其中酸类化合物考察对羟基苯丙酮酸,碱类化合物考察汉防己甲素。
1.5.2 色谱条件的优化采用Poroshell 120 CS-C18色谱柱,正、负离子多反应监测模式进行分离和测定,考察含0.1%甲酸的水-甲醇、含0.1%甲酸的水-乙腈和含0.1%甲酸的甲酸铵水溶液-乙腈3种不同流动相的分离效果。
1.5.3 质谱条件考察通过一级全扫(Full scan)及不同碰撞能下的二级数据,优化AJS-ESI参数。在全扫模式下确定适合的离子模式和母离子信息;在选择性离子监测(SIM)扫描模式下寻找母离子最优的电压;在子离子(Product ion)扫描模式下寻找子离子的信?ⅰMü齅RM扫描确定定性和定量的母离子-子离子最优的碰撞能,以获得最好的质谱响应。
1.5.4 线性关系考察取1.4.2节配制的混合对照品,在优化后的液相色谱/质谱检测条件下进行测定,以峰面积(y)为纵坐标,质量浓度(x)为横坐标绘制标准曲线,样品平行进样3次,峰面积取平均值进行计算,绘制12种化合物的标准曲线,得到每个化合物的线性回归方程和相关系数。实验以70%的甲醇作为空白对照。
1.5.5 检出限、定量限、精密度、稳定性、重复性考察以3倍信噪比检测得到的样品化合物最低浓度或者最小量作为方法的检出限(LOD);以10倍信噪比检测得到的样品化合物最低浓度或最小量作为方法的定量限(LOQ)[27, 28]。
精密吸取1.4.2节配制的混合对照品,按照优化后的液相色谱/质谱检测条件连续进样6次,记录12个物质对应的定量子离子总离子流图的峰面积,计算各自的相对标准偏差(RSD),考察仪器的精密度。
按1.4.1节的方法配制粉防己根部样品提取液,按照优化后的液相色谱/质谱检测条件,每隔3 h进样一次(0、3、6、9、12、15、18、21、24 h),记录各化合物定量子离子总离子流图的峰面积,计算各个化合物的RSD,考察仪器的稳定性[29]。
按1.4.1节的方法配制粉防己根部样品提取液,共10份,按照优化后的液相色谱/质谱检测条件进样测定,记录各化合物定量子离子总离子流图的峰面积,计算各个化合物的RSD以考察仪器的重复性。
1.6 样品测定按1.4.1节的方法配制3月、6月、9月和12月4个批次的粉防己根部样品提取液,按照优化后的液相色谱/质谱检测条件进样测试。
2 结果与分析 2.1 样品提取条件优化结果两类化合物的提取率如图 2所示,结果表明,采用70%的甲醇水溶液作为提取剂,两类化合物均获得最好的提取率。因此,本研究选取70%的甲醇水溶液作为提取剂。
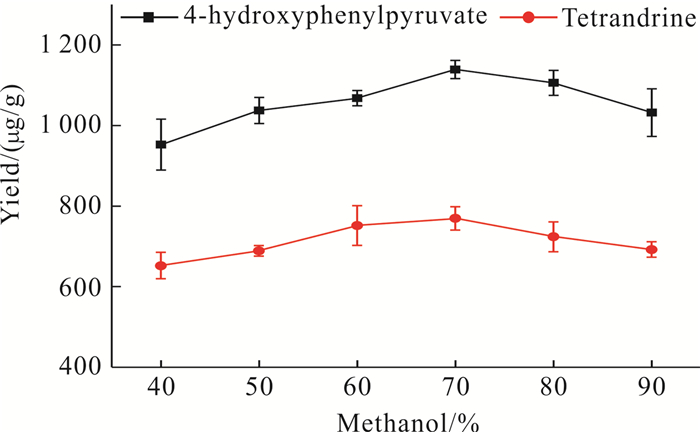
|
| 图 2 不同比例的甲醇水溶液对对羟基苯丙酮酸和汉防己甲素提取率的影响 Fig.2 Effect of different proportions of methanol water on the content of 4-hydroxyphenylpyruvate and tetrandrine |
2.2 色谱条件优化结果
实验结果显示,以含0.1%甲酸的水-甲醇作为流动相,洗脱能力差,出现信号峰粘连分不开的现象;以含0.1%甲酸的水-乙腈作为流动相,分离效果有所改善,但峰型较宽;而以含0.1%甲酸的甲酸铵水溶液-乙腈作为流动相,分离效果最好,峰型更加尖锐。本研究最终使用含0.1%甲酸的10 mmol/L甲酸铵水溶液-乙腈作为流动相,按照1.4.3节的梯度洗脱条件进行洗脱。12种化合物的混合对照品的总离子色谱图如图 3所示。

|
| (a) Total Ion Chromatogarms (TIC) of the mixed 12 compounds; (b) Zoom in TIC of each compound. 图 3 12种化合物的混合对照品的总离子色谱图 Fig.3 Total Ion Chromatogarms (TIC) of the mixed reference substances of 12 compounds |
2.3 质谱条件考察结果
12个对照品的子离子信息如图 4所示。MRM扫描结果表明对羟基苯丙酮酸在负离子模式下的响应较好,其他11种化合物在正离子模式下信号较好,因此选择电喷雾正、负离子模式检测。优化后对照品的质谱条件信息如表 1所示。

|
| 图 4 12个对照品的子离子信息及其对应的结构 Fig.4 Product ion information and corresponding structure of 12 reference substances |
| 化合物 Compound |
保留时间/min Retention time/min |
母离子([M+H]/[M-H]) Precursor ion ([M+H]/[M-H]) |
子离子(m/z) Product ion (m/z) |
碰撞能量/eV Collision energy/eV |
电压/V Fragmentor/V |
| L-tyrosine | 2.825 | 182.1 [M+H]+ | 136.0a | 15 | 95 |
| 123.1 | 20 | ||||
| L-dopa | 2.632 | 198.1 [M+H]+ | 152.0a | 12 | 95 |
| 107.0 | 30 | ||||
| Tyramine | 2.262 | 138.1 [M+H]+ | 121.2a | 10 | 70 |
| 103.0 | 25 | ||||
| 4-hydroxyphenylpyruvate | 8.596 | 179.1 [M-H]- | 92.1a | 25 | 75 |
| 102.1 | 15 | ||||
| Dopamine | 2.226 | 154.1 [M+H]+ | 137.1a | 10 | 85 |
| 119.1 | 20 | ||||
| (S)-Norcoclaurine | 5.037 | 272.2 [M+H]+ | 107.0a | 30 | 135 |
| 115.0 | 50 | ||||
| (S)-Coclaurine | 5.599 | 286.2 [M+H]+ | 107.0a | 30 | 140 |
| 115.0 | 50 | ||||
| (S)-N-Methylcoclaurine | 5.625 | 300.2 [M+H]+ | 107.0a | 30 | 122 |
| 269.2 | 20 | ||||
| Berbamine | 6.031 | 609.4 [M+H]+ | 381.0a | 45 | 255 |
| 174.0 | 65 | ||||
| Tetrandrine | 6.441 | 623.6 [M+H]+ | 381.3a | 50 | 240 |
| 191.2 | 65 | ||||
| Fangchinoline | 6.207 | 609.6 [M+H]+ | 367.3a | 45 | 240 |
| 192.2 | 60 | ||||
| Cepharanthine | 6.373 | 607.5 [M+H]+ | 174.1a | 66 | 245 |
| 365.2 | 46 | ||||
| Note: a represents product ions for quantification. | |||||
2.4 线性关系考察结果
12种化合物的线性回归方程和相关系数(R2)如表 2所示。结果表明,12种化合物对应回归方程的相关系数为0.992 11-0.999 95,在各自的线性范围内线性关系良好。
| 化合物 Compound |
线性范围/(ng/mL) Linear range/(ng/mL) |
线性回归方程 Linear regression equation |
相关系数R2 Correlation coefficient R2 |
| L-tyrosine | 20-2 000 | y=1.688883x+561.212613 | 0.992 11 |
| L-dopa | 50-5 000 | y=0.757144x+1499.362000 | 0.995 30 |
| Tyramine | 100-50 000 | y=376.074389x+575796.277178 | 0.994 81 |
| 4-hydroxyphenylpyruvate | 5 000-50 000 | y=0.009709x-5.128076 | 0.998 77 |
| Dopamine | 5-5 000 | y=798.983982x-9882.775298 | 0.999 81 |
| (S)-Norcoclaurine | 1-100 | y=7140.551085x+7960.771956 | 0.999 93 |
| (S)-Coclaurine | 1-100 | y=6823.289602x+37538.024595 | 0.999 13 |
| (S)-N-Methylcoclaurine | 1-100 | y=14387.055804x+16759.953424 | 0.999 28 |
| Berbamine | 5-5 000 | y=111.028462x-5649.540585 | 0.999 05 |
| Tetrandrine | 5-5 000 | y=274.965830x-8983.571788 | 0.999 76 |
| Fangchinoline | 5-5 000 | y=348.160119x-9980.891032 | 0.999 89 |
| Cepharanthine | 5-5 000 | y=177.664218x-2720.457202 | 0.999 95 |
2.5 检出限、定量限、精密度、稳定性、重复性考察结果
如表 3所示,对羟基苯丙酮酸的检出限和定量限相对较高,分别为44.95 ng/mL和149.84 ng/mL;而其他11种化合物的检出限和定量限分别为0.04-4.38 ng/mL和0.13-14.60 ng/mL。12种化合物精密度RSD为0.65%-7.03%,说明测定仪器的精密度良好。粉防己根部各化合物的稳定性RSD为1.55%-6.67%,说明供试品溶液(粉防己根部样品提取液)在24 h内稳定。12种化合物的重复性RSD为1.65%-7.47%,说明重复性良好,实验结果均满足定量分析要求。
| 化合物 Compound |
检出限/(ng/mL) Detection limit/(ng/mL) |
定量限/(ng/mL) Quantification limit/(ng/mL) |
精密度RSD/% RSD of precision/% |
稳定性RSD/% RSD of stability/% |
重复性RSD/% RSD of repeatability/% |
| L-tyrosine | 1.66 | 5.54 | 7.03 | 2.94 | 6.62 |
| L-dopa | 4.38 | 14.60 | 5.62 | 3.21 | 5.40 |
| Tyramine | 1.35 | 4.50 | 1.08 | 5.90 | 3.69 |
| 4-hydroxyphenylpyruvate | 44.95 | 149.84 | 5.54 | 6.67 | 5.31 |
| Dopamine | 0.25 | 0.82 | 1.64 | 3.24 | 6.72 |
| (S)-Norcoclaurine | 0.06 | 0.20 | 1.49 | 2.05 | 1.65 |
| (S)-Coclaurine | 0.04 | 0.13 | 2.84 | 4.12 | 3.76 |
| (S)-N-Methylcoclaurine | 0.06 | 0.21 | 1.88 | 2.69 | 7.47 |
| Berbamine | 0.82 | 2.74 | 3.68 | 1.81 | 4.72 |
| Tetrandrine | 0.18 | 0.59 | 1.54 | 2.53 | 2.75 |
| Fangchinoline | 0.13 | 0.44 | 0.65 | 1.55 | 3.03 |
| Cepharanthine | 1.78 | 5.95 | 1.59 | 3.75 | 1.72 |
2.6 样品测定结果
对比混合对照品溶液和粉防己根部样品提取液的UPLC-QQQ-MS/MS色谱图(图 5),根据液相色谱共有峰并结合质谱数据对粉防己根部样品提取液中的化学成分进行定性分析。实验结果表明,粉防己根部样品提取液中准确包含所研究的12种化学成分。
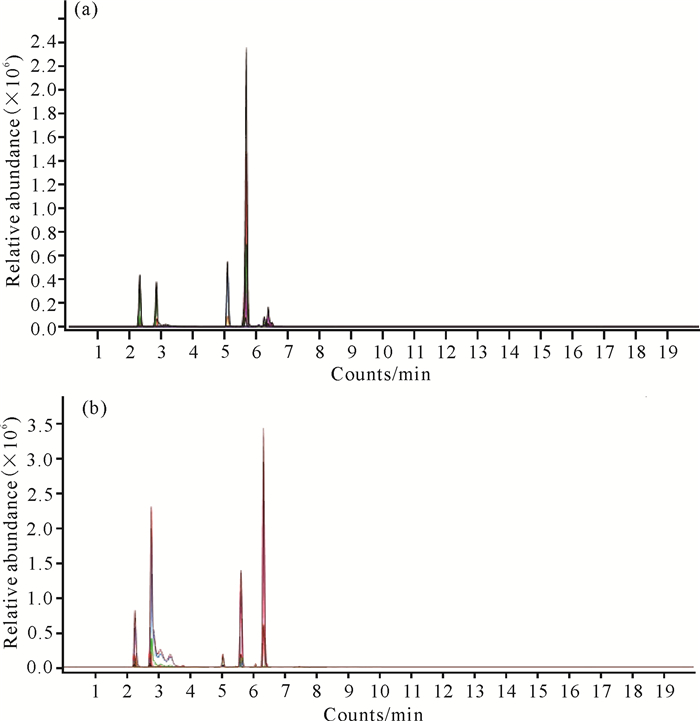
|
| (a) Mixed control solution; (b) Extract solution of S.tetrandra. 图 5 混合对照品溶液和粉防己根部样品提取液的UPLC-QQQ-MS/MS色谱图 Fig.5 UPLC-QQQ-MS/MS chromatogram of mixed reference solution and extract solution of the root of S.tetrandra |
基于相对保留时间和定量子离子总离子流图的峰面积对粉防己根部样品提取液的12种化学成分进行含量分析。实验结果如图 6所示,粉防己根部样品中酪胺、对羟基苯丙酮酸、汉防己甲素和L-酪氨酸的含量相对较高,均在1 500 μg/g以上;而汉防己乙素、多巴胺、小檗胺和千金藤素的含量次之,它们的含量为100-500 μg/g;L-多巴、去甲乌药碱和乌药碱的含量相对较低,均在50 μg/g以下;在所有测试的化合物中,N-甲基乌药碱含量最少,在1 μg/g以下。N-甲基乌药碱是合成多种苄基异喹啉生物碱的重要前体物质,其含量较低可能与其较高的生物合成利用率或者代谢速率有关。实验测试得到的小檗胺、汉防己甲素、汉防己乙素和千金藤素在粉防己根中的含量与吴梦丽等[30]、杨帆等[31]的研究结果基本一致。此外,随着月份的增加,L-酪氨酸、去甲乌药碱和汉防己乙素的含量都有明显的增加趋势;而酪胺、L-多巴和千金藤素的含量则随着月份的增加而减少;多巴胺的含量随着月份的增加出现先增后减的趋势,而小檗胺的含量随着月份的增加则显示出先减后增的趋势。总之,研究结果表明,粉防己根部各主要活性成分的含量存在着显著的差异,同一化学物质的含量在不同的采集月份也有着明显的差异。
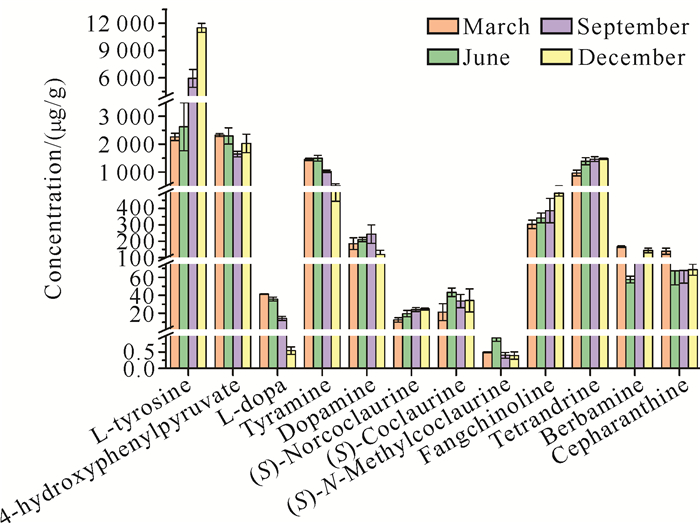
|
| 图 6 粉防己根12种化合物在不同采集月份的含量变化 Fig.6 Content variations of 12 compounds in root of S.tetrandra from different collection month |
3 结论
本研究通过超高效液相色谱-三重四极杆串联质谱仪快速测定粉防己在不同采集时期各代谢化合物的含量变化,建立了同时、高效、定量检测粉防己根中双苄基异喹啉生物碱代谢途径中潜在的12种化合物的液相色谱、质谱检测条件。对3月、6月、9月和12月4个不同批次采集的粉防己根部样品的主要活性物质的测定结果表明,粉防己根中12种不同化合物的含量具有显著差异,在不同的采集月份同一活性物质呈现出动态变化规律。
| [1] |
胡世林. 防己的本草考证[J]. 现代药物与临床, 2009, 24(5): 286-288. |
| [2] |
刘嘉琪, 张雅男, 赵婉, 等. 粉防己化学成分及药理学研究进展[J]. 中医药学报, 2017, 45(3): 100-103. DOI:10.3969/j.issn.1002-2392.2017.03.032 |
| [3] |
杨敬, 朱安祥, 胡军, 等. 粉防己碱的作用机制研究进展[J]. 国际中医中药杂志, 2018, 40(3): 286-289. DOI:10.3760/cma.j.issn.1673-4246.2018.03.025 |
| [4] |
MEI L F, CHEN Y C, WANG Z M, et al. Synergistic anti-tumour effects of tetrandrine and chloroquine combination therapy in human cancer: a potential antagonistic role for p21[J]. British Journal of Pharmacology, 2015, 172(9): 2232-2245. DOI:10.1111/bph.13045 |
| [5] |
殷华芳, 钱晓萍, 刘宝瑞. 汉防己甲素抗肿瘤机制研究进展[J]. 现代肿瘤医学, 2011, 19(3): 582-584. |
| [6] |
QIAN X P, YAN B, ZHOU X F, et al. Synergistic antiangiogenic activity of tetrandrine combined with endostar on the human umbilical vein endothelial cell model[J]. Cancer Biotherapy and Radiopharmaceuticals, 2013, 28(5): 385-390. DOI:10.1089/cbr.2012.1331 |
| [7] |
陈银. 汉防己甲素防治放射性肺纤维化的实验研究[D]. 南京: 南京中医药大学, 2017.
|
| [8] |
BELLIK Y, BOUKRAÂ L, ALZAHRANI H A, et al. Molecular mechanism underlying anti-inflammatory and anti-allergic activities of phytochemicals: an update[J]. Molecules, 2013, 18(1): 322-353. |
| [9] |
SHARECK J, NANTEL A, BELHUMEUR P. Conjugated linoleic acid inhibits hyphal growth in Candida albicans by modulating Ras1p cellular levels and downregulating TEC1 expression[J]. Eukaryotic Cell, 2011, 10(4): 565-577. DOI:10.1128/EC.00305-10 |
| [10] |
ASKOURA M, MOTTAWEA W, ABUJAMEL T, et al. Efflux pump inhibitors (EPIs) as new antimicrobial agents against Pseudomonas aeruginosa[J]. Libyan Journal of Medicine, 2011, 6(5870): 1-8. |
| [11] |
李行诺, 闫海霞, 沙娜, 等. 粉防己生物碱化学成分的分离与鉴定[J]. 沈阳药科大学学报, 2009, 26(6): 430-433. |
| [12] |
魏江存, 魏中璇, 谢臻, 等. 防己科植物化学成分及其药理作用研究进展[J]. 湖北农业科学, 2019, 58(20): 5-8, 20. |
| [13] |
NARCROSS L, FOSSATI E, BOURGEOIS L, et al. Microbial factories for the production of benzylisoquinoline alkaloids[J]. Trends in Biotechnology, 2016, 34(3): 228-241. DOI:10.1016/j.tibtech.2015.12.005 |
| [14] |
SCHENCK C A, MAEDA H A. Tyrosine biosynthesis, metabolism, and catabolism in plants[J]. Phytochemistry, 2018, 149(28): 82-102. |
| [15] |
MORRIS J S, FACCHINI P J. Molecular origins of functional diversity in benzylisoquinoline alkaloid methyltransferases[J]. Frontiers in Plant Science, 2019, 10: 1058. DOI:10.3389/fpls.2019.01058 |
| [16] |
SINGH A, MENÉNDEZ-PERDOMO I M, FACCHINI P J. Benzylisoquinoline alkaloid biosynthesis in opium poppy: an update[J]. Phytochemistry Reviews, 2019, 18(6): 1457-1482. DOI:10.1007/s11101-019-09644-w |
| [17] |
HAGEL J M, BEAUDOIN G A W, FOSSATI E, et al. Characterization of a flavoprotein oxidase from opium poppy catalyzing the final steps in sanguinarine and papaverine biosynthesis[J]. Journal of Biological Chemistry, 2012, 287(51): 42972-42983. DOI:10.1074/jbc.M112.420414 |
| [18] |
AGARWAL P, PATHAK S, KUMAR R S, et al. 3'O-methyltransferase, Ps3'OMT, from opium poppy: involvement in papaverine biosynthesis[J]. Plant Cell Reports, 2019, 38(10): 1235-1248. DOI:10.1007/s00299-019-02439-5 |
| [19] |
BHAKUKI D S, JAIN S, SINGH A N. Biosynthesis of the bisbenzylisoquinoline alkaloid, tetrandiine[J]. Phytochemistry, 1980, 11(19): 2347-2350. |
| [20] |
KRAUS P F X, KUTCHAN T M. Molecular cloning and heterologous expression of a cDNA encoding berbamunine synthase, a C-O phenol-coupling cytochrome P450 from the higher plant Berberis stolonifera[J]. Proceedings of the National Academy of Sciences of the United States of America, 1995, 92(6): 2071-2075. |
| [21] |
BHAGYA N, CHANDRASHEKAR K R. Tetrandrine: a molecule of wide bioactivity[J]. Phytochemistry, 2016, 125(16): 5-13. |
| [22] |
WEI J X, FANG L L, LIANG X L, et al. A sensitive and selective UPLC-MS/MS method for simultaneous determination of 10 alkaloids from Rhizoma Menispermi in rat plasma and its application to a pharmacokinetic study[J]. Talanta, 2015, 144(15): 662-670. |
| [23] |
LIANG X F, XIANG Y N, LI Y L, et al. A rapid method for simultaneous quantification of berberine, berbamine, magnoflorine and berberrubine in mouse serum using UPLC-MS/MS[J]. Journal of Chromatography B, 2020, 1142(29): 122040. |
| [24] |
QIAO J, LUO Z L, GU Z, et al. Identification of a novel specific cucurbitadienol synthase allele in Siraitia grosvenorii correlates with high catalytic efficiency[J]. Molecules, 2019, 24(3): 627. |
| [25] |
王亚冬, 李秀梅, 潘方方, 等. 两种药食同源植物总生物碱的提取及其抗氧化作用[J]. 食品研究与开发, 2020, 41(5): 73-80. |
| [26] |
VILLATE A, SAN NICOLAS M, GALLASTEGI M, et al. Review: metabolomics as a prediction tool for plants performance under environmental stress[J]. Plant Science, 2021, 303: 110789. |
| [27] |
姜冰, 丁涛, 曹崇江, 等. HPLC-MS/MS法同时测定动物源性食品中9种吡咯里西啶类生物碱的含量[J]. 分析测试学报, 2020, 39(4): 473-478. |
| [28] |
柴玲, 刘布鸣, 徐远金, 等. 基于UPLC-MS/MS的蒽贝素血药浓度测定及其在大鼠体内药动学研究[J]. 广西科学, 2020, 27(4): 418-424. |
| [29] |
杨帆, 吴梦丽, 高慧, 等. 高效液相色谱法同时测定防己药材中粉防己碱和防己诺林碱含量[J]. 南方农业学报, 2019, 50(11): 2545-2551. |
| [30] |
吴梦丽, 何志鹏, 白燕远, 等. 基于UPLC指纹图谱的防己不同部位化学成分差异分析[J]. 中草药, 2020, 51(23): 6077-6083. |
| [31] |
杨帆, 黄旭, 吴梦丽, 等. 防己薄层鉴别法优化及不同部位化学成分差异分析[J]. 广西中医药大学学报, 2019, 22(2): 45-48. |



