作为最重要的初级生产者,浮游植物在海洋生态系统的生物群落结构、地球化学物质循环以及能量流动中均发挥着巨大的作用[1, 2],因此开展影响浮游植物群落结构组成与动态变化的相关研究是海洋生态学的基础内容之一。种间竞争是影响生物群落结构重组的主要因素之一,通常可分为利用性竞争和干扰性竞争两大类[3]。化感作用是一种常见的干扰性竞争,是发生于植物或微生物之间的一种相互作用,即在其生长发育过程中,植物或微生物将代谢产生的某些化学物质分泌到环境中,从而影响自身和其他生物的生长代谢[4]。研究表明,水体中的浮游植物不但受到高等植物产生的化感物质的影响,而且藻类之间也普遍存在化感竞争[5, 6],化感作用在浮游生物群落演替与藻类竞争中发挥着重要作用。
北部湾位于南海的西北部,曾有“中国目前最洁净的海湾”之称[7],过去该海湾的赤潮灾害远少于东部发达地区海域。然而,近年来随着沿海经济的快速增长,北部湾近岸海域的生态环境退化问题日益严重,海域水体富营养化情况呈增长趋势[8, 9],这也导致了近十年来该海域赤潮暴发的次数明显增多[10]。研究表明,相对于2002-2011年,2012-2021年北部湾海域赤潮发生的面积增加了近20倍,其间引发赤潮次数最多的生物种类是球形棕囊藻(Phaeocystis globosa)[11]。球形棕囊藻自2011年开始频繁地在北部湾海域引起赤潮,成为该海域赤潮的主要种类,其次是夜光藻(Noctiluca scintillans)、水华微囊藻(Microcystis flosaquae)和红海束毛藻(Trichodesmium erythaeum),而近10年不断有新的赤潮藻种出现[11],如2016年5月在北部湾钦州海域发生面积约为20 km2的红色赤潮藻(Akashiwo sanguinea)赤潮[12],而该藻也成为北部湾海域的赤潮新记录种类。红色赤潮藻,曾被命名为红色裸甲藻(Gymnodinium sanguineum),是一种细胞较大,广温、广盐、广布的裸甲藻。该藻是一种混合营养型甲藻,兼具光合自养和异养能力。红色赤潮藻在世界各水域均有造成严重的赤潮事件的记录,包括欧洲、北美、南美、亚洲(日本和中国)等[13]。红色赤潮藻在中国近海暴发赤潮的频率和范围不断增加,在浙江南麂列岛[14]、山东烟台[15]、福建同安[16]和广东深圳[17]等沿海水域均有大量该藻赤潮事件的报道。Xu等[18]研究发现,不同地理来源株系的红色赤潮藻对鲻(Mugil cephalus)、凡纳滨对虾(Litopenaeus vannamei)、文蛤(Meretrix meretrix)等均有不同程度的毒害效应,即该藻株对海洋动物的毒性有明显的株系差异。关于红色赤潮藻对其他浮游植物的化感作用研究较少,黄博珠[19]研究发现红色赤潮藻能够抑制共存浮游植物的生长, 包括红胞藻(Rhodomonas salina)、锥状斯氏藻(Scrippsiella trochoidea)和球形棕囊藻,且抑制率随着红色赤潮藻细胞密度的上升而提高,但红色赤潮藻对海洋原甲藻(Prorocentrum micans)无影响,且其对上述3种浮游植物的抑制作用也具有株系差异。在对深圳大鹏湾一次球形棕囊藻藻华发生过程的研究中,刘悦等[20]发现球形棕囊藻赤潮随着红色赤潮藻赤潮的出现而消退,因此认为红色赤潮藻赤潮是球形棕囊藻赤潮消亡的原因。但两者之间的相互影响关系尚不明确,北部湾海域的红色赤潮藻是否也对该海域的球形棕囊藻具有化感抑制作用有待进一步研究。
综上所述,为探讨北部湾株系的红色赤潮藻对该海域的球形棕囊藻生长是否具有化感抑制作用,本研究以红色赤潮藻北部湾株(以下简称“红色赤潮藻”)以及球形棕囊藻北部湾株(以下简称“球形棕囊藻”)为实验材料,研究红色赤潮藻对球形棕囊藻的化感作用及作用方式,为自然海域中浮游植物种群演替研究以及球形棕囊藻赤潮的治理研究提供理论依据。
1 材料与方法 1.1 实验藻种实验所用的球形棕囊藻和红色赤潮藻均分离自钦州湾海域,保存于广西科学院北部湾海洋研究中心赤潮藻种质资源库,编号分别为BBW PG-02和BBG 9002。
1.2 方法 1.2.1 红色赤潮藻对不同密度球形棕囊藻生长的影响实验开始前,取处于指数生长期末期、生长状态良好的球形棕囊藻和红色赤潮藻各1瓶,并计算细胞密度,为了使各培养组中的密度均匀,球形棕囊藻先用10 μm滤膜过滤获得以游离单细胞为主的藻液再进行计数。根据表 1设置红色赤潮藻和球形棕囊藻的起始密度,并分别标记为Test A、Test B、Test C、Control AS和Control PG (表 1),每组设置3个平行。培养温度为(20±1) ℃,光照强度约2 500 lx,光暗比为12 h∶12 h。每天取样进行细胞计数,实验开始当天记为第0天。
| 实验组 Experimental groups |
起始密度/(cells/L) Initial density/(cells/L) |
|
| 红色赤潮藻 A.sanguinea |
球形棕囊藻 P.globosa |
|
| Test A | 5×105 | 2×106 |
| Test B | 5×105 | 1×106 |
| Test C | 5×105 | 5×105 |
| Control AS | 5×105 | 0 |
| Control PG | 0 | 1×106 |
1.2.2 红色赤潮藻对球形棕囊藻的化感作用方式
实验所用的球形棕囊藻和红色赤潮藻前处理操作(过滤及计数)同1.2.1节所述。设置4组实验,Test 1、Test 2、Test 3及对照组Con PG,其中4组球形棕囊藻细胞密度均为1×107 cells/L,Test 1为加入红色赤潮藻的完整细胞培养液和球形棕囊藻共培养,红色赤潮藻密度为5×105 cells/L;Test 2为加入与Test 1中所用红色赤潮藻培养液等体积的无细胞滤液,滤液为用3 μm滤膜在自然重力作用下(即非负压抽滤)过滤红色赤潮藻培养液去除细胞所得;在Test 3中加入与Test 1、Test 2等体积的红色赤潮藻藻液超声破碎液,超声条件为在冰浴条件下250 W、转3 s停2 s破碎藻液30 min,并镜检无红色赤潮藻完整细胞方可使用;对照组Con PG为添加等体积的f/2培养基。以上每组实验设置3个平行,培养条件同1.2.1节所述。每天取样进行细胞计数,实验开始当天记为第0天。
1.3 细胞计数取1.0 mL摇匀后的培养液于1.5 mL离心管中,加入20 μL鲁哥氏碘液进行固定,用移液枪轻轻吹打混匀后,取0.1 mL于100 μL浮游植物计数框中进行藻细胞计数。
1.4 数据处理与分析采用SigmaPlot 12.5绘制图片,使用SPSS 13.0分析显著性。
2 结果与分析 2.1 混合培养条件下红色赤潮藻和球形棕囊藻的相互影响与对照组(Control AS组)相比,在与不同密度的球形棕囊藻混合培养条件下,红色赤潮藻生长情况无明显差异(图 1)。由于起始培养密度较高,4组实验的红色赤潮藻均无明显生长延滞期,在第2天即进入指数生长期。在第4天达到稳定期时,Test A、Test B、Test C以及Control AS中红色赤潮藻的细胞密度平均值分别为(3.07±0.22)×106、(2.70±0.26)×106、(2.86±0.25)×106和(2.88±0.30)×106 cells/L。SPSS分析结果表明,除了在第5天Test C组的红色赤潮藻密度显著高于Test A和Control AS组(P < 0.05),以及第7天Test A组显著高于Control AS组(P < 0.05)外,在整个培养过程中,4个实验组的红色赤潮藻密度均无显著差异(P>0.05)。

|
| 图 1 不同密度比例混合培养条件下红色赤潮藻的生长曲线 Fig.1 Growth curves of A.sanguinea under mixed culture conditions with different density ratios |
与对照组(Control PG组)相比,混合培养条件下的球形棕囊藻细胞生长受到明显抑制(图 2)。球形棕囊藻的细胞密度随着其所占比值的降低而减小,Control PG组的细胞密度在第5天达到最大值,为(39.4±8.3)×107 cells/L,Test A、Test B、Test C的细胞密度最大值分别为(17.3±2.5)×107 cells/L(第4天)、(11.9±1.4)×107 cells/L(第3天)、(11.4±0.3)×107 cells/L (第5天)。第5-10天,Control PG组的球形棕囊藻细胞密度均显著高于其余3组(P < 0.01)。Test A和Test B的细胞密度在实验末期(第10天)有小幅度的增加,细胞平均密度分别由第9天的(9.8±0.3)×107、(7.9±0.7)×107 cells/L增加至(14.8±1.8)×107、(11.3±0.2)×107 cells/L。
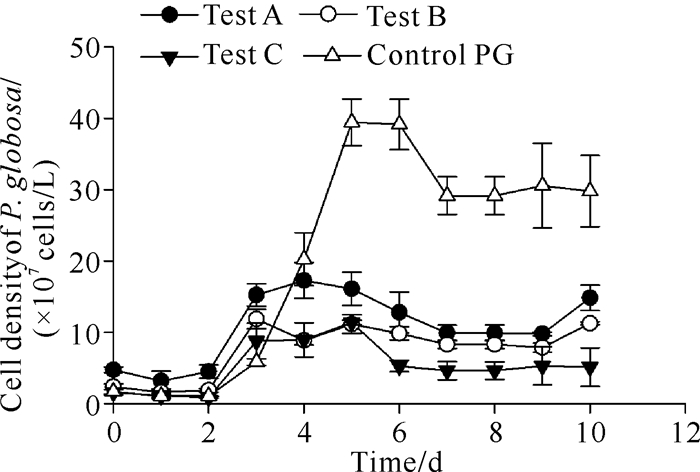
|
| 图 2 不同密度比例混合培养条件下球形棕囊藻的生长曲线 Fig.2 Growth curves of P.globosa under mixed culture conditions with different density ratios |
2.2 红色赤潮藻对球形棕囊藻的化感作用机制
即使混合培养中的球形棕囊藻细胞密度提高到1×107 cells/L (球形棕囊藻赤潮密度阈值),其生长仍受到明显的影响,而红色赤潮藻生长不受球形棕囊藻影响(图 3,Test 1)。此外,在添加了红色赤潮藻的无细胞滤液(Test 2)和藻液超声破碎液(Test 3)的培养组中,球形棕囊藻的细胞生长也受到显著抑制。在第3-5天,添加红色赤潮藻不同组分的实验组,球形棕囊藻细胞密度均比对照组(Con PG组)高;而从第7天开始,对照组的密度显著高于3个实验组(P < 0.01)。在整个实验过程中对照组、Test 1、Test 2、Test 3组球形棕囊藻的细胞密度最大值分别为(86.1±6.2)×107 cells/L(第12天)、(19.4±3.7)×107 cells/L(第4天)、(22.9±0.4)×107 cells/L(第5天)和(29.1±3.0)×107 cells/L (第4天)。在第4-7天,Test 1组的球形棕囊藻密度明显低于Test 2和Test 3,但在实验后期(第11-14天)其密度略高于后两组,而Test 2的生长曲线在整个实验周期中基本介于Test 1和Test 3之间。

|
| 图 3 红色赤潮藻不同组分对球形棕囊藻生长的影响 Fig.3 Growth curves of P.globosa under mixed culture conditions with different components of A.sanguinea |
3 讨论
红色赤潮藻和球形棕囊藻都是我国近岸海域频繁引发赤潮的原因种,在北部湾海域,红色赤潮藻是近几年才出现的赤潮新纪录种类,而球形棕囊藻是近十年来在该海域多次发生赤潮的种类。黄博珠[19]研究表明,红色赤潮藻的不同株系对共存浮游植物表现出不一样的毒性效应,其中大亚湾JX14株系的细胞毒素粗提液能够导致球形棕囊藻细胞的裂解,同时认为有毒物质不仅存在于红色赤潮藻细胞内,而且也能够分泌到细胞外部起作用。北部湾的红色赤潮藻研究较少,目前仅有关于其种类鉴定的报道[21],关于该海域株系的红色赤潮藻对其他浮游植物的影响尚缺乏研究。
本研究的混合培养结果表明红色赤潮藻的生长不受球形棕囊藻细胞密度的影响(图 1),但红色赤潮藻抑制了球形棕囊藻生长(图 2),说明红色赤潮藻对球形棕囊藻表现出抑制生长的化感作用,即红色赤潮藻可产生能抑制球形棕囊藻生长的化学物质。由于浮游植物的化感作用强弱与具有化感作用的宿主、目标藻相对密度有关,通常宿主的藻密度越高,目标藻的藻密度越低,化感作用就越强[6, 22]。通过保持红色赤潮藻的密度不变(5×105 cells/L),将球形棕囊藻赤潮密度从5×105 cells/L调整至2×106 cells/L,红色赤潮藻的抑制作用随着球形棕囊藻密度的增加而减弱(图 2)。
海洋浮游植物的化感物质可以直接分泌至海水中,也可以通过藻细胞间的接触而相互影响。为了探索红色赤潮藻对球形棕囊藻的作用机制,本研究开展了红色赤潮藻不同组分对球形棕囊藻生长的影响,结果显示除了完整细胞培养液外,其无细胞滤液以及藻液超声破碎液也都显著抑制球形棕囊藻的生长,抑制强弱顺序为完整细胞培养液>无细胞滤液>藻液超声破碎液(图 3,第4-7天),说明此化学物质主要是释放到细胞外发挥作用,也可以通过细胞直接接触而起作用。由于红色赤潮藻是一种混合营养型甲藻,它不仅可以光合自养,而且还可以摄食其他微型生物,现有研究表明该藻可以摄食寡毛类纤毛虫[23]、聚球藻(Synechococcus sp.)[24]、中肋骨条藻(Skeletonema costatum)[25]等,所以完整细胞培养液实验组中的球形棕囊藻细胞密度低于藻液超声破碎液组和无细胞滤液组,可能是红色赤潮藻细胞摄食球形棕囊藻导致的。藻液超声破碎液的抑制作用小于其他两组,推测可能是超声破碎过程降低了这种化感物质的活性。Wang等[6]研究表明水体中的化感作用具有时效性,如在三角褐指藻(Phaeodactylum tricornutum)的无细胞滤液中加入赤潮异弯藻(Heterosigma akashiwo)进行混合培养时,后者细胞在实验初期大量死亡和裂解,生长受到显著抑制,但后期又恢复正常生长,这可能是由于滤液中化感物质发生了降解。在本研究中,球形棕囊藻细胞密度在实验末期也具有增长的趋势(图 2、3),一方面说明红色赤潮藻对球形棕囊藻生长的抑制作用可能具有时效性,另一方面也可能是后期培养液中的营养盐浓度较低,球形棕囊藻依靠其微小的细胞在竞争中处于优势。特别的是,实验前期各处理组的球形棕囊藻细胞均高于对照组(图 2、3),一方面可能是竞争者或其化感作用的出现对球形棕囊藻的生长产生了瞬时促进作用,另一方面也可能是抑制效应需要一定的时间才能起作用,本研究结果表明红色赤潮藻对球形棕囊藻的抑制效应在混合培养四至五天后逐渐增强。
植物或者微生物分泌的化感物质主要成分多种多样,主要有脂肪族化合物、脂肪酸、萜类化合物以及各种芳香族化合物[26]。目前对红色赤潮藻的化感物质尚未见报道,今后可开展相关研究,既可以补充对此种典型赤潮藻类的认识,又可以为浮游植物间的相互作用机理以及赤潮的治理提供参考依据。
4 结论混合培养实验表明红色赤潮藻对球形棕囊藻的生长具有显著的抑制性化感作用,且抑制作用随着球形棕囊藻相对密度的降低而增强。红色赤潮藻的化感物质主要分泌于细胞外发挥作用,另外细胞直接接触也会发挥抑制效应。本研究结果为我国近岸海域两种典型赤潮藻类的相互影响关系,以及浮游植物群落演替机制研究提供了参考依据。
| [1] |
AZAM F, MALFATTI F. Microbial structuring of marine ecosystems[J]. Nature Reviews Microbiology, 2007, 5(10): 782-791. DOI:10.1038/nrmicro1747 |
| [2] |
POMEROY L R, LEB WILLIAMS P J, AZAM F, et al. The microbial loop[J]. Oceanography, 2007, 20(2): 28-33. DOI:10.5670/oceanog.2007.45 |
| [3] |
尹思成, 马逸驰, 王先云, 等. 3种淡水微藻相互间化感作用的实验研究[J]. 生态毒理学报, 2020, 15(6): 223-233. |
| [4] |
RICE E L. Allelopathy: an update[J]. The Botanical Review, 1979, 45(1): 15-109. DOI:10.1007/BF02869951 |
| [5] |
杨翠云, 赵娜娜, 夏传海, 等. 海洋卡盾藻无细胞滤液对赤潮微藻的作用及其与微藻的共培养[J]. 海洋环境科学, 2011, 30(6): 798-803. |
| [6] |
WANG R, XUE Q, WANG J, et al. Competitive interactions between two allelopathic algal species: Heterosigma akashiwo and Phaeodactylum tricornutum[J]. Marine Biology Research, 2020, 16(1): 32-43. DOI:10.1080/17451000.2019.1702213 |
| [7] |
今牛, 苏伟. 北部湾中国目前最洁净的海湾[J]. 沿海环境, 1999(1): 10-11. |
| [8] |
LAO Q, LIU G, SHEN Y, et al. Biogeochemical processes and eutrophication status of nutrients in the northern Beibu Gulf, South China[J]. Journal of Earth System Science, 2021, 130(4): 199. DOI:10.1007/s12040-021-01706-y |
| [9] |
姜宁. 广西北部湾海域赤潮演变趋势分析及其防控思路[J]. 海洋开发与管理, 2019, 36(11): 82-85. |
| [10] |
劳齐斌, 刘国强, 申友利, 等. 北部湾入海河流营养盐的分布特征及入海通量研究[J]. 海洋学报(中文版), 2020, 42(12): 93-100. |
| [11] |
粟启仲, 雷学铁, 刘国强, 等. 广西北部湾近岸海域近20年赤潮灾害特征分析[J]. 广西科学, 2022, 29(3): 552-557. |
| [12] |
广西壮族自治区海洋局. 2016年广西壮族自治区海洋环境质量公报[EB/OL]. (2017-06-26)[2023-11-21]. http://hyj.gxzf.gov.cn/zwgk_66846/hygb_66897/hyhjzlgb/t7201863.shtml.
|
| [13] |
丁西飞. 混合营养型甲藻: 红色赤潮藻对水生动物的毒性效应研究[D]. 广州: 暨南大学, 2018.
|
| [14] |
王金辉, 秦玉涛, 李志恩, 等. 南麂列岛自然保护区海域红色裸甲藻赤潮及其成因分析[J]. 海洋科学, 2005, 29(2): 32-36. |
| [15] |
刘义豪, 宋秀凯, 靳洋, 等. 一次陆源降雨污水引起血红哈卡藻赤潮的成因[J]. 生态学报, 2012, 32(15): 4836-4843. |
| [16] |
陈国斌. 厦门同安湾海域血红哈卡藻赤潮前的自动监测研究[J]. 海洋环境科学, 2012, 31(3): 391-394. |
| [17] |
马方方, 郭翔宇, 徐丽君, 等. 深圳海域红色赤潮藻赤潮在线监测数据变化及其成因分析[J]. 海洋技术学报, 2018, 37(4): 54-61. |
| [18] |
XU N, WANG M, TANG Y Z, et al. Acute toxicity of the cosmopolitan bloom-forming dinoflagellate Akashiwo sanguinea to finfish, shellfish, and zooplankton[J]. Aquatic Microbial Ecology, 2017, 80(3): 209-222. DOI:10.3354/ame01846 |
| [19] |
黄博珠. 混合营养型甲藻红色赤潮藻对共存浮游植物的毒性效应[D]. 广州: 暨南大学, 2016.
|
| [20] |
刘悦, 李丽, 翟晓辉, 等. 深圳大鹏湾一次球形棕囊藻藻华的发生过程及成因分析[J]. 热带海洋学报, 2022, 41(3): 164-171. |
| [21] |
徐轶肖, 何喜林, 张腾, 等. 北部湾涠洲岛红色赤潮藻的分子鉴定[J]. 海洋科学, 2020, 44(9): 63-73. |
| [22] |
MAO X T, XU R X, GAO Y, et al. Allelopathy of Alexandrium pacificum on Thalassiosira pseudonana in laboratory cultures[J]. Ecotoxicology and Environmental Safety, 2021, 215: 112123. DOI:10.1016/j.ecoenv.2021.112123 |
| [23] |
BOCKSTAHLER K R, COATS D W. Grazing of the mixotrophic dinoflagellate Gymnodinium sanguineum on ciliate populations of Chesapeake Bay[J]. Marine Biology, 1993, 116(3): 477-487. DOI:10.1007/BF00350065 |
| [24] |
JEONG H J, YOO Y D, SEONG K A, et al. Feeding by the mixotrophic red-tide dinoflagellate Gonyaulax polygramma: mechanisms, prey species, effects of prey concentration, and grazing impact[J]. Aquatic Microbial Ecology, 2005, 38(3): 249-257. |
| [25] |
YOO Y D, JEONG H J, KIM M S, et al. Feeding by phototrophic red-tide dinoflagellates on the ubiquitous marine diatom Skeletonema costatum[J]. The Journal of Eukaryotic Microbiology, 2009, 56(5): 413-420. DOI:10.1111/j.1550-7408.2009.00421.x |
| [26] |
李慧. 化感作用对中肋骨条藻和东海原甲藻种间竞争的影响[D]. 青岛: 中国海洋大学, 2011.
|



