2. 广西高校中药提取纯化与质量分析重点实验室, 广西南宁 530200;
3. 广西壮瑶药重点实验室, 广西南宁 530200
2. Key Laboratory of TCM Extraction and Purification and Quality Analysis in Guangxi Universities, Nanning, Guangxi, 530200, China;
3. Guangxi Key Laboratory of Zhuang and Yao Ethnic Medicine, Nanning, Guangxi, 530200, China
龙眼叶是无患子科(Sapindaceae)龙眼属(Dimocarpus)植物龙眼(Dimocarpus longan Lour.)的叶子或嫩芽,具有清热解毒、祛风除湿等功效[1]。主要用于治疗发热、湿疹、肠炎等[2],常以单方形式治疗糖尿病。前期研究发现龙眼叶的乙酸乙酯部位具有一定的降糖活性[3],其降血糖作用机制可能与胰岛细胞损伤修复、炎性反应因子水平降低有关[4]。初步推测黄酮类成分山柰酚、槲皮苷、槲皮素为龙眼叶抗2型糖尿病的药效物质基础[5]。因此,本研究通过星点设计-效应面法(CCD-RSM)设立优化实验方案,进行龙眼叶黄酮单体组分配伍的降糖作用研究,探讨山柰酚、槲皮苷、槲皮素最佳配伍比例,为提高龙眼叶组分配伍的科学性和临床治疗的有效性提供科学方法与实验依据。
1 材料与方法 1.1 材料人肝癌HepG2细胞(购自中国科学院上海生命科学研究院细胞资源中心),1640高糖培养基[赛默飞世尔生物化学制品(北京)有限公司],胎牛血清(浙江天杭生物科技股份有限公司),磷酸盐缓冲溶液(PBS,江苏凯基生物技术股份有限公司),0.25%胰酶细胞消化液和CCK-8试剂盒(上海碧云天生物技术有限公司),葡萄糖试剂盒(上海荣盛生物药业股份有限公司),盐酸二甲双胍片(中美上海施贵宝制药有限公司),山柰酚对照品、槲皮苷对照品和槲皮素对照品(成都麦德生科技有限公司),无水乙醇为分析纯。
SW-CJ-1FD型单人单面净化工作台(苏州智净净化设备有限公司),MCO-18AIC型CO2细胞培养箱(日本SAYO生物科技有限公司),CK40+PM20型倒置系统显微镜(日本OLYMPUS OPTICAL有限公司),Multiskan SkyHigh全波长酶标仪、Sorvall ST 16R型高速冷冻离心机和Forma 89000型超低温冰箱(美国Thermo Fisher科技公司),SQP型万分之一电子分析天平[赛多利斯科学仪器(北京)有限公司]。
1.2 方法 1.2.1 细胞复苏用75%乙醇擦拭SW-CJ-1FD型单人单面净化工作台后,摆放好实验所需的物品,并开启紫外灯照射30 min后,将HepG2细胞从-80 ℃冰箱中取出,快速放入37 ℃水浴锅中,轻摇使其冻存液溶解;然后把细胞转移到装有5 mL含10%胎牛血清的1640高糖培养基(完全培养基)的离心管中,1 000 r/min离心5 min,弃去上清液;用完全培养基轻轻吹打细胞,使细胞悬浮,接种到装有3 mL完全培养基的25 cm3细胞培养瓶中,倒置系统显微镜下观察,标记好细胞名称、代数、日期后,放入37 ℃、5% CO2细胞培养箱中培养,24 h内观察细胞状态及贴壁状况,待培养瓶中的培养液颜色变黄时换液,即用巴氏吸管将旧的培养液吸出培养瓶,再沿壁加入2 mL PBS冲洗细胞2次,最后加入新的完全培养基,后续每隔2-3 d换液1次。
1.2.2 细胞传代在倒置系统显微镜下观察HepG2细胞生长状况,当细胞的密度达到倒置系统显微镜视野下的80%时,对细胞进行传代。弃去培养基,用PBS冲洗2次;加入1-2 mL 0.25%胰蛋白酶消化,将培养瓶放回培养箱2 min,倒置系统显微镜下观察至细胞相互分离且变圆,表明消化完成;加入完全培养基,轻轻吹打细胞使之成细胞悬液,1 000 r/min离心5 min,弃去上清液,重新加入新鲜的完全培养基,制成单细胞悬液,按1∶3的比例传代,相同条件下扩大培养。
1.2.3 HepG2细胞胰岛素抵抗模型的建立HepG2细胞传代后,用完全培养基培养,按4×103个/孔接种于96孔板,在37 ℃、5% CO2条件下培养24 h。弃去培养液,分别加入含1×10-5、1×10-6、1×10-7、1×10-8、1×10-9 mol/L胰岛素的无血清培养液,加入不含胰岛素的无血清培养液作为对照组,另设一组不含细胞以及不加胰岛素作为空白组。设立5个复孔,并分别于24、48 h之后用葡萄糖测定试剂盒检测培养液上清液中的葡萄糖含量[6-8]。计算对照组与不同胰岛素浓度组细胞葡萄糖的消耗量和消耗率。葡萄糖消耗量=空白组葡萄糖含量-模型组葡萄糖含量[9-11],葡萄糖消耗率(%)=(空白组葡萄糖含量-模型组葡萄糖含量)/空白组葡萄糖含量[12, 13]。选择葡萄糖消耗率最小,即达到胰岛素抵抗最高状态的胰岛素作用浓度与时间分别为胰岛素最佳浓度与时间。
1.2.4 山柰酚、槲皮素、槲皮苷对HepG2细胞存活率的影响将HepG2细胞按5×104个/mL细胞悬液接种于96孔板内,每孔100 μL,设置5个复孔。将接种后的细胞分为空白组、给药组和对照组3个组,空白组只加完全培养基不接种细胞,对照组则只加细胞悬液不加药物,给药组按以下不同药物浓度给药:山柰酚和槲皮素浓度梯度均为20、40、60、80、100、120、140、160 μmol/L,槲皮苷浓度梯度为100、120、140、160、180、200、220、240、260、280、300 μmol/L。依次加完后将细胞放入37 ℃、5% CO2培养箱内培养24 h后将96孔板取出,轻轻吸出板孔内液体,并用PBS缓冲液清洗细胞2次,每孔加入90 μL的完全培养基和CCK-8溶液10 μL后,放入37 ℃、5% CO2培养箱内继续培养。1 h后取出96孔板,在450 nm波长下用酶标仪检测吸光度[14]。计算细胞存活率,实验重复3次。细胞存活率=(给药孔吸光度-空白孔吸光度)/(对照孔吸光度-空白孔吸光度)×100%[15]。根据CCK-8实验结果筛选出可促进HepG2细胞增殖的槲皮素、山柰酚、槲皮苷最适给药浓度。
1.2.5 龙眼叶黄酮成分的组分配伍优化(1) CCD-RSM实验
根据前期实验结果,在药物对细胞没有毒性的剂量范围内,确定各药的最适给药浓度范围。山柰酚用量用A (μmol/L)表示,槲皮素用量用B (μmol/L)表示,槲皮苷用量用C (μmol/L)表示,A、B、C为自变量,分别以山柰酚、槲皮素、槲皮苷对胰岛素抵抗的HepG2细胞葡萄糖消耗率Y (%)为考察指标,进行三因素五水平(-1.732,-1,0,+1,+1.732)的CCD-RSM,因素水平见表 1[16]。通过Design expert 8.0.6软件生成20组实验组合,按照表 1列出的每组单体药物配比浓度加药。在相同条件下测定HepG2细胞的葡萄糖消耗率Y(%),记录每组因素组合的实验结果,并将实验结果填入对应列。
| 水平 Level |
因素Factor | ||
| Kaempferol (A) | Quercetin (B) | Quercitrin (C) | |
| -1.732 | 80 | 60 | 160 |
| -1 | 88 | 68 | 177 |
| 0 | 100 | 80 | 200 |
| +1 | 112 | 92 | 223 |
| +1.732 | 120 | 100 | 240 |
(2) 最佳配比组合预测与验证
采用Design Expert 8.0.6软件对实验结果建立二次回归数学模型预测。根据二项式拟合方程,绘制葡萄糖消耗率影响趋势的三维效应面和二维等高图,选择最佳配伍比例并进行实验验证。
2 结果与分析 2.1 胰岛素抵抗模型的建立 2.1.1 24 h不同浓度胰岛素对HepG2细胞胰岛素抵抗的影响如表 2所示,模型组HepG2细胞对葡萄糖的消耗率相比于对照组均有不同程度的减少。其中,模型组1×10-7 mol/L与对照组相比,差异具有极显著统计学意义(P < 0.01),说明胰岛素浓度为1×10-7 mol/L时,HepG2细胞对葡萄糖消耗率明显减少,为20.62%;模型组1×10-8、1×10-9 mol/L与对照组相比,差异具有统计学意义(P < 0.05),说明胰岛素浓度为1×10-8、1×10-9 mol/L时,HepG2细胞对葡萄糖消耗率减少,分别为21.76%、23.26%;其余浓度与对照组相比,差异无显著性。由此可判定胰岛素浓度1×10-7 mol/L为HepG2细胞产生胰岛素抵抗的最佳作用浓度。
| 组别 Group |
胰岛素浓度/(mol/L) Insulin concentration/(mol/L) |
葡萄糖消耗量/(mmol/L) Glucose consumption/(mmol/L) |
葡萄糖消耗率/% Glucose consumption rate/% |
| Control group | 0 | 3.26±0.02 | 29.16 |
| Model group | 1×10-5 | 2.89±0.19 | 25.82 |
| 1×10-6 | 2.74±0.16 | 24.54 | |
| 1×10-7 | 2.31±0.11** | 20.62 | |
| 1×10-8 | 2.43±0.08* | 21.76 | |
| 1×10-9 | 2.60±0.07* | 23.26 | |
| Note: compared with the control group, ** means P<0.01, * means P<0.05. | |||
2.1.2 48 h不同浓度胰岛素对HepG2细胞胰岛素抵抗的影响
如表 3所示,模型组HepG2细胞对葡萄糖的消耗率相比于对照组均有不同程度的减少。其中,模型组1×10-7、1×10-8 mol/L与对照组相比差异具有统计学意义(P < 0.05),说明胰岛素浓度为1×10-7、1×10-8 mol/L时,HepG2细胞对葡萄糖消耗率减少,分别为25.55%、27.04%;其余浓度与对照组相比差异无显著性。与胰岛素浓度1×10-8 mol/L组相比,浓度为1×10-7 mol/L时,HepG2细胞对葡萄糖的消耗率更小,由此可判定胰岛素浓度1×10-7 mol/L为HepG2细胞产生胰岛素抵抗的最佳作用浓度。在胰岛素浓度同为1×10-7 mol/L的情况下,与作用时间48 h相比,作用24 h时HepG2细胞对葡萄糖的消耗率更小,耗时更少,因此选择胰岛素浓度1×10-7 mol/L、时间24 h作为HepG2细胞产生胰岛素抵抗的实验条件。
| 组别 Group |
胰岛素浓度/(mol/L) Insulin concentration/(mol/L) |
葡萄糖消耗量/(mmol/L) Glucose consumption/(mmol/L) |
葡萄糖 消耗率/% Glucose consumption rate/% |
| Control group | 0 | 3.36±0.07 | 32.66 |
| Model group | 1×10-5 | 2.98±0.35 | 28.53 |
| 1×10-6 | 2.84±0.19 | 26.43 | |
| 1×10-7 | 2.33±0.07* | 25.55 | |
| 1×10-8 | 2.67±0.03* | 27.04 | |
| 1×10-9 | 3.05±0.15 | 29.21 | |
| Note: compared with the control group, * means P<0.05. | |||
2.2 山柰酚、槲皮素、槲皮苷浓度对HepG2细胞存活率的影响
用CCK-8法检测不同浓度山柰酚、槲皮素和槲皮苷浓度对HepG2细胞存活率的影响,结果见表 4和表 5。根据《医疗器械生物学评价第5部分:体外细胞毒性试验》(GB/T 16886.5-2017),当细胞活力降低超过30%时表示药物具有细胞毒性作用。因此,在药物对细胞没有毒性的剂量范围内,确定了各药的最适给药浓度:山柰酚80-120 μmol/L、槲皮素60-100 μmol/L、槲皮苷160-240 μmol/L。
| 给药浓度/(μmol/L) Dose concentration/(μmol/L) |
HepG2细胞存活率/% Survival rate of HepG2 cells/% |
|
| 山柰酚 Kaempferol |
槲皮素 Quercetin |
|
| 0 | 100.00 | 100.00 |
| 20 | 127.99±6.43* | 113.23±6.41 |
| 40 | 114.22±8.87 | 105.86±7.33 |
| 60 | 104.93±13.21 | 95.28±6.50 |
| 80 | 95.83±1.43* | 87.80±3.19 |
| 100 | 84.64±0.99** | 68.19±2.27** |
| 120 | 75.70±2.87** | 62.79±7.89** |
| 140 | 66.77±2.96** | 58.21±2.90** |
| 160 | 62.98±4.92** | 55.55±5.24** |
| Note: compared with the blank group (0 μmol/L), * means P<0.05,** means P<0.01. | ||
| 槲皮苷浓度/(μmol/L) Quercitrin concentration/(μmol/L) |
HepG2细胞存活率/% Survival rate of HepG2 cells/% |
| 0 | 100.00 |
| 100 | 104.09±4.13 |
| 120 | 99.36±4.47 |
| 140 | 97.35±8.47 |
| 160 | 94.66±2.78 |
| 180 | 88.44±1.38** |
| 200 | 84.54±2.42** |
| 220 | 80.62±2.00** |
| 240 | 76.80±5.17** |
| 260 | 74.60±3.18** |
| 280 | 73.29±2.16** |
| 300 | 69.88±7.28** |
| Note: compared with the blank group (0 μmol/L), ** means P<0.01. | |
2.3 龙眼叶黄酮成分组分配伍的优化 2.3.1 CCD-RSM实验结果
根据CCD-RSM得到的实验结果如表 6所示,单体药物的葡萄糖消耗率结果如表 7所示,其中,二甲双胍为阳性对照组。配伍给药组降糖的作用较明显,葡萄糖消耗率均较高,其各单体药物的浓度值相对较低(表 6);3种单体分别有一定的降血糖作用,但没有配伍给药组降糖的效果明显,而且单体给药组降糖作用较好的组别,其单体浓度普遍偏高(表 7),不如配伍给药组以相对较低的浓度配比获得较高的葡萄糖消耗率。
| 试验号 Test number |
A/(μmol/L) | B/(μmol/L) | C/(μmol/L) | Y/% |
| 1 | -1 | -1 | -1 | 15.36 |
| 2 | 1 | -1 | -1 | 16.97 |
| 3 | -1 | 1 | -1 | 15.73 |
| 4 | 1 | 1 | -1 | 14.62 |
| 5 | -1 | -1 | 1 | 8.32 |
| 6 | 1 | -1 | 1 | 16.58 |
| 7 | -1 | 1 | 1 | 7.57 |
| 8 | 1 | 1 | 1 | 13.24 |
| 9 | -1.732 | 0 | 0 | 14.24 |
| 10 | 1.732 | 0 | 0 | 18.41 |
| 11 | 0 | -1.732 | 0 | 11.34 |
| 12 | 0 | 1.732 | 0 | 11.25 |
| 13 | 0 | 0 | -1.732 | 16.26 |
| 14 | 0 | 0 | 1.732 | 9.49 |
| 15 | 0 | 0 | 0 | 21.52 |
| 16 | 0 | 0 | 0 | 20.75 |
| 17 | 0 | 0 | 0 | 20.73 |
| 18 | 0 | 0 | 0 | 21.34 |
| 19 | 0 | 0 | 0 | 20.63 |
| 20 | 0 | 0 | 0 | 20.66 |
| 药物名称 Drug name |
给药浓度/(μmol/L) Dose concentration/(μmol/L) | 葡萄糖消耗率/% Glucose consumption rate/% |
| Metformin | 16 000 | 14.80±1.05 |
| 8 000 | 14.16±0.87 | |
| 4 000 | 21.98±0.84 | |
| Kaempferol | 80 | 13.88±1.06 |
| 88 | 9.88±1.07 | |
| 100 | 17.23±1.32 | |
| 112 | 12.65±0.79 | |
| 120 | 10.40±0.96 | |
| Quercetin | 60 | 16.13±0.55 |
| 68 | 5.07±1.37 | |
| 80 | 8.26±0.90 | |
| 92 | 11.79±0.64 | |
| 100 | 7.79±1.02 | |
| Quercitrin | 160 | 4.90±0.96 |
| 177 | 8.72±0.98 | |
| 200 | 14.40±0.93 | |
| 223 | 11.64±1.01 | |
| 240 | 7.50±1.00 |
2.3.2 回归模型建立与显著性分析
运用Design expert 8.0.6数据分析软件对试验数据进行多元回归拟合,结果见表 8,得到二次多项回归模型为Y=20.94+1.55×A-0.44×B-2.05×C-0.66×AB+1.68×AC-0.26×BC-1.53×A2-3.2×B2-2.68×C2。
| 来源 Source |
离差平方和 Sum of squares of deviation |
自由度 Degree of freedom |
均方 Mean square |
F值 F value |
P值 P value |
显著性 Significance |
| Model | 378.86 | 9 | 42.1 | 107.04 | <0.000 1 | ** |
| A | 33.49 | 1 | 33.49 | 85.16 | <0.000 1 | ** |
| B | 2.77 | 1 | 2.77 | 7.04 | 0.024 2 | * |
| C | 58.82 | 1 | 58.82 | 149.57 | <0.000 1 | ** |
| AB | 3.52 | 1 | 3.52 | 8.96 | 0.013 5 | * |
| AC | 22.55 | 1 | 22.55 | 57.33 | <0.000 1 | ** |
| BC | 0.56 | 1 | 0.56 | 1.42 | 0.261 7 | |
| A2 | 36.78 | 1 | 36.78 | 93.53 | <0.000 1 | ** |
| B2 | 161.77 | 1 | 161.77 | 411.35 | <0.000 1 | ** |
| C2 | 112.97 | 1 | 112.97 | 287.26 | <0.000 1 | ** |
| Residual error | 3.93 | 10 | 0.39 | |||
| Missing fit | 3.18 | 5 | 0.64 | 4.24 | 0.069 6 | ns |
| Pure error | 0.75 | 5 | 0.15 | |||
| Sum total | 382.79 | 19 | ||||
| R2=0.989 7 Adj R2=0.980 5 | ||||||
| Note: P<0.01 means extremely significant and is represented by **; P<0.05 means significant and is represented by *; P>0.05 means not significant and is represented by ns. | ||||||
在α=0.05显著性水平下,剔除对影响不显著的因素得到回归方程为Y =20.94+1.55×A-0.44×B-2.05×C-0.66×AB+1.68×AC-1.53×A2-3.2×B2-2.68×C2,R2=0.989 7。说明用二项式数学模型预测实验的数据结果是可信的。对方程进行方差分析可知回归方程具有显著性差异(P < 0.01),3个因素对HepG2细胞葡萄糖消耗率的影响排序为C>A>B,其中,槲皮苷、山柰酚对葡萄糖消耗率影响极显著(P < 0.01),回归方程的失拟项不显著(P>0.05),表明未知因素对实验结果的干扰小,模型能充分拟合实验数据。
2.3.3 各因素的交互作用根据回归方程,考察响应面曲面图及等高线图的形状,分析山柰酚、槲皮素、槲皮苷对葡萄糖消耗率的影响。响应面曲面图和等高线图可以很好地反映自变量之间的相互作用。通过观察响应面曲面图的坡度陡峭程度,可确定两者对响应值的影响程度,响应面曲面图越陡峭说明两者的交互作用越明显。
山柰酚和槲皮素交互作用对葡萄糖消耗率的影响如图 1所示。在槲皮苷浓度为200 μmol/L的情况下,当山柰酚浓度小于100 μmol/L时,随着槲皮素浓度的逐渐升高,葡萄糖消耗率先升高后降低;当山柰酚浓度大于100 μmol/L时,随着槲皮素浓度的逐渐升高,葡萄糖消耗率呈现先缓慢升高后迅速降低的变化趋势;当槲皮素浓度小于80 μmol/L时,随着山柰酚浓度的逐渐升高,葡萄糖消耗率呈逐渐升高的趋势,当槲皮素浓度大于80 μmol/L时,随着山柰酚浓度的逐渐升高,葡萄糖消耗率呈先升高后缓慢降低的趋势。说明山柰酚和槲皮素之间存在显著的交互作用,且山柰酚的变化陡峭程度大于槲皮素,说明山柰酚对葡萄糖消耗率的影响大于槲皮素。
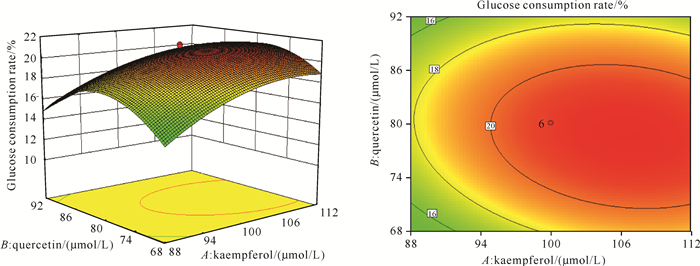
|
| 图 1 山柰酚和槲皮素交互作用对葡萄糖消耗率的响应面曲面图和等高线图 Fig.1 Response surface diagram and contour chart of the interaction between kaempferol and formed quercetin on glucose consumption rate |
山柰酚和槲皮苷交互作用对葡萄糖消耗率的影响如图 2所示。当槲皮素浓度为80 μmol/L、槲皮苷浓度一定时,随着山柰酚浓度的逐渐升高,葡萄糖消耗率呈先升高后降低的趋势。在槲皮素浓度为80 μmol/L的情况下,当山柰酚浓度小于100 μmol/L时,随着槲皮苷浓度的逐渐升高,葡萄糖消耗率逐渐减小;当山柰酚浓度大于100 μmol/L时,随着槲皮苷浓度的逐渐升高,葡萄糖消耗率先升高后降低。说明山柰酚和槲皮苷之间存在显著的交互作用,且槲皮苷的变化陡峭程度大于山柰酚,说明槲皮素对葡萄糖消耗率的影响大于山柰酚。
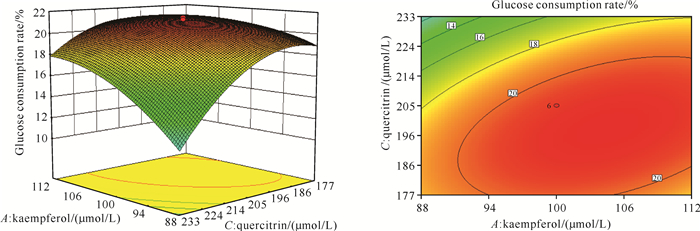
|
| 图 2 山柰酚和槲皮苷交互作用对葡萄糖消耗率的响应面曲面图和等高线图 Fig.2 Response surface diagram and contour chart of kaempferol and quercetin interaction on glucose consumption rate |
槲皮素和槲皮苷交互作用对葡萄糖消耗率的影响如图 3所示。当山柰酚浓度为100 μmol/L、槲皮素浓度一定时,随着槲皮苷浓度的逐渐升高,葡萄糖消耗率先升高后降低;当山柰酚浓度为100 μmol/L、槲皮苷浓度一定时,随着槲皮素浓度的逐渐升高,葡萄糖消耗率呈现先升高后降低的变化趋势。说明槲皮素和槲皮苷之间无显著的交互作用,且槲皮苷的变化陡峭程度大于槲皮素,说明槲皮苷对葡萄糖消耗率的影响大于槲皮素。
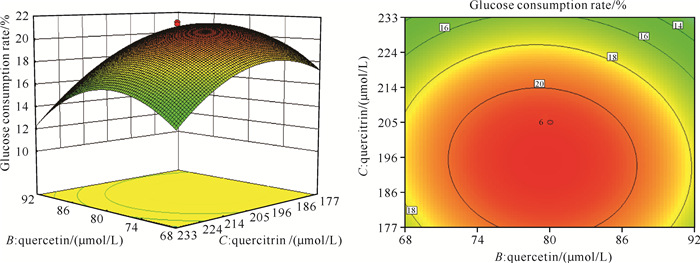
|
| 图 3 槲皮素和槲皮苷交互作用对葡萄糖消耗率的响应面曲面图和等高线图 Fig.3 Response surface diagram and contour chart of quercetin and quercetin interaction on glucose consumption rate |
2.4 验证实验结果
根据回归方程模型,得到预测的最优条件:山柰酚浓度为104.807 μmol/L、槲皮素浓度为78.855 μmol/L、槲皮苷浓度为194.078 μmol/L,根据实际情况将该条件修正为山柰酚浓度为105.0 μmol/L、槲皮素浓度为78.9 μmol/L、槲皮苷浓度为194.0 μmol/L(根据实验可调整的参数进行设置),在此最优条件下经6次平行实验,实际得到的葡萄糖消耗率为(21.05±0.52)%,与预测值21.52%相差2.19%,证实了预测值和实验值之间具有良好的相关性。
3 讨论龙眼叶是一味具有广西民族特色的中药材,其性味甘、淡、平,具有发表清热、利湿解毒等功效。随着研究的深入,发现龙眼叶有多种化学成分,如多酚类、黄酮类以及挥发油物质[17, 18],其中黄酮类化合物为其主要活性物质。黄酮类成分具有抑制α-葡萄糖苷酶活性,延缓机体对葡萄糖的吸收,从而降低血糖的作用[19-21]。
本研究建立HepG2细胞胰岛素抵抗模型,通过CCK8法筛选出3种黄酮类成分的最佳给药浓度,并采用CCD-RSM的设计方案,优选出龙眼叶黄酮类成分的最佳组分配伍比例。CCD-RSM是一种在药学领域中常用的设计方法,具有实验精度高、实验次数少、预测性较好等特点,可用于优化制剂工艺以及组分配伍[22, 23]。配伍是中药应用的基本形式之一[24],中药配伍是通过比例或药味之间的搭配,促进不同药物之间相互作用,从而发挥药物的最大疗效,主要表现在药物的体内过程如代谢、排泄等不同环节[25]。因此,本研究通过龙眼叶黄酮类单体成分组分配伍来协同降糖以增强龙眼叶治疗糖尿病的效果。
本课题组前期研究了龙眼叶在2型糖尿病模型大鼠体内的代谢成分,并根据实验结果,结合黄酮类成分为龙眼叶的主要药效基础,初步推测山柰酚、槲皮苷、槲皮素为龙眼叶抗2型糖尿病的药效物质基础[26]。目前的研究多数集中在黄酮类单体成分的降血糖作用。如汤小平等[27]研究发现槲皮苷可改善糖尿病大鼠的糖耐量异常,存在一定的降血糖作用。吴巧敏等[28]研究发现山柰酚能够降低2型糖尿病大鼠的血糖并改善胰岛素抵抗。王建礼等[29]发现槲皮素能降低2型糖尿病大鼠的血糖。本研究将龙眼叶中3种黄酮类成分以不同比例配伍,通过CCD-RSM实验设计,优选出龙眼叶黄酮成分的最佳组分配伍比例。研究结果显示,山柰酚、槲皮素、槲皮苷配伍能显著改善胰岛素抵抗HepG2细胞的葡萄糖消耗率,消耗率越高则降血糖效果越好,改善情况与三者的配伍比例有一定关系。在槲皮苷浓度一定的前提下,随着槲皮素浓度升高,疗效先增强后减弱,当槲皮素浓度小于80 μmol/L时,随着山柰酚用量增加,疗效逐渐增加;当槲皮素浓度大于80 μmol/L时,随着山柰酚用量增加,疗效先增强后减弱。在槲皮素浓度一定的前提下,随着山柰酚浓度升高,疗效先增强后减弱,当山柰酚浓度小于100 μmol/L时,随着槲皮苷用量增加,疗效逐渐减弱;当山柰酚浓度大于100 μmol/L时,随着槲皮苷用量增加,疗效先增强后减弱。在山柰酚浓度一定的前提下,随着槲皮苷和槲皮素用量增加,疗效先增强后减弱。最终优选出龙眼叶黄酮单体成分最佳配伍比例为山柰酚105.0 μmol/L、槲皮素78.9 μmol/L、槲皮苷194.0 μmol/L。
综上所述,龙眼叶组分配伍可以提高药物临床疗效,但配伍组分治疗糖尿病的作用机制后续还需要开展更进一步的研究。
4 结论本研究通过高浓度胰岛素诱导建立胰岛素抵抗模型,分别考察了不同浓度的胰岛素及不同诱导时间对胰岛素抵抗模型的诱导情况。结果显示,HepG2细胞建立胰岛素抵抗模型的最佳条件为1×10-7 mol/L胰岛素诱导24 h;并通过CCD-RSM实验优选山柰酚、槲皮素、槲皮苷的最佳配伍比例,最终确定龙眼叶黄酮类单体成分最佳配伍比例为山柰酚105.0 μmol/L、槲皮素78.9 μmol/L、槲皮苷194.0 μmol/L。本研究可为确定龙眼叶最佳配伍比例提供数据支撑,为后期龙眼叶配伍组分调节糖脂代谢机制的研究奠定基础。
| [1] |
国家中医药管理局《中华本草》编委会. 中华本草: 13卷[M]. 上海: 上海科学技术出版社, 1999: 112.
|
| [2] |
福建省医药研究所. 福建中药志(第一册)[M]. 福州: 福建人民出版社, 1979: 296.
|
| [3] |
梁洁, 金青青, 黄团心, 等. 龙眼叶不同极性部位对2型糖尿病小鼠的降血糖作用研究[J]. 中国药房, 2018, 29(7): 950-954. |
| [4] |
梁洁, 金青青, 黄团心, 等. 龙眼叶乙酸乙酯提取物对2型糖尿病大鼠降血糖作用机制的研究[J]. 中华中医药杂志, 2019, 34(2): 563-568. |
| [5] |
梁洁, 韦金玉, 黄冬芳, 等. 基于UPLC-Q-TOF-MS/MS技术的龙眼叶入血成分分析[J]. 中药材, 2021, 44(3): 615-621. |
| [6] |
李秀丽, 贺嵩敏, 朱莹, 等. HepG2细胞胰岛素抵抗模型的建立与鉴定[J]. 中国实验方剂学杂志, 2013, 19(5): 203-207. |
| [7] |
肖婷, 唐永瑜, 张道宏, 等. 黑树莓花色苷对HepG2细胞胰岛素抵抗作用研究[J]. 药物评价研究, 2022, 45(9): 1810-1815. |
| [8] |
王瑞雪, 房一明, 郭娜, 等. 柠檬皮多酚对胰岛素抵抗的HepG2细胞葡萄糖消耗量的影响[J]. 食品工业, 2022, 43(9): 161-165. |
| [9] |
刘迪迪, 邱军强, 程翠林, 等. HepG2细胞胰岛素抵抗模型建立影响因素研究[J]. 食品与药品, 2018, 20(1): 1-6. |
| [10] |
马永强, 韩烨, 张凯, 等. 甜玉米芯多糖对胰岛素抵抗HepG2细胞糖代谢功能的影响[J]. 食品科学, 2021, 42(17): 170-176. |
| [11] |
蒋国君, 刘天旭, 黄桂红, 等. 异槲皮苷对HepG2细胞中Raf/MEK/ERK信号通路的干预作用[J]. 中国药理学通报, 2017, 33(10): 1382-1387. |
| [12] |
TIE F F, DING J, HU N, et al. Kaempferol and kaempferide attenuate oleic acid-induced lipid accumulation and oxidative stress in HepG2 cells[J]. International Journal of Molecular Sciences, 2021, 22(16): 8847. DOI:10.3390/ijms22168847 |
| [13] |
陈琪, 刘婷婷, 白图雅, 等. 槲皮素通过调节AhR和Nrf2通路对HepG2细胞中药物代谢酶GSTP1的影响[J]. 中南药学, 2022, 20(1): 8-13. |
| [14] |
容子玲, 刘玉晖, 朱洪杨, 等. 葛根抑制高糖诱导巨噬细胞损伤与调控内质网应激信号通路的关系探讨[J]. 中国实验方剂学杂志, 2022, 28(24): 58-64. |
| [15] |
范泽萍, 陈兰英, 刘鹏, 等. 白头翁皂苷A3通过M2型巨噬细胞提高人结肠癌SW480细胞对5-FU的化疗敏感性[J]. 中国医院药学杂志, 2022, 42(18): 1868-1875. |
| [16] |
朱秀珍, 席啸虎. 星点设计-效应面法优化茯苓、厚朴、郁金配伍比例的研究[J]. 中国民间疗法, 2021, 29(17): 85-88, 114. |
| [17] |
梁洁, 滕建北, 柳贤福, 等. 龙眼叶化学成分预试研究[J]. 中国民族民间医药, 2010, 19(4): 142-143. |
| [18] |
梁洁, 王雯慧, 甄汉深, 等. 广西产龙眼叶及花挥发油成分气质联用分析[J]. 中国实验方剂学杂志, 2010, 16(9): 52-55. |
| [19] |
KIMURA A, LEE J H, LEE I S, et al. Two potent competitive inhibitors discriminating alpha-glucosidase family Ⅰ from familyⅡ[J]. Carbohydrate Research, 2004, 339(6): 1035-1040. DOI:10.1016/j.carres.2003.10.035 |
| [20] |
TADERA K, MINAMI Y, TAKAMATSU K, et al. Inhibition of alpha-glucosidase and alpha-amylase by flavonoids[J]. Journal of Nutritional Science and Vitaminology, 2006, 52(2): 149-153. DOI:10.3177/jnsv.52.149 |
| [21] |
吴小杰, 郐滨, 赵海桃, 等. 刺玫果黄酮对胰岛素抵抗HepG2细胞糖代谢功能研究[J]. 林产化学与工业, 2023, 43(3): 41-48. |
| [22] |
方哲正, 黄味子, 戚建平, 等. 星点设计-效应面优化法在国内制剂处方优化中的应用进展[J]. 药学学报, 2021, 56(1): 169-177. |
| [23] |
谢静静, 杨永寿, 郝芳芳, 等. 星点设计-响应面法优选美洲大蠊抗肝纤维化颗粒的成型工艺[J]. 医药导报, 2021, 40(12): 1710-1715. |
| [24] |
王阶, 郭丽丽, 杨戈, 等. 方剂配伍理论研究方法及研究前景[J]. 世界科学技术-中医药现代化, 2006, 8(1): 1-5. |
| [25] |
王旭华, 徐顶巧, 黄露, 等. 黄连-吴茱萸药对配伍机制研究进展[J]. 中国实验方剂学杂志, 2022, 28(3): 266-274. |
| [26] |
胡珏, 梁洁, 李萍, 等. 基于UHPLC-Q-Orbitrap MS技术的龙眼叶乙酸乙酯部位体内代谢研究[J]. 中华中医药学刊, 2023, 41(7): 173-180. |
| [27] |
汤小平, 施宁川, 丁志山, 等. 槲皮苷对原发性糖尿病大鼠血糖的作用研究[J]. 中国药师, 2016, 19(8): 1449-1451, 1454. |
| [28] |
吴巧敏, 金雅美, 倪海祥. 山柰酚对2型糖尿病大鼠慢性并发症相关因子的影响[J]. 中草药, 2015, 46(12): 1806-1809. |
| [29] |
王建礼, 杨作成, 王聪, 等. 槲皮素对糖尿病大鼠的降糖作用及机制研究[J]. 济宁医学院学报, 2018, 41(2): 135-138. |



