番木瓜Carica papaya L.,是番木瓜科Caricaceae番木瓜属Carica L.的常绿软木质小乔木[1],原产于中美洲加勒比海岸,自明清时期传入中国,在南方的热带和亚热带地区如广东、广西、海南、福建、云南和台湾等地广泛种植[2],与香蕉Musa nana Lour.、菠萝Ananas comosus (L.) Merr.同称为“热带三大草本果树”。番木瓜在鲜食消费、食品加工和生物制剂领域均有重要作用,鲜食品种口感风味独特、营养丰富,加工型品种主要用于割浆提取木瓜蛋白酶[3]。木瓜蛋白酶,又称为番木瓜酶、半胱氨酸蛋白酶[4],由一条单肽链组成,包含212个氨基酸残基,其活性中心包含3个关键的氨基酸残基:Cys25、His159和Asp158。除了活性中心的氨基酸,木瓜蛋白酶还有由6个半胱氨酸残基形成的3对二硫键[5-6]。木瓜蛋白酶具有蛋白水解特性,主要涉及精氨酸、赖氨酸和半胱氨酸的催化过程,被广泛应用于医药和食品行业。木瓜蛋白酶既能嫩化肉质、改善啤酒品质、松化饼干、改性豆类制品[6-7],又能治疗皮肤溃烂、辅助治疗肿瘤以及腰椎间盘突出症[7]。此外,木瓜蛋白酶在一些化工和日用品行业也作用显著[8]。但由于木瓜蛋白酶自身结构特殊,其稳定性和活力很大程度上取决于pH值和温度,受环境影响较大。运输过程中环境变化较大,尤其是夏天温度过高,会使酶活力下降速率加快,造成严重的经济损失。因此,寻找保持木瓜蛋白酶活力稳定性的方法迫在眉睫。
有研究表明,加入保护剂可以减少环境因素对酶活力的影响,从而降低酶活力下降速率[9],例如乙二胺四乙酸(Ethylene Diamine Tetraacetic Acid,EDTA)、L-半胱氨酸、山梨醇、海藻糖[10-11]、麦芽糖[12]等。糖分子可以将酶分子包裹,或者将酶分子的活性空间结构填满,使得酶蛋白结构更加稳固而避免失活[10]。醇类[13-14]可参与多种重要的生化反应,保护重要酶蛋白不被氧化或者将活性基团维持在还原状态[15],起到稳定酶的作用。焦亚硫酸钠是一种粉末状的无机化合物,具有杀菌的特性[16-17],可以作为食品防腐剂,广泛用于葡萄酒工业以及新鲜水果的保存,能抑制酶催化和非酶促褐变反应,并有效抑制微生物生长[18]。L-半胱氨酸的抗氧化作用较强,常被用作蔬菜、水果的抗褐变剂[19-20],并且通过增加超氧化物歧化酶(Superoxide Dismutase, SOD)、过氧化氢酶(Catalase, CAT)和单脱氢抗坏血酸还原酶(Monodehydroascorbate Reductase, MDHAR)的活性和减少过氧化氢的产生来延迟果实的成熟[21]。谷胱甘肽是一种非蛋白硫醇,能够维持细胞内的生理氧化还原反应,有较强的抗氧化特性[22-23],能够提高甜椒的抗氧化能力, 促进甜椒的抗坏血酸-谷胱甘肽循环,有效缓解甜椒在低温胁迫下的采后冷害[24];谷胱甘肽还能调节辣椒Copsicum annuum的次生代谢过程和氧化还原反应,从而有效延缓辣椒果实的成熟[25]。基于此,本研究在提取木瓜蛋白酶过程中加入不同种类的保护剂并研究不同保护剂对木瓜蛋白酶活力和稳定性的影响,旨在提高木瓜蛋白酶的经济效益,并推动木瓜蛋白酶产业的发展,促进与之相关的食品和医药等产业的健康发展。
1 材料与方法 1.1 材料与仪器谷胱甘肽(湖南福来格生物技术有限公司,食品级),L-半胱氨酸(河南万邦化工科技有限公司,食品级),EDTA(北京赛因坦科技有限公司,纯度99.8%),焦亚硫酸钠(湖南岳阳三湘化工有限公司,食品级),硫代硫酸钠(天津市大茂化学试剂厂,纯度99.7%),维生素C(河南万邦化工科技有限公司,食品级),葡萄糖(国药集团化学试剂有限公司,纯度99.7%),蔗糖(国药集团化学试剂有限公司,纯度99.7%),聚乙二醇[PEG,生工生物工程(上海)股份有限公司,纯度99.8%],L-半胱氨酸盐酸盐一水合物(北京索莱宝科技有限公司,纯度99.8%),氯化钠[重庆川东化工(集团)有限公司,纯度99.7%],三氯乙酸(上海阿拉丁生化股份有限公司,纯度99.0%),干酪素(国药集团化学试剂有限公司,纯度99.5%),752N紫外可见分光光度计(上海仪电分析仪器有限公司),HH-8水浴锅(金坛市城东新瑞仪器厂),BSA224S天平[赛多利斯科学仪器(北京)有限公司],PHS-3E pH计(上海仪电科学仪器股份有限公司)。
1.2 方法 1.2.1 木瓜蛋白酶浓缩液的制备将木瓜浆与纯水按照1∶7的体积比浸泡3 h后用榨汁机打碎,用沉淀剂进行絮凝并静置2 h,再用板框压滤(陶瓷膜除菌),超滤膜进行浓缩后得到木瓜蛋白酶浓缩液。
1.2.2 保护剂种类的初筛为了解不同试剂对木瓜蛋白酶的真实保护效果,以酶活力的高低和保护时间长短作为评价指标,进行保护剂初筛。从成本、危害性和实用性出发,选择质量分数为0.5%的焦亚硫酸钠、EDTA、L-半胱氨酸、谷胱甘肽、硫代硫酸钠、PEG、山梨醇、维生素C、葡萄糖、蔗糖试剂分别加入木瓜蛋白酶浓缩液中,放入-20 ℃冰箱中冷冻过夜,真空冷冻干燥2-3 d,研磨粉碎获得木瓜蛋白酶干粉,并模拟运输温度于36 ℃下保存,分别于0、7、14、21、28、58、88 d测定木瓜蛋白酶活力和稳定性。以未添加任何其他试剂的木瓜蛋白酶浓缩液为对照组。
1.2.3 保护剂最适保护浓度的确定参考何平等[26]以及前期实验进行保护剂的浓度梯度设计,比较不同保护剂对酶活性的影响,筛选表现较好的保护剂进行浓度梯度测试。向木瓜蛋白酶浓缩液中分别添加质量分数为0.05%、0.10%、0.20%、0.40%的焦亚硫酸钠,质量分数为0.20%、0.60%、1.00%、1.40%的L-半胱氨酸,质量分数为0.10%、0.20%、0.40%、0.60%的谷胱甘肽,放入-20 ℃冰箱中冷冻过夜,真空冷冻干燥2-3 d,研磨粉碎获得木瓜蛋白酶干粉,并模拟运输温度于36 ℃下保存,分别于0、7、14、21、28、58、88 d测定木瓜蛋白酶活力和稳定性。以未添加任何其他试剂的木瓜蛋白酶浓缩液为对照组。通过分析不同保存时间下的酶活力情况,确定最适保护浓度。
1.2.4 木瓜蛋白酶活力的测定称取0.4 g待测酶,加入100 mL磷酸盐缓冲液(由L-半胱氨酸盐酸盐一水合物、氯化钠、EDTA配制而成,pH值为4.5)反复摇匀,再用移液管吸取1 mL置于50 mL容量瓶中,加酶稀释液至刻度,取其中的1 mL待测酶溶液置于带塞试管中,于(37±0.2) ℃恒温水浴10 min,迅速加入5 mL酪蛋白溶液(pH值为7),反应10 min后加入5 mL三氯乙酸溶液终止反应。对照组先加三氯乙酸溶液后再加酪蛋白溶液。反应结束后用干燥滤纸过滤,以水作空白对照,在275 nm波长处测定滤液吸光度A。
酶活力单位定义:在测定条件下每分钟水解酪蛋白释放出的三氯乙酸可溶物在275 nm处的吸光度与1 μg的酪氨酸吸光度相当时,所需要的酶量为一个酶活力单位,以u/g表示。酶活力计算公式如下:
| $ \text { 酶活力 }=50 \times \frac{11}{10} \times \frac{A-B}{C} \times \frac{N}{W} \text {, } $ |
式中,50为每毫升标准液含酪氨酸的质量,即50 μg;11为测试时参加反应的溶液体积,即11 mL;10为反应时间10 min;A为待测酶溶液测试滤液的吸光度;B为待测空白测试滤液的吸光度;C为酪氨酸标准液的吸光度;N为待测酶的稀释倍数;W为待测酶的质量。
1.2.5 数据处理分析利用Excel 2019软件和IBM SPSS statistics 26软件处理实验数据,采用Duncan's多重比较法进行显著性差异分析,以P < 0.05表示显著差异,并用Origin 2021软件制图。
2 结果与分析 2.1 不同种类试剂对木瓜蛋白酶活力的影响不同种类试剂作用下的木瓜蛋白酶活力如图 1所示,不同种类试剂处理0 d和7 d的木瓜蛋白酶活力均存在一定差异。相比于对照组,EDTA组、硫代硫酸钠组、PEG组、山梨醇组、维生素C组、葡萄糖组、蔗糖组处理0 d时的木瓜蛋白酶活力就有所下降;焦亚硫酸钠组、EDTA组、L-半胱氨酸组、谷胱甘肽组、硫代硫酸钠组处理7 d的木瓜蛋白酶活力高于对照组。从处理7 d后的木瓜蛋白酶活力结果可以看出,PEG、山梨醇、维生素C、葡萄糖、蔗糖对木瓜蛋白酶的保护作用较差;焦亚硫酸钠、EDTA、L-半胱氨酸、谷胱甘肽、硫代硫酸钠等试剂组的木瓜蛋白酶活力均高于对照组,保护作用较好,可用作木瓜蛋白酶保护剂。
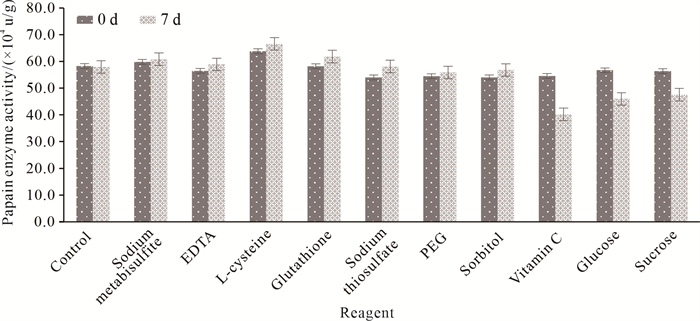
|
| 图 1 不同种类试剂作用下的木瓜蛋白酶活力 Fig.1 Papain enzyme activity under the action of different reagents |
2.2 不同种类保护剂对木瓜蛋白酶稳定性的影响
木瓜蛋白酶难以实现食品加工过程中的即产即用,在存放或运输时间较长时,木瓜蛋白酶易受到环境影响,导致酶活力不稳定,从而造成不同程度的损失。含有焦亚硫酸钠、EDTA、L-半胱氨酸、谷胱甘肽、硫代硫酸钠等保护剂的木瓜蛋白酶活力变化如图 2所示。随着保存时间的延长,木瓜蛋白酶活力不断下降,但焦亚硫酸钠组、谷胱甘肽组和L-半胱氨酸组在7-88 d的木瓜蛋白酶活力均比未添加保护剂的高。28 d内焦亚硫酸钠组和L-半胱氨酸组木瓜蛋白酶活力相对稳定且保持在较高水平。L-半胱氨酸组前期木瓜蛋白酶活力保持稳定,在第58 d出现上升。EDTA组的保护效果较差,随着时间的延长,木瓜蛋白酶活力始终与对照组相近甚至更低。结合生产效益及成本价值,EDTA不适合用作木瓜蛋白酶保护剂。含有硫代硫酸钠的木瓜蛋白酶活力从第21 d开始直线下降,说明其不够稳定,也不利于食品生产。综上,焦亚硫酸钠、L-半胱氨酸、谷胱甘肽这3种保护剂的稳定效果较好。
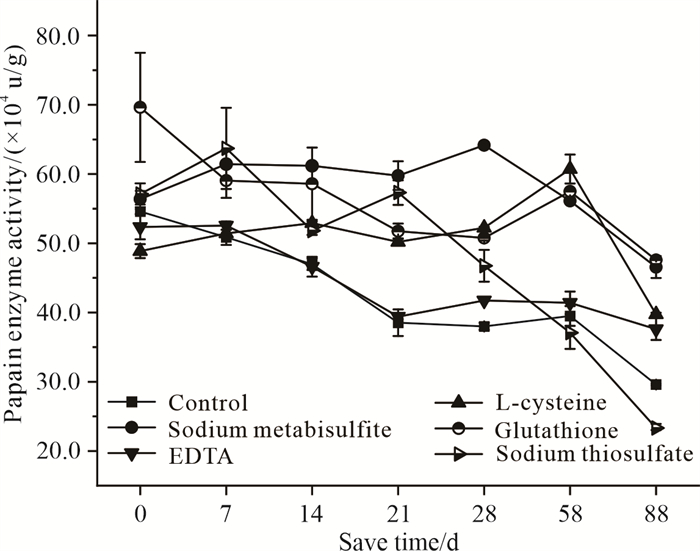
|
| 图 2 不同种类保护剂作用下的木瓜蛋白酶稳定性 Fig.2 Papain enzyme stability under the action of different protective agents |
2.3 木瓜蛋白酶保护剂的最适保护浓度
对不同保护剂浓度作用下的木瓜蛋白酶活力进行SPSS显著性差异分析发现,焦亚硫酸钠、L-半胱氨酸、谷胱甘肽的添加浓度分别为0.10%、0.60%、0.40%时,木瓜蛋白酶活力相对较高(P < 0.05),即其对木瓜蛋白酶的最适保护浓度分别为0.10%、0.60%、0.40%(图 3)。而在其他添加浓度下,木瓜蛋白酶活力则较低。保护剂稳定性排序为焦亚硫酸钠>L-半胱氨酸>谷胱甘肽,但第88 d时焦亚硫酸钠保护能力明显减弱(图 4)。
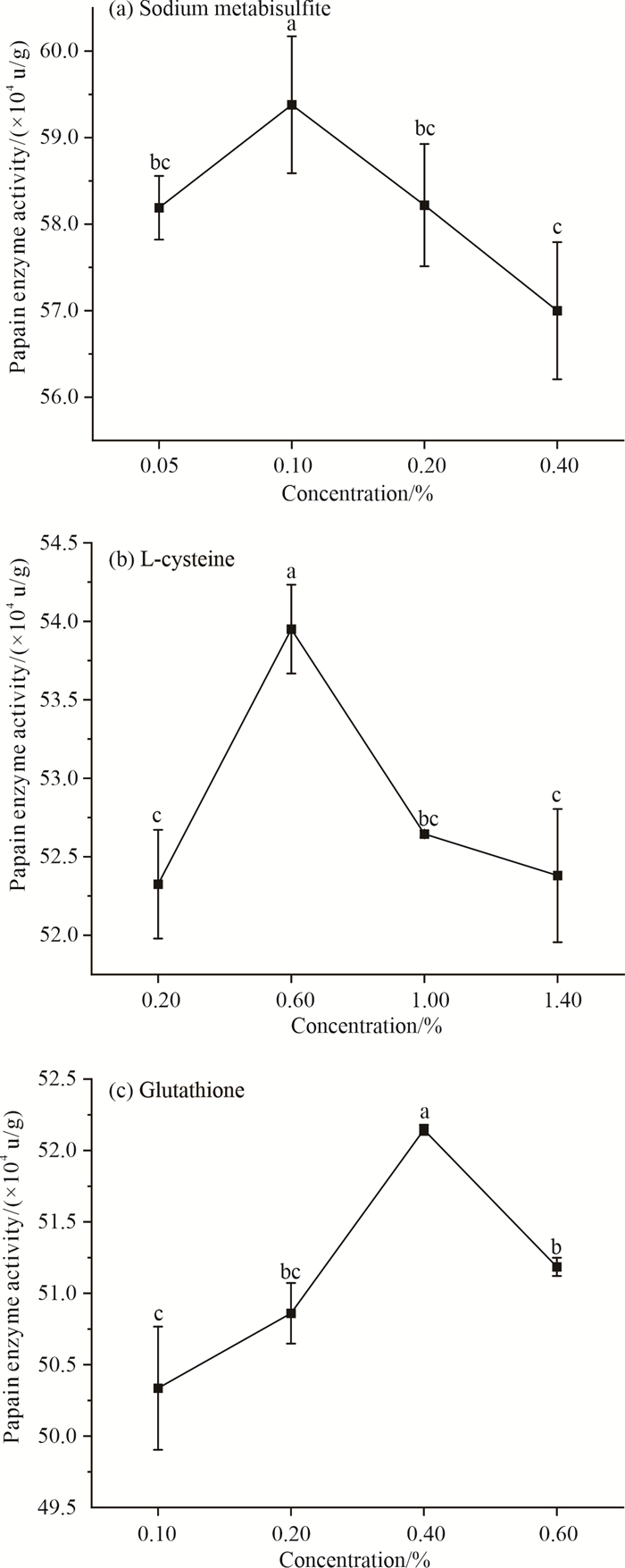
|
| Different lowercase letters in the figure indicate the effect of the concentration of protective agents on the activity of papain enzyme. 图 3 不同浓度保护剂作用下的木瓜蛋白酶活力 Fig.3 Papain enzyme activity under the action of different concentrations of protective agents |
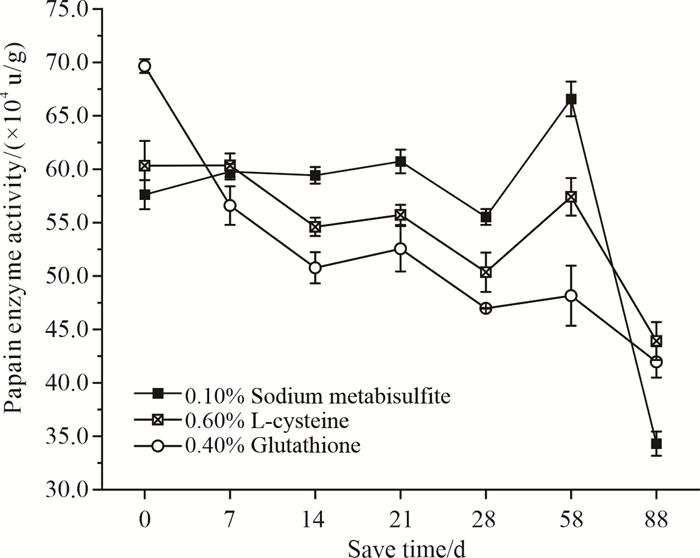
|
| 图 4 最适保护浓度下的木瓜蛋白酶稳定性 Fig.4 Stability of papain enzyme at optimal protective concentrations |
3 讨论
在食品工业中,木瓜蛋白酶活力和稳定性一直是影响木瓜酶产业发展的关键性因素。前人对此也进行了多项研究,Ide等[27]通过将木瓜蛋白酶吸附在硅藻上形成功能性复合材料,并用非交联和碱处理有效提高酶活性;还可采用多种固定化方法[28]来稳定木瓜蛋白酶,例如使用壳聚糖接枝共聚物与N-乙烯基咪唑[29]、涂有聚多巴胺的纤维素纳米晶体[30]、聚乙烯亚胺改性纳米磁球[31]、壳聚糖和壳聚糖琥珀酸酯基质[32]等。此外,也有研究人员选择一些人工抗氧化剂,例如二丁基羟基甲苯(Butylated Hydroxytoluene,BHT)、丁基羟基茴香醚(Butylated Hydroxyanisol,BHA)、没食子酸丙酯(Propyl Gallat,PG)等,但这些试剂价格昂贵导致产品成本升高,效益下降。与此相比,通过在木瓜蛋白酶提取过程中添加保护剂来降低酶活力损失速率,操作更加方便,成本较低。
焦亚硫酸钠、L-半胱氨酸、谷胱甘肽被认为是良好的食品添加剂,均能够影响蛋白质的结构和化学反应。尽管此类还原剂对二硫键总量的影响相对较小,但是裂解的二硫键会使得蛋白质具有可以交联的活性硫基团[33-34],可促进蛋白质分子间交联。与前人研究不同的是,吴蓉等[9]在木瓜蛋白酶覆膜固定化过程中添加PEG和山梨醇后,能够起到保护酶活力的作用;郑振慧等[35]在提取木瓜蛋白酶的工艺过程中添加EDTA作为保护剂,也有较好效果;韩佳钰等[36]研究发现蔗糖溶液的加入会引起木瓜蛋白酶活性中心结构的变化,从而促进了木瓜蛋白酶活力提升。造成差异的原因可能是以上研究都是处理0 d的酶活力,并且处理温度与本研究也有所不同。
4 结论本研究围绕木瓜蛋白酶活力和稳定性,探究了不同试剂对木瓜蛋白酶的影响。以添加试剂处理7 d后的蛋白酶活力为评价指标进行初筛,并进一步将保存时间延长至88 d进行复筛,最终明确焦亚硫酸钠、L-半胱氨酸和谷胱甘肽是对木瓜蛋白酶稳定性保护效果最佳的3种试剂,其对木瓜蛋白酶的最适保护浓度分别为0.10%、0.60%与0.40%。稳定性排序为焦亚硫酸钠>L-半胱氨酸>谷胱甘肽。但这3种保护剂保护机制不明确,木瓜蛋白酶分子被保护的具体位点暂不清楚,有待后续进行更深入研究。
| [1] |
FUENTES G, SANTAMARÍA J M. Papaya (Carica papaya L.): origin, domestication, and production[M]. New York: Springer, 2014.
|
| [2] |
刘德兵, 曾晓鹏, 陈子妹, 等. 我国选育的番木瓜品种介绍[J]. 中国热带农业, 2007(1): 47-49. DOI:10.3969/j.issn.1673-0658.2007.01.026 |
| [3] |
陈燕, 潘祖建, 黄雪梅, 等. 我国番木瓜种质资源保护及利用研究进展[J]. 中国果树, 2024(6): 5-10. |
| [4] |
NOVINEC M, LENARCIC B. Papain-like peptidases: structure, function, and evolution[J]. Biomolecular Concepts, 2013, 4(3): 287-308. DOI:10.1515/bmc-2012-0054 |
| [5] |
BABALOLA B A, AKINWANDE A I, GBOYEGA A E, et al. Extraction, purification and characterization of papain cysteine-proteases from the leaves of Carica papaya[J]. Scientific African, 2023, 19: e01538. DOI:10.1016/j.sciaf.2022.e01538 |
| [6] |
AYODIPUPO BABALOLA B, IFEOLU AKINWANDE A, OTUNBA A A, et al. Therapeutic benefits of Carica papaya: a review on its pharmacological activities and characterization of papain[J]. Arabian Journal of Chemistry, 2024, 17(1): 105369. DOI:10.1016/j.arabjc.2023.105369 |
| [7] |
牟利辉. 木瓜蛋白酶的应用研究[J]. 广东化工, 2008, 35(10): 96-98. |
| [8] |
邓静, 吴华昌, 周健. 木瓜蛋白酶研究进展[J]. 广西轻工业, 2003, 19(3): 5-7. DOI:10.3969/j.issn.1003-2673.2003.03.001 |
| [9] |
吴蓉, 董其惠, 孙伊伊, 等. 吸附-纤维素覆膜联合固定化酶[J]. 高等学校化学学报, 2019, 40(9): 1888-1896. |
| [10] |
杨基础, 董燊, 杨小民. 海藻糖对固定化酶的保护作用[J]. 化工学报, 2000, 51(2): 193-197. DOI:10.3321/j.issn:0438-1157.2000.02.009 |
| [11] |
MEGOURA M, ISPAS-SZABO P, MATEESCU M A. Enhanced stability of vegetal diamine oxidase with trehalose and sucrose as cryoprotectants: mechanistic insights[J]. Molecules, 2023, 28(3): 992. DOI:10.3390/molecules28030992 |
| [12] |
王红玉, 高静, 王海鸥. 溶胶-凝胶法固定化木瓜蛋白酶的活性保护[J]. 过程工程学报, 2008, 8(6): 1190-1194. DOI:10.3321/j.issn:1009-606X.2008.06.028 |
| [13] |
初志战, 黄卓烈, 巫光宏, 等. 乙醇溶液对木瓜蛋白酶催化活性的影响[J]. 热带亚热带植物学报, 2005, 13(4): 329-332. DOI:10.3969/j.issn.1005-3395.2005.04.010 |
| [14] |
刘冰, 丛文杰, 姚兵莉, 等. 优化稳定剂提高丙酮酸氧化酶稳定性的研究[J]. 生物加工过程, 2023, 21(6): 616-622. DOI:10.3969/j.issn.1672-3678.2023.06.004 |
| [15] |
王田林, 梁新红, 孙俊良, 等. 响应面法优化木瓜蛋白酶提取工艺[J]. 食品研究与开发, 2016, 37(19): 86-90. |
| [16] |
MAJ W, PERTILE G, RÓALSKA S, et al. The role of food preservatives in shaping metabolic profile and chemical sensitivity of fungi: an extensive study on crucial mycological food contaminants from the genus Neosartorya (Aspergillus spp.)[J]. Food Chemistry, 2024, 453: 139583. DOI:10.1016/j.foodchem.2024.139583 |
| [17] |
NATSKOULIS P I, LAPPA I K, PANAGOU E Z. Evaluating the efficacy of turbimetric measurements as a rapid screening technique to assess fungal susceptibility to antimicrobial compounds as exemplified by the use of sodium metabisulfite[J]. Food Research International, 2018, 106: 1037-1041. DOI:10.1016/j.foodres.2018.01.058 |
| [18] |
ALIMOHAMMADI A, MOOSAVY M H, AMIN-DOUSTVANDI M, et al. Sodium metabisulfite as a cytotoxic food additive induces apoptosis in HFFF2 cells[J]. Food Chemistry, 2021, 358: 129910. DOI:10.1016/j.foodchem.2021.129910 |
| [19] |
PACE B, CAPOTORTO I, VENTURA M, et al. Evaluation of L-cysteine as anti-browning agent in fresh-cut lettuce processing[J]. Journal of Food Processing and Preservation, 2015, 39(6): 985-993. DOI:10.1111/jfpp.12312 |
| [20] |
ZHANG X Y, LIU J R, SONG L Q, et al. Pre-cut l-cysteine treatment inhibited the browning of fresh-cut apples by regulating enzyme activities and amino acid levels[J]. Postharvest Biology and Technology, 2023, 205: 112528. DOI:10.1016/j.postharvbio.2023.112528 |
| [21] |
SONG Y B, LIANG H Z, PENG J C, et al. Application of L-cysteine hydrochloride delays the ripening of harvested tomato fruit[J]. Foods, 2024, 13(6): 841. DOI:10.3390/foods13060841 |
| [22] |
KUBÁT M, ROUŠAROVÁ E, ROUŠAR T, et al. Recent advances in separation methods for characterization of glutathione metabolism and dietary supplementation[J]. TrAC Trends in Analytical Chemistry, 2024, 176: 117751. DOI:10.1016/j.trac.2024.117751 |
| [23] |
王海梅, 田启威, 杨仕平. 谷胱甘肽和二氧化锰的氧化还原反应在生物领域上的应用[J]. 上海师范大学学报(自然科学版), 2020, 49(2): 203-218. |
| [24] |
YAO M M, GE W Y, ZHOU Q, et al. Exogenous glutathione alleviates chilling injury in postharvest bell pepper by modulating the ascorbate-glutathione (AsA-GSH) cycle[J]. Food Chemistry, 2021, 352: 129458. DOI:10.1016/j.foodchem.2021.129458 |
| [25] |
PAL S, DAS A, SARKAR B, et al. Modulation of secondary metabolism and redox regulation by exogenously applied glutathione improves the shelf life of Capsicum annuum L. fruit[J]. Plant Physiology and Biochemistry, 2024, 212: 108789. |
| [26] |
何平, 黄卓烈, 黎春怡, 等. 木瓜蛋白酶的固定化及其性质研究[J]. 热带亚热带植物学报, 2008, 16(4): 334-338. |
| [27] |
IDE Y, MATSUKAWA Y. Fabrication of functional diatomaceous earth with enhanced papain enzyme adsorption[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2024, 701: 134888. |
| [28] |
陈尚文, 邓乾春, 周彬, 等. 蛋白酶的固定化及其在食品工业中应用的研究进展[J]. 食品科学, 2024, 45(17): 253-264. |
| [29] |
SOROKIN A V, OLSHANNIKOVA S S, LAVLIN-SKAYA M S, et al. Chitosan graft copolymers with N-vinylimidazole as promising matrices for immobilization of bromelain, ficin, and papain[J]. Polymers, 2022, 14(11): 2279. |
| [30] |
RASHIDI Z, HOMAEI A, FERNANDEZ-LAFUEN- TE R. Enhanced stability of papain at extreme pHs and temperatures by its immobilization on cellulose nanocrystals coated with polydopamine[J]. Process Biochemistry, 2024, 146: 147-159. |
| [31] |
梁杰, 林国荣, 邹汉勋, 等. 基于聚乙烯亚胺改性纳米磁球的木瓜蛋白酶固定化[J]. 食品工业科技, 2024, 45(23): 151-160. |
| [32] |
HOLYAVKA M G, PANKOVA S M, VYSHKVOR-KINA Y M, et al. Chitosan and chitosan succinate as photoprotectors for papain immobilized on their matrix[J]. Biology Bulletin, 2023, 50(11): 3077-3086. |
| [33] |
BARTOCCINI F, RETINI M, CRINELLI R, et al. Dithiol based on L-cysteine and cysteamine as a disulfide-reducing agent[J]. The Journal of Organic Chemistry, 2022, 87(15): 10073-10079. |
| [34] |
RICHTER J K, WATANABE P, BERNIN J, et al. Cysteine, sodium metabisulfite, and glutathione enhance crosslinking between proteins during high moisture meat analog extrusion processing and may improve the fibrousness of the products[J]. Journal of the Science of Food and Agriculture, 2024, 104(12): 7488-7500. |
| [35] |
郑振慧, 窦世娟, 司贺龙, 等. 探索木瓜蛋白酶最适反应条件、固定化和制备结晶[J]. 农村科学实验, 2017(3): 103-105. |
| [36] |
韩佳钰, 黄业传, 代雯, 等. 蔗糖对木瓜蛋白酶活性影响及其分子机制[J]. 粮食与油脂, 2025, 38(1): 151-156. |



